猪表皮生长因子在植物乳杆菌中的表达及其活性检测
2015-12-29钟泽民赖强余希尧刘德辉黄毓茂
钟泽民,赖强,余希尧,刘德辉,黄毓茂
猪表皮生长因子在植物乳杆菌中的表达及其活性检测
钟泽民1*,赖强1*,余希尧1,刘德辉2,黄毓茂1
1 华南农业大学兽医学院,广东 广州 510642 2 广州沃德生物科技有限公司,广东 广州 510663

钟泽民, 赖强, 余希尧, 等. 猪表皮生长因子在植物乳杆菌中的表达及其活性检测. 生物工程学报, 2015, 31(9): 1325–1334.Zhong ZM, Lai Q, Yu XY, et al. Expression and characterization of porcine epidermal growth factor in Lactobacillusplantarum. Chin J Biotech, 2015, 31(9): 1325–1334.
为获得一株高效表达猪表皮生长因子 (pEGF) 的重组植物乳杆菌,并检测其生物活性,从仔猪肠道内容物中分离植物乳杆菌,选择其中生物活性最强的一株 (Lp-1) 为宿主。以商品化乳杆菌表达载体pIAβ8为骨架,干酪乳杆菌超强组成型启动子SCP、M6前体蛋白信号肽SP、猪表皮生长因子pEGF等为元件,构建表达pEGF的植物乳杆菌重组表达载体pSCPSE。用电转化方法 (2.0 kV,2 000 Ω,25 μF,4.0 ms) 将重组载体pSCPSE转化入宿主菌Lp-1中获得重组植物乳杆菌Lp-pSCPSE。以Tricine-SDS-PAGE法和pEGF ELISA特异性检测试剂盒检测目的蛋白的表达;用培养12 h的阳性转化子菌体给刚断奶的BALB/c小鼠灌胃,2次/d,连续10 d,以断奶小鼠的体重、肠绒毛长度和隐窝深度的变化为指标,检测目的蛋白的生物活性。Tricine-SDS-PAGE检测和小鼠实验结果显示,重组植物乳杆菌的培养上清中出现6 kDa左右pEGF的特异性条带,且表达pEGF的重组植物乳杆菌能显著增加(<0.05) 断奶小鼠的体重、肠绒毛高度和肠隐窝深度。结果表明,pEGF在植物乳杆菌中成功表达,且具有良好的生物学活性。
猪源乳酸杆菌,猪表皮生长因子 (pEGF),断奶小鼠,绒毛高度,隐窝深度
表皮生长因子 (Epidermal growth factor,EGF) 是一种高效的有丝分裂原,能刺激细胞增殖、分化,促进离子交换和细胞外基质合成,是哺乳动物乳中含量最高的生长因子之一。研究表明,猪表皮生长因子 (pEGF) 不仅能刺激初生仔猪的肠上皮发育[1],而且有利于猪早期胚胎的发育,提高仔猪的成活率[2]。Lee等的研究表明,pEGF能有效地刺激早期断奶仔猪的肠道发育及修复受损的肠道上皮细胞[3]。Chuang等发现,pEGF不仅能促进早期断奶仔猪的肠道发育,而且能促进空肠消化酶基因的表达和增强消化酶的活性[4]。为缩短母猪生育周期,生产中一般对仔猪进行早期断奶,而断奶应激是影响早期断奶仔猪的生产性能的主要原因之一。通过在日粮中添加适量的pEGF可有效缓解早期断奶仔猪的断奶应激,有利于仔猪生产性能的提高[5]。
植物乳杆菌作为肠道正常菌群,能粘附于消化道上皮细胞[6],产生各种抑菌活性物质[7-8],改善肠道环境。由于其安全性和多种益生特点,近年来,乳杆菌作为外源蛋白的表达宿主,已被国内外研究人员广泛用于各项研究。庾庆华等[9]分离鸡源乳杆菌,并以其为载体宿主,成功表达了绿色荧光蛋白;李一经等[10]利用短乳杆菌S层启动子构建乳酸杆菌表达系统成功表达了TGEV的N蛋白;Sasikumar等[11]在植物乳杆菌中表达草酸脱羧酶,能有效降解小鼠的肾结石。
基于乳杆菌的诸多优点,若以乳杆菌为表达宿主表达pEGF,并将其应用到临床上,则可能对断奶仔猪的生产性能的提高具有重大意义。本研究为获得高效表达pEGF的重组乳杆菌,分离鉴定了一株具有较广谱抑菌活性的植物乳杆菌为宿主,以pIAβ8为载体骨架构建表达载体,成功表达了pEGF,为生产上缓解仔猪断奶应激、促进断奶仔猪生长提供参考。
1 材料与方法
1.1 材料
新鲜仔猪肠道内容物于中山市某农场采集;SPF 级BALB/c小鼠购自南方医科大学实验动物中心;MRS培养基为海博公司产品;乳杆菌鉴定试剂盒为环凯公司产品;质粒小量提取试剂盒购自Omega公司;各种基因克隆试剂购于TaKaRa公司;载体质粒购于Biovector公司;指示菌株为本实验室保存;其他试剂为国产分析纯。
1.2 植物乳杆菌的初步分离
取28 日龄新鲜断奶仔猪肠道内容物0.5 g置于4.5 mL灭菌生理盐水中,摇匀。进行梯度稀释,稀释至第7个梯度,吸取10–5、10–6、10–7梯度稀释液100 μL于固体MRS培养基平板上均匀涂布。将上述平板置于37 ℃恒温培养箱培养48 h,挑选形状规则、活性高的单菌落10株,反复划线纯化获得纯菌株。分别将单菌落接入MRS液体培养基中标号L1–L10,37 ℃培养24 h后,分别取各菌株的10–7梯度稀释液100 μL,置于无菌平皿中,倾入已经融化并冷却至45 ℃左右的MC培养基13–15 mL,立即混匀,待凝固后倒置培养。溶钙检测后,将分离纯化出来的菌株接种于冻存液中,编号后收存于–80 ℃冰箱。对产溶钙环的菌株进行革兰氏染色,在光学显微镜下观察其菌体特征。
1.3 植物乳杆菌的初步鉴定
参照乳杆菌生化鉴定试剂盒说明,对镜检为革兰氏阳性杆菌的菌株进行鉴定。对鉴定阳性的菌株进行编号保存,并以Excel 2010软件绘制其菌液值和pH值随时间的变化曲线 (图1)。
1.4 抑菌活性菌株的筛选
将鉴定为乳杆菌阳性的菌株分别接种到MRS液体培养基中,培养24 h后,取菌液20 mL,5 000×g离心10 min,取其上清液,以管-碟法测试菌液上清对大肠杆菌、金黄色葡萄球菌的抑菌活性。挑选抑菌活性最强的一株乳杆菌,命名为Lp-1。
1.5 16S rRNA鉴定
根据乳杆菌的16S rRNA基因序列的保守区域,设计16S rRNA扩增引物P1、P2 (表1),对Lp-1进行16S rRNA鉴定。PCR反应条件为:94 ℃ 5 min,94 ℃ 1 min,55 ℃ 50 s,72 ℃ 2 min,30个循环;72 ℃终延伸10 min。PCR产物送Invitrogen公司测序,测序结果与GenBank中同源序列 (Accession No. NC_004567.2) 进行比对后确定Lp-1的种属。

图1 宿主菌Lp-1菌液在24 h内OD值和pH值的变化趋势

表1 本研究所用PCR引物序列
Primers utilized in this study. Underlined regions of the primer sequences represent the restriction endonuclease sites.
1.6 重组表达载体的构建
从GenBank中获得超强启动子序列 (Accession No. FW501695) SCP,根据其序列用软件Primer premier 6.0设计PCR引物P3、P4,并在P3的5ʹ端引入酶切位点Ⅰ,在P4的5ʹ端引入酶切位点HⅠ。以干酪乳杆菌CETC5276的基因组为模板,P3、P4为引物扩增出超强启动子SCP,将其克隆入pMD-19T载体中构建克隆载体pT-SCP。利用限制性内切酶Ⅰ和HⅠ对pT-SCP进行双酶切后,回收目的片段SCP,转而克隆入经过相同酶切处理的表达载体pIAβ8中[12],成功构建载体pSCP。
从文献[13]中获得M6前体蛋白信号肽序列 (SP),该信号肽由141个碱基组成,能有效地将目的蛋白转移到胞外。从GenBank中获取猪表皮生长因子 (pEGF) 的基因序列 (Accession No. X59516)。在片段SP的5ʹ端和3ʹ端分别引入酶切位点Ⅰ和Ⅰ,在片段pEGF的5ʹ端和3ʹ端分别引入酶切位点Ⅰ和RⅠ,然后根据植物乳杆菌的密码子偏嗜性对上述两段序列进行密码子优化后送Invitrogen公司合成。
将合成片段通过常规的基因克隆方法依次克隆入表达载体pSCP中,然后将连接产物转化入DH5α感受态细胞中,挑取阳性转化子,进行酶切鉴定和测序鉴定,最后获得表达pEGF的重组载体pSCPSE,用于植物乳杆菌的电 转化。
1.7 植物乳杆菌感受态细胞的制备及电转化
植物乳杆菌Lp-1的感受态细胞的制备参考Mason[14]和Luchansky[15]的方法,并改进如下:挑取新鲜培养Lp-1的单菌落,接种于5 mL的MRS培养液中,37 ℃培养过夜;吸取1 mL过夜培养的菌液,接种于含2%甘氨酸 (/) 的99 mL的MRS液中,37 ℃培养至590为0.6左右,再冰浴10 min,使细菌停止生长。4 ℃、8 000×g离心5 min收集菌体,然后以冰冷的SMEB (1 mol/L蔗糖、25 mmol/L MgCl2) 缓冲液洗涤菌体3次,最后用SMEB缓冲液将菌体重悬至原菌液浓度的50倍,每管100 μL分装置冰中备用。
将7 μL (10 ng/μL) 重组载体pSCPSE与100 μL上述感受态细胞混匀,转移至预冷的 2 mm电转杯 (Bio-Rad) 中,静置30 min,然后以Bio-Rad 电转仪进行电击转化。电转参数为2.0 kV,2 000 Ω,25 μF[16],脉冲时间约为4.0 ms。电转后以900 μL预冷的MRS液重悬,冰浴20 min后置37 ℃孵育3 h。
1.8 阳性转化子的筛选及表达产物的鉴定
取适量的电转-孵育后菌液涂布于20 μg/mL的氯霉素抗性MRS平板中,37 ℃培养24–48 h,参照庾庆华等[9]的方法挑取单菌落,以P5、P6 (表1) 为引物做菌落PCR鉴定。鉴定为阳性的菌株命名为Lp-pSCPSE。将转化了空载体EV和重组载体pSCPSE的植物乳杆菌分别接种于含氯霉素抗性的MRS液体培养基中,37 ℃培养过夜。次日将上述过夜培养的菌液按2%的比例接种于适量MRS液中,37 ℃培养24 h后取其上清。用截留分子量为10 kDa的超滤离心管过滤上清后取≤10 kDa的滤过液,置于真空干燥箱中浓缩20倍。以Tricine-SDS-PAGE法对上述浓缩液中的目的蛋白进行检测,同时设立相应浓度的空载体组和标准品阳性对照组。
以猪表皮生长因子 (pEGF) ELISA特异性检测试剂盒 (环凯公司) 分别检测Lp-pSCPSE 在37 ℃培养12、24、36、48 h后上清中pEGF的含量。用曲线拟合软件Cruver Expert 1.3选择拟合度最高的浓度-值曲线,得出拟合方程,然后计算出相应样品浓度。
1.9 目的蛋白生物活性的检测
将37 ℃培养12 h的重组植物乳杆菌Lp-pSCPSE菌液离心取菌体,以无菌PBS洗涤2次后重悬至浓度约为2.0×109CFU/mL备用,以相同方法制备空载体重组植物乳杆菌Lp-EV备用。19–21日龄BALB/c断奶小鼠随机分为PBS、空载体 (EV)、重组pEGF植物乳杆菌 (pEGF)、重组人源EGF (rhEGF) 4组,每组10只,并记录各组每只小鼠的体重。
每组灌胃给药量如下:PBS组、EV组和EGF组各300 μL/只,rhEGF标准品对照组按 50 μg/kg[17]给药,2次/d,持续10 d。实验第10天处死所有实验小鼠,称重后分别在距小肠各段 (十二指肠、空肠、回肠) 起始处1–2 cm间各取0.5 cm肠道为样品,以无菌PBS冲洗后置于10%甲醛溶液中固定过夜。固定后的组织以石蜡包埋后切片 (5 μm),再以苏木精和伊红 (HE) 染色做组织学检查,测定各实验组肠绒毛高度和隐窝深度[17]。
2 结果
2.1 有抑菌活性的植物乳杆菌的分离和鉴定
生化鉴定结果显示,本研究分离的革兰氏阳性杆菌菌株对七叶苷、纤维二糖、麦芽糖、甘露糖、水杨苷、山梨醇、蔗糖、棉籽糖等均呈阳性反应,初步鉴定为植物乳杆菌。管-碟法检测该菌37 ℃培养24 h上清对大肠杆菌、金黄色葡萄球菌的抑菌效果分别为19 mm和20 mm抑菌圈 (牛津杯外径为8 mm) (图2)。
Lp-1的16S rRNA测序结果经Blast序列比对后显示,该菌株与WCFS1株同源性最高,即本研究分离的菌株属于植物乳杆菌。16S rRNA测序结果略。
2.2 重组表达载体的构建
经琼脂糖凝胶电泳鉴定,超强启动子SCP的PCR产物长度约为400 bp,M6前体蛋白信号肽SP的基因片段长度约为150 bp,猪表皮生长因子pEGF的基因片段长度约为170 bp,均与预期片段长度相符。将上述各片段分别通过相应的酶切位点克隆到骨架质粒中构建重组载体,再对重组载体进行双酶切鉴定,结果在750 bp左右出现条带,与插入的目的条带SCP、SP和pEGF总长一致(图3)。测序鉴定结果与实验设计序列完全一致,证明表达pEGF的重组表达载体pSCPSE构建成功。

图2 管-碟法检测Lp-1 37 ℃培养24 h的菌液上清对大肠杆菌K99和金黄色葡萄球菌ATCC29213的抑菌效果

图3 重组载体pSCPSE的双酶切鉴定
2.3 电转后阳性转化子的筛选
用pSCPSE电转Lp-1的感受态,涂布于氯霉素抗性MRS平板培养,获得多个单菌落。以溶菌液[9]预先处理单菌落后取之为模板,以P5、P6为引物做菌落PCR鉴定,PCR产物通过琼脂糖凝胶电泳鉴定与预期条带大小相符 (结果未显示)。表明重组载体成功电转入宿主菌Lp-1中。
2.4 阳性转化子培养上清表达产物的分析
在阳性转化子Lp-pSCPSE的培养上清中检测出特异性条带,大小约为6 kDa左右,与标准品阳性对照组大小相同,而空载体组的培养上清未检测到特异性条带(图4)。表明重组载体pSCPSE成功电转化入植物乳杆菌Lp-1中,且在信号肽SP的引导下,目的蛋白成功分泌到胞外。用猪表皮生长因子 (pEGF) ELISA特异性检测试剂盒检测Lp-pSCPSE在37 ℃培养12、24、36、48 h后上清中的pEGF (表2)。以曲线拟合软件Curve Expert 1.3分析ELISA数据后得到拟合度最高的浓度-值曲线,拟合方程为=a+b+c2+d3(a、b、c、d为拟合方程常数,为样品值,为样品浓度)。经计算,重组植物乳杆菌Lp-pSCPSE培养24 h后上清中pEGF的浓度达最大值为280 ng/mL。
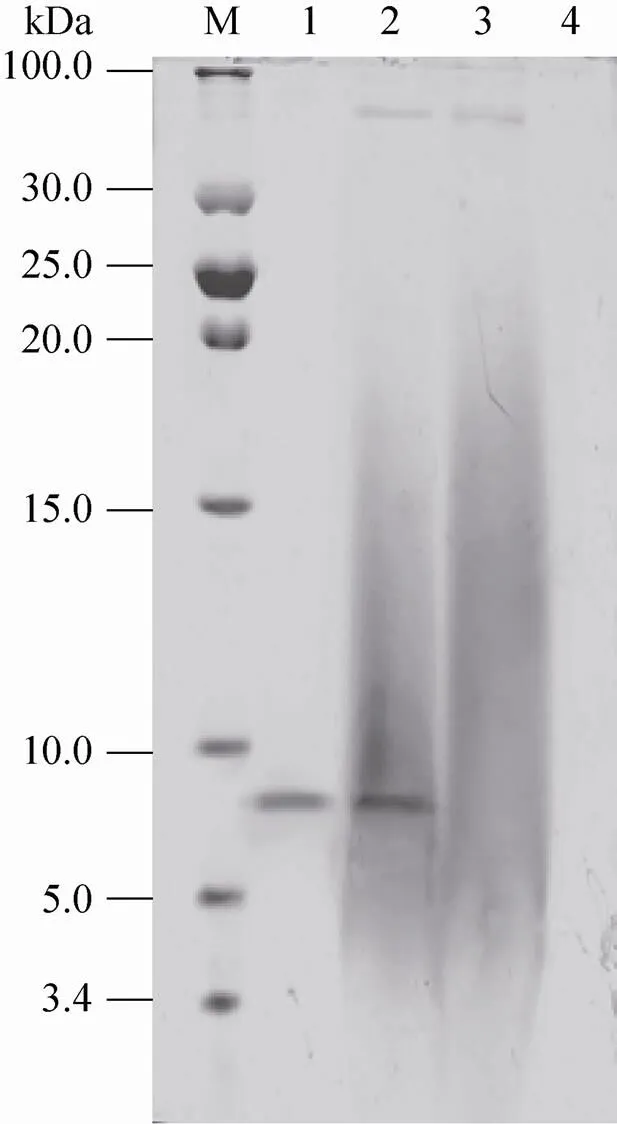
图4 重组植物乳杆菌培养上清浓缩液的Tricine- SDS-PAGE鉴定

表2 重组植物乳杆菌菌液ELISA检测结果
2.5 重组植物乳杆菌生物活性的检测
以表达pEGF的重组植物乳杆菌Lp-pSCPSE、电转化空载体质粒的植物乳杆菌Lp-EV、rhEGF标准品和PBS分别对断奶的BALB/c小鼠进行灌胃实验。结果表明重组乳杆菌Lp-pSCPSE能有效促进断奶小鼠体重的增加,数据统计结果显示,与Lp-EV组和PBS组相比,Lp-pSCPSE组和rhEGF组增重差异显著 (字母不同表示差异显著) (图5)。
石蜡切片后,参考Cheung等[17]的方法,用Leica LAS Extended Annotation显微图像分析软件对各实验组小鼠的十二指肠、空肠、回肠进行组织学检查及数据测量,统计分析结果显示Lp-pSCPSE组和rhEGF组的各肠段肠绒毛长度和隐窝深度与Lp-EV组和PBS组相比差异显著 (字母不同表示差异显著) (图6)。

图5 不同处理组10 d后实验小鼠增重的对比(字母不同表示差异显著,P<0.05)

图6 表达pEGF的重组植物乳杆菌Lp-pSCPSE对BALB/c早期断奶小鼠肠绒毛高度 (A) 及肠隐窝深度 (B)的影响
3 讨论
pEGF作为一种活性小肽,在促使肠道上皮细胞的正常分裂增殖过程中的作用不可或缺[18-19]。其在畜牧业生产,尤其是在提高断奶仔猪生产性能中有良好的应用前景。近年来,随着国内外研究的深入,已经实现了pEGF在大肠杆菌、酵母菌、乳酸乳球菌等多种宿主菌中的表达和应用[3,5]。但pEGF在这些宿主中表达存在各自的不足之处:大肠杆菌表达系统表达小肽易形成包涵体,且产物中内毒素的去除过程繁复;酵母表达系统表达pEGF后虽纯化过程相对简易,但酵母菌不是猪肠道正常定殖菌,无法持续为断奶仔猪提供pEGF,给实际生产操作带来不便;乳酸乳球菌虽为猪肠道内正常菌群,但其对猪肠道黏膜的粘附性和产乳酸能力不佳。为克服上述表达系统的不足,本研究以分离的仔猪源植物乳杆菌为宿主表达pEGF;该菌分离自仔猪肠道,对猪肠道黏膜有很强的粘附性,其发酵液中乳酸浓度高,pH值可达3.8,在降低仔猪消化道pH值,限制肠道内嗜碱性细菌数量起重要作用。此外,Park等[20]研究发现,以植物乳杆菌喂养小鼠能有效缓解小鼠因高脂食物而导致的肥胖症状;将植物乳杆菌与多重耐药的铜绿假单胞菌共培养时,能降低铜绿假单胞菌的毒性[21];还有研究表明植物乳杆菌能对内毒素引起的肝损伤和小鼠急性镉中毒起保护作用[22]。
pEGF作为一种生长因子,仅需微量便可在机体内产生相应的生物学功能。Cheung等[17]研究发现,1 ng/mL浓度的EGF与25 ng/mL浓度的EGF对小鼠的肠绒毛的促生长作用无显著差异。而本研究构建的重组植物乳杆菌表达的pEGF可达280 ng/mL,满足机体对该生长因子的需要。Wang等[23]研究发现,与传统的抗生素相比,表达EGF的乳酸菌不仅能有效地控制猪肠道内的大肠杆菌、肠球菌等有害菌的数量,而且能促进肠道内其他益生菌的生长,从而改善肠道菌群。以本研究构建的重组植物乳杆菌饲喂小鼠,小鼠的肠绒毛高度和隐窝深度与对照组相比都有明显差别,说明重组植物乳杆菌进入小鼠消化道后能在消化道内正常生长并分泌表达pEGF,有效促进肠上皮细胞的增生。在停止饲喂重组乳杆菌后的第10天,仍能从小鼠粪便分离的植物乳杆菌中检测到pEGF目的基因存在,证明本研究构建的重组植物乳杆菌能有效地在小鼠消化道内定殖,且持续性地产生pEGF,有助于修复肠道损伤,促进肠道发育。因此,表达pEGF的植物乳杆菌作为一种减缓仔猪断奶应激的微生态制剂,具有重大的临床推广意义。传统的抗仔猪断奶应激剂主要由微量元素、微量元素氨基酸螯合物及各种稀释剂和载体物质组成,对仔猪的生长发育存在一定影响,且抗应激效果不理想。本研究采用益生型植物乳杆菌为宿主表达pEGF,不仅有利于猪肠道内菌群稳态的维持,而且能有效抗仔猪断奶应激。本研究的开展对益生型植物乳杆菌的临床应用及其潜力开发提供相应的理论依据。
[1] Abud HE, Watson N, Heath JK. Growth of intestinal epithelium in organ culture is dependent on EGF signaling. Exp Cell Res, 2005, 303(2): 252–262.
[2] Abeydeera LR, Wang WH, Cantley TC, et al. Presence of epidermal growth factor duringmaturation of pig oocytes and embryo culture can modulate blastocyst development afterfertilization. Mol Reprod Dev, 1998, 51(4): 395–401.
[3] Lee DN, Kuo TY, Chen MC, et al. Expression of porcine epidermal growth factor inand its biology activity in early-weaned piglets. Life Sci, 2006, 78(6): 649–654.
[4] Lee DN, Chuang YS, Chiou HY, et al. Oral administration recombinant porcine epidermal growth factor enhances the jejunal digestive enzyme genes expression and activity of early-weaned piglets. J Anim Physiol Anim Nutr, 2008, 92(4): 463–470.
[5] Kang P, Toms D, Yin YL, et al. Epidermal growth factor-expressingenhances intestinal development of early-weaned pigs. J Nutr, 2010, 140(4): 806–811.
[6] Van Tassell ML, Miller MJ.adhesion to mucus. Nutrients, 2011, 3(12): 613–636.
[7] Drider D, Fimland G, Hechard Y, et al. The continuing story of class IIa bacteriocins. Microbiol Mol Biol Rev, 2006, 70(2): 564–582.
[8] Peng X, Jiang Y. Protective effects ofNDC 75017 against lipopolysaccharide-induced liver injury in mice. Inflammation, 2014, 37(5): 1599–1607.
[9] Yu QH. The expression of GFP in the chicken'sand distribution of the recombinant bacterium after oral administration in the small intestine of chicken [D]. Nanjing: Nanjing Agricultural University, 2006 (in Chinese).庾庆华. 绿色荧光蛋白在鸡源乳酸杆菌中的表达及该重组菌口服后在小肠中的分布[D]. 南京: 南京农业大学, 2006.
[10] Li YJ, Qin S, Tang LJ, et al. Construction of constitutive expression system based onS layer promoter. J Northeast Agri Univ, 2013, 44(6): 125–130 (in Chinese).李一经, 秦思, 唐丽杰, 等. 基于短乳杆菌S层启动子组成型乳酸杆菌表达系统的构建. 东北农业大学学报, 2013, 44(6): 125–130.
[11] Sasikumar P, Gomathi S, Anbazhagan K, et al. Recombinantexpressing and secreting heterologous oxalate decarboxylase prevents renal calcium oxalate stone deposition in experimental rats. J Biomed Sci, 2014, 21: 86.
[12] Zuo RY, Chang J, Yin QQ, et al. Phytase gene expression inand analysis of its biochemical characteristics. Microbiol Res, 2010, 165(4): 329–335.
[13] Dieye Y, Usai S, Clier F, et al. Design of a protein-targeting system for lactic acid bacteria. J Bacteriol, 2001, 183(14): 4157–4166.
[14] Mason CK, Collins MA, Thompson K. Modified electroporation protocol forisolated frorn the chicken crop facilitates transformation and the use of a genetic tool. J Microbiol Meth, 2005, 60(3): 353–363.
[15] Luchansky JB, Kleeman EG, Raya RR, et al. Genetic transfer systems for delivery of plasmid deoxyribonucleic acid toADH conjugation, electroporation, and transduction. J Dairy Sci, 1989, 72(6): 1408–1417.
[16] Alegre MT, Rodriguez MC, Mesas JM. Transformation ofby electroporation withmodified plasmid DNA. FEMS Microbiol Lett, 2004, 241(1): 73–77.
[17] Cheung QCK, Yuan ZF, Dyce PW, et al. Generation of epidermal growth factor-expressingand its enhancement on intestinal development and growth of early-weaned mice. Amer Soc Nutr, 2009(89): 871–879.
[18] Bedford A, Huynh E, Fu M, et al. Growth performance of early-weaned pigs is enhanced by feeding epidermal growth factor-expressingfermentation product. J Biotechnol, 2014, 173: 47–52.
[19] Bashir O, Fitzgerald AJ, Berlanga-Acosta J, et al. Effect of epidermal growth factor administration on intestinal cell proliferation, crypt fission and polyp formation in multiple intestinal neoplasia (Min) mice. Clin Sci (Lond), 2003, 105(3): 323–330.
[20] Park JE, Oh SH, Cha YS.LG42 isolated from gajami sik-hae decreases body and fat pad weights in diet-induced obese mice. J Appl Microbiol, 2014, 116(1): 145–156.
[21] Joshi S, Kaur A, Sharma P, et al. Lactonase-expressingNC8 attenuates the virulence factors of multiple drug resistantin co-culturing environment. World J Microbiol Biotechnol, 2014, 30(8): 2241–2249.
[22] Zhai Q, Wang G, Zhao J, et al. Protective Effects ofCCFM8610 against acute cadmium toxicity in mice. Appl Environ Microb, 2013, 79(5): 1508–1515.
[23] Wang D, Xu S, Lin Y, et al. Recombinant porcine epidermal growth factor-secretingpromotes the growth performance of early-weaned piglets. BMC Vet Res, 2014, 171(10): 1–12.
(本文责编 郝丽芳)
Expression and characterization of porcine epidermal growth factor in
Zemin Zhong1*, Qiang Lai1*, Xiyao Yu1, Dehui Liu2, and Yumao Huang1
1College of Veterinary Medicine, South China Agricultural University, Guangzhou 510642, Guangdong, China 2 Guangzhou Well Biotechnology Co. LTD, Guangzhou 510663, Guangdong, China
Epidermal growth factor (EGF) is an epithelial cell growth factor that can stimulate intestinal development, repair the damage of epidermal cells as well as reduce the incidence of pathogen infection and diarrhea. In order to produce a recombinantexpressing porcine epidermal growth factor (pEGF), we constructed a recombinant vector stably expressing pEGF instrainsFirst,strain Lp-1 was isolated from intestinal contents of piglets. Then the functional domain of pEGF, M6 precursor protein signal peptide (SP) and super strong constitutive promoter (SCP) were connected with the backbone plasmid pIAβ8 to construct the recombinant vector that was transformed intoLp-1 by electroporation. Afterwards, pEGF was expressed in Lp-1 and detected by Tricine-SDS-PAGE and ELISA. After orally irrigated early-weaned BALB/c mice with the recombinantevery morning and late afternoon for 10 consecutive days, body weight, villous height and crypt depth in the intestine were measured to examine the influence of the recombinant bacteria on the intestinal development of early-weaned mice. Finally, the results of our experiments demonstrated that pEGF was successfully expressed in Lp-1 and the molecular weight of pEGF was 6 kDa. In addition, the recombinant pEGF can enhanced the daily gain and exerted significance influence (<0.05) to the small intestinal morphology of early-weaned BALB/c mice. In conclusion, pEGF could be expressed inand the recombinant pEGF possesses good biological activity.
, porcine epidermal growth factor (pEGF), early-weaned mice, villus height, crypt depth
10.13345/j.cjb.140544
November 11, 2014; Accepted:March 25, 2015
Yumao Huang. E-mail: ymaohuang@scau.edu.cn
*These authors contributed equally to this study.
