老年胃癌患者术后早期肠外联合肠内营养支持对其预后的影响
2015-12-29郑云丽
·肿瘤·
老年胃癌患者术后早期肠外联合肠内营养支持对其预后的影响
郑云丽
(乐清市人民医院肿瘤外科,浙江乐清325600)
摘要〔〕目的探讨肠外营养支持(PN)联合肠内营养支持(EN)对老年胃癌(GC)患者术后营养和免疫功能的恢复价值。方法选择老年GC患者40例,将患者分随机分为观察组和对照组,每组20例。观察组患者术后给予PN联合EN支持,而对照组术后仅给予PN支持。比较两组患者术前和手术10 d后的免疫功能指标CD4+、CD4+/CD8+、IgA、IgG、营养指标〔血清白蛋白(ALB)、转铁蛋白(TF)和24 h尿素氮(24 h UP)〕以及并发症发生情况。结果两组术前CD4+、CD4+/CD8+、IgA、IgG、ALB、TF和24 h UP,差异无统计学意义(P>0.05);术后10 d,观察组患者免疫指标CD4+、CD4+/CD8+、IgA、IgG明显高于对照组(P<0.05);且ALB、TF和24 h UP与对照组差异显著(P<0.05);观察组患者并发症发生率(10.0%)明显低对照组(25.0%,P<0.05)。结论对老年GC患者术后给予EN联合PN支持有利于GC患者免疫力提升和营养的改善,并能降低并发症。
关键词〔〕肠内营养支持;肠外营养支持;免疫功能;胃癌
中图分类号〔〕R73〔文献标识码〕A〔
第一作者:郑云丽(1978-),女,主管护师,主要从事肿瘤外科护理研究。
随着人口老龄化进程的加剧,老年胃癌(GC)患者的数量逐年增加。但是由于GC发病隐匿,症状不明显,多数患者发病后已属于中晚期,老年GC患者往往存在不同程度的影响不良和免疫功能低下,手术创伤又会使分解代谢增加,机体营养消耗增多,从而产生营养不良,导致并发症风险增加,延迟患者的康复,降低其生存质量。因此,改善老年GC患者术后营养状况,提高术后免疫力,以防止或减少术后并发症的发生已成为当今外科研究的热点课题。术后肠内营养支持(EN)是指在手术后的早期经鼻胃管、胃、空肠造口等途径输送营养物质,以满足机体代谢需求的一种营养支持治疗的方式。研究表明在肠胃外科患者术后行EN具有可行性和有效性〔1〕。EN不仅为患者提供了一定的热量和底物,维持肠黏膜结构和功能的完整,而且可有效预防和减少术后并发症的发生。肠外营养支持(PN)是比较成熟的营养支持方式,研究显示,PN可以显著降低患者术后出现的不良反应和并发症〔2,3〕。本文探讨老年GC患者给予术后PN联合EN支持对其预后的影响。
1对象与方法
1.1研究对象选择自2011年8月至2012年12月期间在我院住院治疗并在术后接受营养支持的老年GC患者40例。纳入标准:①确诊为GC并拟行手术,可耐受手术并最终接受手术治疗的患者,年龄65~80岁;②患者依从性较好,配合研究;③患者病历资料完全,且知情受试。排除标准:①排除存在严重心、肺、肾功能障碍,内分泌代谢或免疫系统疾病,严重感染及水、电解质平衡紊乱者;②排除不能耐受肠内营养者;③排除近期使用干扰研究的药物治疗,包括激素、蛋白、免疫抑制剂等药物。将患者分为观察组20例和对照组20例。观察组男13例,女7例,年龄67~78〔平均(71.2±8.2)〕岁。对照组男15例,女5例,年龄66~80〔平均(72.1±6.8)〕岁。两组患者一般资料相比,差异不显著,因此具有可比性。本次研究在患者及其家属签字同意的情况下进行。
1.2护理方法观察组患者术后给予EN支持联合PN,而对照组术后仅给予PN支持。EN:液体量2 000 ml,包含糖200 g,Nacl 4.5 g,10% KCl 40 ml,多种维生素及微量元素混合输注。应用肠内营养输注系统输注(Flocare800,Nutricia公司制造),营养制剂选择Nutricia公司营养制剂能全力。于术后12 h开始按Harris-Benedict公式计算的机体基础能量消耗量的1/8应用肠内营养泵缓慢泵入,视患者情况逐渐调整剂量。具体实施于术后当天12 h应用100 ml,若无不适主诉则术后第1天应用200 ml,第二天应用300 ml,视患者具体反映而定,第3至第7天随着肠内营养泵入量增多,动态调节肠外营养的液体量及能量〔4〕。输注时注意患者反应及营养液温度。通常应维持于32℃以上。避免冷刺激带来的不适感。PN:建立静脉通道,通过静脉通道将一定量氨基酸、脂肪乳剂和葡萄糖输入患者体内,高营养液的配制严格按照无菌操作进行,并保证24 h内消耗完。
1.3观察指标统计两组患者术前和手术10 d后的免疫功能指标CD4+、CD4+/CD8+、IgA、IgG、营养指标〔血清白蛋白(ALB)、转铁蛋白(TF)和24 h尿素氮(24 h UP)〕以及并发症发生情况。CD4+、CD8+、ALB、TF和24 h UP由迈瑞公司生产的BS-300全自动生化分析仪及配套试剂进行测量。IgA、IgG由罗氏公司生产的Cobase 411电化学发光全自动免疫分析仪及配套试剂进行测量。实验操作严格按照试剂说明书步骤进行,严格每日质控,并按照定标频率要求对试剂进行定标。
1.4统计学方法采用SPSS13.0软件行t及χ2检验。
2结果
2.1两组患者术后10 d免疫功能指标比较两组术前CD4+、CD4+/CD8+、IgA、IgG相比,差异不显著(P>0.05);术后10 d,观察组患者免疫指标CD4+、CD4+/CD8+、IgA、IgG明显高于对照组(P<0.05)。见表1。
2.2两组患者手术10 d后营养指标比较两组术前ALB、TF和24 h UP相比,差异不显著(P>0.05);术后10 d,观察组患者免疫指标ALB、TF和24 h UP明显高于对照组(P<0.05)。见表2。
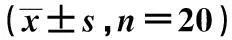
表1 两组患者术前术后10 d免疫功能指标比较
两组相比:1)P<0.05
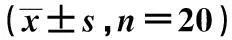
表2 两组患者术前及术后10 d后营养指标比较
2.3两组患者术后并发症发生情况比较观察组患者并发症发生率明显低于对照组(χ2=2.196,P=0.043)。见表3。
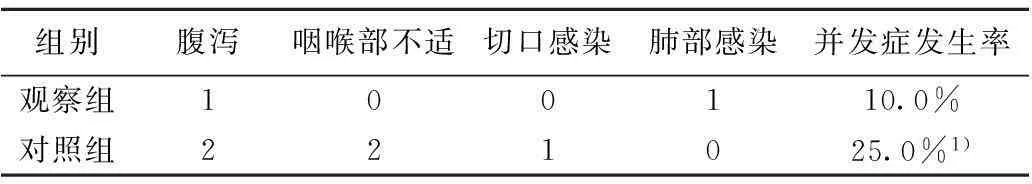
表3 两组患者术后并发症发生情况比较( n, n=20)
与观察组比较:1)P<0.05
3讨论
改善老年GC患者术后营养状况,提高术后免疫力,以防止或减少术后并发症的发生已成为当今外科研究的热点课题〔4〕。EN的作用包括预防胃肠道黏膜萎缩、衰减损伤引起的应激反应、维护免疫功能和保持正常的肠道菌群。在晚期肿瘤手术患者中的作用已经有多项报道,这些研究涉及食道癌、胃癌、胰腺癌和远端胆管肿瘤的患者〔5~7〕。
EN的优点在于能够促进肠蠕动恢复,保证食物的吸收,防止肠黏膜的萎缩,有助于维持肠黏膜结构和屏障功能的完整性,增进静脉系统的血流,刺激胃肠激素分泌,防止细菌移位〔8,9〕。因而能够减少术后感染,改善营养状态,迅速恢复体力,提高机体免疫功能。为临床实际运用中寻找一种有效的营养支持方法,选择适当的观测指标以评价肠内、肠外营养的效果显得尤为重要〔10〕,在评价指标的选取上,体重是较为粗略的指标,ALB可反映机体蛋白营养状况,总蛋白、ALB、TF等指标较为常用〔11〕,其均在肝脏合成,外科手术应激时下降,与患者并发症和死亡率相关,因此可作为判断预后的指示物。本研究表明两种营养支持方式联合对于老年GC患者营养指标的恢复效果更为显著。
体液免疫是机体抗细菌、毒素及病毒的重要防线。CD4+、CD4+/CD8+、IgA、IgG构成体液免疫的主要抗体,是人体免疫功能的重要指标〔12,13〕。而肿瘤患者免疫功能往往受到抑制,营养不良可导致免疫功能低下,手术应激将加重免疫抑制状态,表现为循环中辅助性淋巴细胞亚群CD4+减少,抑制性淋巴细胞亚群CD8+相对增加,CD4+/CD8+比例下降〔14,15〕。本研究提示联合营养支持不仅促进了患者营养改善,还能修复免疫功能,有利于改善患者的预后。
综上所述,对老年GC患者术后给予EN联合PN支持有利于患者免疫力提升和营养的改善,并能降低并发症的风险。
4参考文献
1Mariette C,De Botton ML,Piessen G.Surgery in esophageal and gastric cancer patients:what is the role for nutrition support in your daily practice〔J〕?Ann Surg Oncol,2012;19(7):2128-34.
2谢小平,揭志刚,李正荣,等.术后早期肠外联合肠内营养支持治疗对老年胃癌病人临床预后的影响〔J〕.肠外与肠内营养,2012;19(1):43-5,49.
3Kim HU,Chung JB,Kim CB.The comparison between early enteral nutrition and total parenteral nutrition after total gastrectomy in patients with gastric cancer:the randomized prospective study〔J〕.Korean J Gastroenterol,2012;59(6):407-13.
4黄国强,于吉人,冯永生,等.老年胃癌患者术后早期肠内与肠外营养的比较〔J〕.中国老年学杂志,2012;32(9):1839-40.
5Barlow R,Price P,Reid TD,etal.Prospective multicentre randomised controlled trial of early enteral nutrition for patients undergoing major upper gastrointestinal surgical resection〔J〕.Clin Nutr,2011;30(5):560-6.
6陶芝英,李刚.胃癌术后早期肠内营养与肠外营养的疗效比较〔J〕.中国医药导报,2013;10(25):28-30.
7Miyata H,Yano M,Yasuda T,etal.Randomized study of clinical effect of enteral nutrition support during neoadjuvant chemotherapy on chemotherapy-related toxicity in patients with esophageal cancer〔J〕.Clin Nutr,2012;31(3):330-6.
8张亚冰.胃癌全胃切除术后早期肠内营养支持的临床研究〔J〕.重庆医学,2011;40(16):1579-81.
9Seike J,Tangoku A,Yuasa Y,etal.The effect of nutritional support on the immune function in the acute postoperative period after esophageal cancer surgery:total parenteral nutrition versus enteral nutrition〔J〕.J Med Invest,2011;58(1,2):75-80.
10许晓东,孙元水,邵钦树,等.肠内免疫营养对胃癌患者术后肠黏膜屏障功能的影响〔J〕.中华胃肠外科杂志,2011;14(6):436-9.
11Seres DS,Valcarcel M,Guillaume A.Advantages of enteral nutrition over parenteral nutrition〔J〕.Ther Adv Gastroenterol,2013;6(2):157-67.
12张伦,余硕,何剪太,等.早期肠内营养支持对腹部手术患者免疫功能的影响〔J〕.中国老年学杂志,2012;32(5):1060-1.
13Alshadwi A,Nadershah M,Carlson ER,etal.Nutritional considerations for head and neck cancer patients:a review of the literature〔J〕.J Oral Maxillof Surg,2013;71(11):1853-60.
14王晓君,许勤,陈丽,等.胃癌术后序贯性早期肠内营养支持的临床效果及卫生经济学评价〔J〕.肠外与肠内营养,2013;20(6):348-52.
15Park JS,Chung HK,Hwang HK,etal.Postoperative nutritional effects of early enteral feeding compared with total parental nutrition in pancreaticoduodectomy patients:a prosepective,randomized study〔J〕.J Korean Med Sci,2012;27(3):261-7.
〔2014-04-18修回〕
(编辑安冉冉/曹梦园)
