艾灸对类风湿关节炎模型大鼠滑膜病变的影响
2015-12-29江星,孙志岭,周丹萍等
艾灸对类风湿关节炎模型大鼠滑膜病变的影响
江星孙志岭周丹萍徐骁王苗苗王富强1许志洋1纪伟2
(南京中医药大学护理学院,江苏南京210023)
摘要〔〕目的应用蛋白质组学技术观察艾灸对类风湿关节炎模型大鼠滑膜病变的影响。方法48只雄性SD大鼠,随机选取6只作为正常组,余42只建立Ⅱ型胶原诱导的关节炎模型,其中造模成功的36只随机分为6组:艾灸Ⅰ、Ⅱ、Ⅲ组,模型Ⅰ、Ⅱ、Ⅲ组,每组6只。艾灸组选取双侧“足三里”、“肾俞”穴治疗,Ⅰ、Ⅱ、Ⅲ组分别干预1、2、3 w。模型组不治疗。7组大鼠分别收集滑膜组织标本,双向电泳。软件分析比对各时间点艾灸组、模型组以及正常组。选取各时间点模型组与艾灸组共同差异蛋白点,应用MALDI-TOF MS鉴定,IPA软件分析差异蛋白的生物功能、信号通路及信号网络。结果①成功建立了各组关节滑膜双向凝胶电泳图谱。②发现并鉴定各时间点艾灸组与模型组共同差异蛋白质9个,PRDXⅠ,EHHADH,MLC3,HPX等蛋白主要通过自身变化调节脂肪酸β-氧化通路Ⅲ、NRF2-介导的氧化应激反应通路、急性期反应通路、细胞骨架肌动蛋白通路、上皮细胞黏附通路等,从而参与功能涉及DNA复制、重组和修复、细胞集结和炎性反应的信号网络,最终调控本研究中RA的发生与发展。结论PRDXⅠ,EHHADH,MLC3,HPX等蛋白具有潜在的作为艾灸治疗RA靶点或疗效标志物的意义,为进一步研究艾灸作用机制提供蛋白质组学依据。
关键词〔〕艾灸;类风湿关节炎;胶原;双向凝胶电泳;质谱;滑膜
中图分类号〔〕R593.22〔文献标识码〕A〔
基金项目:国家自然科学基金资助项目(81173158);江苏省高校自然科学
通讯作者:孙志岭(1970-),男,博士,副教授,主要从事中西医结合治疗风湿病学研究。
1南京医科大学大型仪器中心2江苏省中医院风湿免疫科
第一作者:江星(1983-),女,硕士,讲师,主要从事中西医结合治疗风湿病学研究。
类风湿关节炎(RA)是一种病因不明的全身性自身免疫性疾病,以关节滑膜病变、骨质侵蚀为主要特征,其病理特点是关节滑膜的反复慢性炎性反应、血管翳形成,由此引起软骨吸收、骨质破坏和骨纤维化〔1,2〕。本研究应用双向凝胶电泳(2-DE)及质谱比较艾灸干预后不同时间点的共同差异蛋白,并进行IPA分析,旨在寻找艾灸治疗RA目的蛋白及其信号通路与信号网络,探究艾灸疗法作用机制。
1材料与方法
1.1实验场所与动物本实验在南京中医药大学SPF级动物实验中心完成。SPF级饲养条件:自由灭菌饮食、光/暗周期12 h/12 h(光照时间06:00~18:00)、背景噪音(40±10)db、温度(20±3)℃、相对湿度40%~50%。健康、雄性Sarague-Dawley(SD)大鼠48只,SPF级,体重200~250 g,购于北京维通利华动物实验中心〔SCXK (京) 2012-0001〕。
1.2主要试剂与仪器纯乙酸、完全弗氏佐剂、不完全弗氏佐剂购自美国Sigma公司;牛Ⅱ型胶原购自美国Chondrex公司;二硫苏糖醇(DTT)、碘乙酞胺(Iodoacetmaide)、丙烯酞胺(Acrylmaideine)、甲叉双丙烯酞胺(Disacylmaide)、三羟甲基氨基甲烷(Tris)、3-〔(3-胆酰胺丙基)-二乙胺〕-丙磺酸(CHAPS)、十二烷基磺酸钠(SDS)、过硫酸铵(APS)、硫代硫酸钠、琼脂糖、固相pH梯度干胶条IPG strip(pp~10 NL,24 cm)、固相pH梯度胶条缓冲液(IPGB,Pp~10 NL)等购自美国Amersham公司。
IPG phor等电聚焦仪,Ettan Dalt Ⅱ垂直电泳系统、Image Master 2D 5.0图像分析软件均为美国Amersham公司产品。基质辅助激光解析/电离飞行时间串联质谱分析仪(MALDI-TOF/TOF-MS:Ultraflex Ⅱ型)为德国Bruker公司产品。
1.3施灸材料无烟艾灸选择南阳万春堂天然艾草生物制品开发有限公司生产,规格:7 mm×12 mm。
1.4方法
1.4.1动物模型制备、实验分组及艾灸方法SD大鼠48只,按随机数字表法分出6只为正常组,42只建立Ⅱ型胶原诱导的关节炎模型。参照文献〔3〕方法,牛Ⅱ型胶原溶解在0.05 mol/L的醋酸中,配制成2 mg/ml的胶原溶液,4℃过夜。冰浴条件下,用样本均质仪低速混合时滴加等体积的完全弗氏佐剂,配制Ⅱ型胶原乳剂(终浓度为1 mg/ml)。以每只200 μl于鼠尾根部皮下注射免疫,7 d后按照上述方法100 μl鼠尾基部皮内注射二次免疫。纳入实验的42只大鼠有8只造模失败,造模成功的36只大鼠随机分为6组,艾灸Ⅰ组,艾灸Ⅱ组,艾灸Ⅲ组,模型Ⅰ组,模型Ⅱ组,模型Ⅲ组,每组6只。
参考文献各组大鼠均定穴剃毛,捆缚于鼠板。〔4〕,艾灸组取大鼠肾俞穴(第二腰椎棘突下,左右旁开7 mm)和足三里穴(膝关节后外侧,腓骨小头下约5 mm处),点燃的无烟艾条垂直固定在灸架上保持与穴位距离2 cm (施灸过程中统一按照肾俞穴-对侧肾俞穴-足三里-对侧足三里的顺序),每穴灸20 min。Ⅰ组干预1 w,Ⅱ组干预2 w,Ⅲ组干预3 w。
1.4.2滑膜组织预处理每组干预结束后,大鼠处死剥离膝关节滑膜,迅速放入液氮冻存。同组滑膜组织等量混合,按约1∶8(m/V)的比例加入组织裂解液〔7 mol/L Urea、2 mol/L Lhtiourea,2% Pharmalyte(pp~10),2% NP-40,1% Triton X-100,0.5 mmol/L EDTA,40 mmol/L Tris,4%CHAPS,100 mmol/L DTT,5 mmol/L PMSF〕。室温下静置孵育1 h,其间每隔15 min涡旋一次×3 s,然后以1 200 r/min,4℃离心1 h,吸取上清即为组织中的总蛋白质。取少许(1 μl)组织总蛋白用Bradford法测蛋白质浓度,其余上清分装,-80℃保存备用。
1.4.3蛋白质双向凝胶电泳按IPGphor等电聚焦系统指南及Sun等〔5〕的方法设IPGphor 仪器运行参数:设置程序水化和聚焦均在20℃下进行,电流为每根胶条7 μA,总电压时间69 920 Vh,其中水化在30 V低电压下进行1 h,然后经过500 V 1 h、1 000 V 1 h,最后稳定在8 000 V等电聚焦8.5 h。等电聚焦后,取出胶条于平衡缓冲液中平衡2次,平衡后在12.5%SDS-PAGE均匀胶上行第二向电泳。银染染色,每份蛋白样品均重复电泳3次。
1.4.4凝胶蛋白图谱分析应用Image Scanner扫描仪进行扫描,Image Master 2D 5.0软件进行包括蛋白点的检测、量化、背景扣除和点的匹配等图像分析。以正常组滑膜蛋白作为对照,将艾灸组(Ⅰ、Ⅱ、Ⅲ)与模型组(Ⅰ、Ⅱ、Ⅲ)对应比较,计算蛋白变化量的比值,以比值>1.2〔6〕或<0.83〔7〕的点以及是有或无差别的蛋白点作为后续质谱鉴定及IPA分析的候选蛋白点。
1.4.5质谱鉴定与数据库查询需鉴定的差异蛋白点经切割、脱色、还原、烷基化、胰蛋白酶酶解、萃取及脱盐后,利用质谱仪测得各自肽质量指纹图谱,并以基质峰、酶自动降解片段峰进行校正。所得肽质量指纹图谱用Mascot搜索引擎检索NCBI、MSDB蛋白质数据库。参数设置为每个肽允许有1个不完全裂解位点,且肽片段分子量最大容许误差为±100 ppm,蛋白质匹配分数>54分,物种来源为大鼠。
1.4.6差异蛋白的生物信息学分析采用IPA(Ingenuity Pathway Analysis)软件分析经鉴定的差异蛋白质的生物功能、信号通路,并绘制信号转导网络图。
2结果
2.1双向凝胶电泳分析结果各组大鼠关节滑膜蛋白质双向凝胶电泳银染图谱清晰,蛋白质点分离完全,每张血清凝胶图
谱辨识(1 316.7±24.7)个蛋白点,并显示良好重复性与稳定性。经过背景消减后,分别将其中一块凝胶作为参考胶进行3块凝胶间的蛋白质点匹配,组内蛋白点平均匹配率90%~93%。比对后发现,模型Ⅰ组与艾灸Ⅰ组有365个差异点;模型Ⅱ组与艾灸Ⅱ组有332个差异点;模型Ⅲ组与艾灸Ⅲ组有202个差异点。选取三个时间点共同表达的9个差异蛋白点,作为艾灸治疗持续变化及发挥作用的差异蛋白。这9个蛋白质点在2-DE凝胶上的具体位置见图1。用蛋白点的灰度值代表蛋白表达丰度进行不同时间点差异蛋白点(Spot 1~9)的组间定量比较结果见表1。
2.2部分差异表达蛋白质的质谱鉴定根据2-DE结果,获得9张肽质量指纹图谱(PMF),进入Matrix Science Mascot检索界面,9个共同表达的差异蛋白具体名称和相关信息见表2。

图1 9个共同差异蛋白点在凝胶上的具体位置

SpotNo.正常组艾灸Ⅰ组模型Ⅰ组艾灸Ⅱ组模型Ⅱ组艾灸Ⅲ组模型Ⅲ组10.0000±0.000000.0879±0.006580.1400±0.008590.0000±0.000000.0362±0.010570.0152±0.013300.0639±0.0121220.0820±0.018260.2038±0.003450.1485±0.005500.1755±0.035800.2567±0.019640.0899±0.020760.1590±0.0261830.6041±0.047730.2961±0.008680.2014±0.012690.4886±0.091080.3127±0.042780.5331±0.032240.9268±0.0241240.3101±0.038930.0659±0.013900.0362±0.006950.1931±0.040520.0988±0.012280.2235±0.010070.3592±0.0393750.0146±0.004220.0198±0.004800.0304±0.002680.0028±0.004800.0221±0.006670.0153±0.005660.0285±0.0049160.1732±0.059280.3737±0.046140.2340±0.026940.3033±0.011120.3703±0.039820.2007±0.027850.2996±0.0323870.0398±0.010170.0607±0.013060.0334±0.006550.0429±0.009960.0804±0.005640.0265±0.006870.0562±0.0019080.2393±0.032550.1595±0.011630.0494±0.022220.1551±0.023790.2643±0.038210.0514±0.045530.1428±0.0335990.0000±0.000000.0131±0.011930.0643±0.013900.0000±0.000000.0344±0.012060.0333±0.009960.0047±0.00813
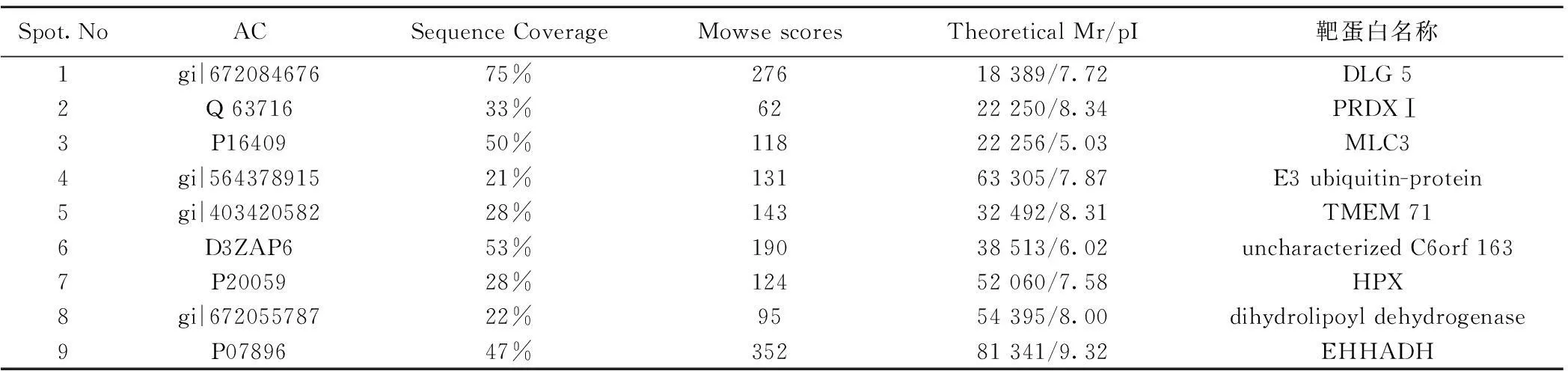
表2 9个蛋白质点具体名称及相关信息
2.3差异蛋白的IPA分析结果9个差异表达蛋白,4个(DLG 5、TMEM 71、E3 ubiquitin-protein ligase、dihydrolipoyl dehydrogenase)由于未能检索到对应的鼠源性Uniport AC,1个(uncharacterized C6orf 163)未搜索到IPA数据,最终得到4个蛋白〔过氧化物还原酶(PRDX)Ⅰ、EHHADH、肌球蛋白轻链(MLC)3、血红素结合蛋白(HPX)〕的IPA分析结果,包括生物功能分析、信号通路分析及信号网络分析。
2.3.1差异蛋白的生物功能分析结果表3列出IPA分析获得的4个蛋白(PRDXⅠ、EHHADH、MLC3、HPX)与RA相关度较高的生物功能。

表3 IPA分析与RA相关度较高的生物功能
以-Log(P值)表示分析结果的富集度,-Log(P值)越大,富集程度越好,参与该项生物功能的蛋白就越多,反之越少
2.3.2差异蛋白的信号通路分析结果IPA分析结果发现31条信号通路,其中富集度最高的通路是脂肪酸β-氧化通路Ⅲ(Fatty Acidβ-oxidation Ⅲ),其他与RA密切相关的通路有急性期反应(Acute Phase Response Signaling)、上皮细胞黏附通路(Epithelial Adherens Junction Signaling)、细胞骨架肌动蛋白通路(Actin Cytoskeleton Signaling)等。见表4。

表4 IPA分析与RA相关度较高的信号通路
以-Log(P值)表示富集度,较高代表此类通路被大量启用;Ratio是指此类通路的激活程度,较高代表此类通路激活程度大(信息传递频繁、信息传递量大)
2.3.3差异蛋白的信号网络分析结果通过IPA软件分析,我们得到模型组与艾灸组共同差异蛋白参与的网络信息图——涉及DNA复制、重组和修复;细胞集结和炎性反应网络。由图2可以发现,该网络信息图由1个(EHHADH)上调与4个(PRDXⅠ、MLC3、HPX)下调的差异蛋白参与,其中PRDXⅠ在网络中与其他蛋白的相互作用最密切,提示在网络通路中具有重要的作用。
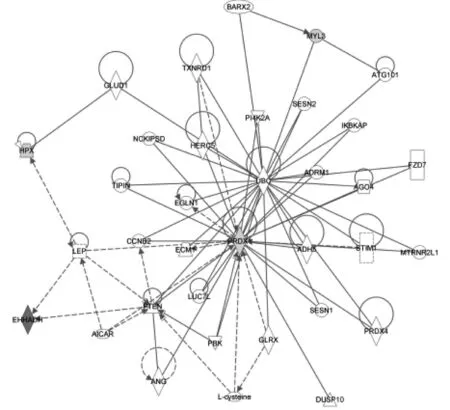
图2 差异蛋白信号网络分析结果
3讨论
本研究发现,PRDXⅠ、EHHADH、MLC3、HPX蛋白全都有可能参与了造模后的改变,3个蛋白(PRDXⅠ、MLC3、HPX)参与了艾灸调控过程。IPA分析发现,这4个蛋白参与的所有生物功能中,与RA密切相关的主要有器官形态、骨骼肌肉功能、免疫功能、炎性反应和疾病、血液系统功能、结缔组织功能等。
PRDXⅠ是重要的过氧化物酶(Prxs),能清除过氧化物,保护机体免受氧化损伤和参与信号传导等重要生理功能〔8〕。有研究发现RA患者抗CCP水平与滑膜液中氧化活性指标(如MDA、MPO)呈正相关〔9〕,说明RA病变过程中氧化应激发挥着重要的作用〔10〕。本研究发现,模型组PRDXⅠ表达上调,推测由此导致的滑膜氧化应激反应是其持续炎症的原因之一;艾灸后低表达,推测艾灸可能通过下调PRDXⅠ表达,调整氧化-抗氧化系统的平衡。有学者认为MLC经调节与Ca2+的结合来调节肌肉收缩与舒张频率〔11〕。本研究发现,当模型组MLC3与正常组相比下调时艾灸使其上调,当MLC3与正常组相比上调时艾灸则使其下调,很显然艾灸对MLC3在肌肉收缩过程中的调控起着非常重要的双向调节作用。 HPX与血红素结合能力最强,它最重要的功能是结合并转运有毒的游离血红素。研究提示〔12〕,HPX具备抗氧化、抗凋亡、免疫调节、器官保护等多种功能,并参与细胞分化以及细胞外基质重建等生理过程。本研究显示艾灸对模型组HPX表达水平有负反馈作用,提示艾灸在RA中显示出明显的免疫调节作用。
本文发现EHHADH主要参与调控脂肪酸β-氧化通路Ⅲ,PRDX1主要参与调控NRF2-介导的氧化应激反应通路等。提示造模使该通路激活,艾灸可能通过下调此通路缓解氧化应激导致的炎症反应和组织损伤。与RA密切相关的其他通路如细胞骨架肌动蛋白通路的激活验证了RA病理过程中伴随着软骨侵蚀〔13〕,同时提示艾灸通过对此通路的调节发挥调控HPX的关键作用。而急性期反应、上皮细胞黏附功能的激活则是机体应对炎症时的一般反应,同时炎症也对此通路产生影响〔14〕,提示艾灸可能通过作用于这两个通路发挥其干预作用。
本研究发现,PRDXⅠ在网络中与其他蛋白的相互作用最密切,PRDXⅠ与LEP、UBC相邻,LEP可与EHHADH及HPX联系,UBC可与MLC3联系,从而构成了4个差异蛋白在整个信息网络中的联络。提示PRDXⅠ在网络通路中具有关键作用,处于信息网络的核心位置。结合蛋白生物功能分析和信号通路分析结果,艾灸极有可能通过作用于NRF2-介导的氧化应激反应通路下调PRDXⅠ,从而调节RA的发生与发展。
4参考文献
1中华医学会风湿病学分会.类风湿关节炎诊断及治疗指南〔J〕.中华风湿病学杂志,2010;14(4):265-70.
2Zhang Y,Guo Z,Zou L,etal.A comprehensive map and functional annotation of the normal human cerebrospinal fluid proteome〔J〕.J Proteomics,2015;119(1):90-9.
3Cai X,Zhou H,Wong Y F,etal.Suppression of the onset and progression of collagen-induced arthritis in rats by QFGJS,a preparation from an anti-arthritic Chinese herbal formula〔J〕.J Ethnopharmacol,2007;110(1):39-48.
4李忠仁.实验针灸学〔M〕.第2版.北京:中国屮医药出版社,2007:255-7.
5Sun ZL,Zhu Y,Wang FQ,etal.Serum proteomic-based analysis of pancreatic carcinoma for the identification of potential cancer biomarkers〔J〕.Biochim Biophys Acta,2007;1774(6):764-71.
6Wu J,Wang F,Gong Y,etal.Proteomic analysis of changes induced by nonylphenol in Sprague-Dawley rat Sertoli cells〔J〕.Chem Res Toxicol,2009;22(4):668-75.
7祝皓.痹肿消汤及其有效成分阿魏酸干预胶原诱导性关节炎大鼠的定量蛋白质组学研究〔D〕.长沙:中南大学,2014.
8Wood ZA,Schroder E,Robin HJ,etal.Structure,mechanism and regulation of peroxiredoxins〔J〕.Trends Biochem Sci,2003;28(1):32-40.
9朱芳玉.类风湿关节炎抗CCP抗体与氧化和抗氧化活性的相关性研究〔J〕.国际检验医学杂志,2012;(21):2576-7.
10Kim CW,Cho EH,Lee YJ,etal.Disease-specific proteins from rheumatoid arthritis patients〔J〕.J Korean Med Sci,2006;21(3):478-84.
11Baylor SM,Hollingworth S.Intracellular calcium movements during excitation-contraction coupling in mammalian slow-twitch and fast-twitch muscle fibers〔J〕.J Gen Physiol,2012;139(4):261-72.
12董贝贝,朱芳芸,魏海东,等.血红素结合蛋白生化物性及应用研究进展〔J〕.中国实验血液学杂志,2013;21(2):513-6.
13Trickey WR,Vail TP,Guilak F.The role of the cytoskeleton in the viscoelastic properties of human articular chondrocytes〔J〕.J Orthop Res,2004;22(1):131-9.
14Venteclef N,Jakobsson T,Steffensen KR,etal.Metabolic nuclear receptor signaling and the inflammatory acute phase response〔J〕.Trends Endocrinol Metab,2011;22(8):333-43.
〔2015-03-17修回〕
(编辑徐杰)
