复合诱变法筛选达托霉素高产菌株
2015-12-28
(华北制药集团新药研究开发有限责任公司微生物药物国家工程研究中心河北省工业微生物代谢工程技术研究中心,河北石家庄050015)
达托霉素是具有独特环状结构的脂肽类抗生素[1],由玫瑰孢链霉菌(Streptomycesroseosporus)发酵产生,它能通过阻碍细菌细胞壁的生成和破坏细菌细胞膜的功能等方式杀死细菌[2-3],作用机制与传统抗生素不同,故不易产生耐药菌。达托霉素的抗菌谱与万古霉素类似,且在体外对万古霉素、甲氧西林、利奈唑烷等的耐药菌也具有强烈活性,因此成为目前临床上公认的继万古霉素之后最理想的备用抗生素[4-9]。鉴于以上特殊优势,达托霉素的工业化生产具有重要的现实意义,筛选适合工业化生产所需的高产菌株迫在眉睫。
复合诱变法是指在诱变育种中使用2种或2种以上的诱变方法处理菌株,以提高菌株的诱变效果[10]。作者在此采用氦氖(He-Ne)激光辐照-亚硝基胍(NTG)复合诱变达托霉素产生菌HK402,以期获得高产且遗传稳定性好的达托霉素产生菌。
1 实验
1.1 菌株与仪器
玫瑰孢链霉菌(Sterptomycesroseosporus)HK402,由微生物药物国家工程研究中心菌种保藏库提供。
摇床,超净工作台,离心机,He-Ne-1000型氦氖激光仪。
1.2 培养基
分离培养基:高氏1号培养基。
种子培养基:糊精1%,葡萄糖0.5%,玉米浆0.5%,K2HPO4·3H2O 0.04%,MgSO4·7H2O 0.1%。
发酵培养基:葡萄糖2%,淀粉1.3%,冷榨豆饼粉1.5%,蛋白胨1%,CaCO30.5%,MgSO4·7H2O 0.3%,前体0.8%。
1.3 方法
1.3.1 培养方法
种子培养:取生长好的斜面,用接种铲挖块1cm2左右接入种子瓶中,28 ℃、220r·min-1培养36h。
发酵培养:将摇瓶种子按4%的接种量接入250 mL装量为40mL的发酵瓶中,28℃、220r·min-1培养118h。
1.3.2 诱变方法
1)单孢子菌悬液的制备
取生长好的成熟斜面,加入适量无菌生理盐水,轻轻刮下孢子后将孢子液移入无菌玻璃珠瓶中充分振荡打散,过滤后将孢子数调到106个·mL-1,待用。
2)亚硝基胍溶液的配制
在通风橱中称取100mg 亚硝基胍于棕色容量瓶中,加入少量丙酮使其溶解,最后用乙醇定容至10 mL,使终浓度为10mg·mL-1,待用。
3)氦氖激光辐照诱变
取适量单孢子菌悬液于石英皿中进行氦氖激光辐照,激光灯功率为18mW,照射距离为20cm,分别照射10min、20min、30min、40min、50min、60min;将处理过的菌悬液梯度稀释后涂平板,28 ℃培养7d,待菌落成熟后计算致死率。挑选菌落形态好、孢子丰富的菌落传斜面,进行摇瓶初筛,并根据初筛结果计算正突变率。
4)亚硝基胍诱变
取适量单孢子菌悬液于10mL 无菌离心管中,分别用终浓度(mg·mL-1)为0.2、0.4、0.6、0.8、1.0、1.2的亚硝基胍处理30min,离心,弃上清,用pH 值为6.5的磷酸缓冲溶液洗涤菌体3次以终止反应,最后用无菌生理盐水梯度稀释涂平板,待菌落成熟后计算致死率。挑选生长健壮、孢子丰富的菌落传斜面,进行摇瓶初筛,并根据初筛结果计算正突变率。
5)氦氖激光辐照-亚硝基胍复合诱变
在最佳诱变剂量下复合处理出发菌株HK402,将处理后的单孢子菌悬液梯度稀释后涂平板,进行菌落初筛和摇瓶初筛,根据初筛结果计算致死率和正突变率。
1.3.3 计算与检测方法
1)致死率和正突变率的计算

2)发酵单位的测定
采用HPLC法[11]测定发酵单位。
2 结果与讨论
2.1 氦氖激光辐照诱变筛选达托霉素高产菌株
将HK402的无菌菌悬液用氦氖激光辐照不同时间后,计算致死率和正突变率,结果见表1。
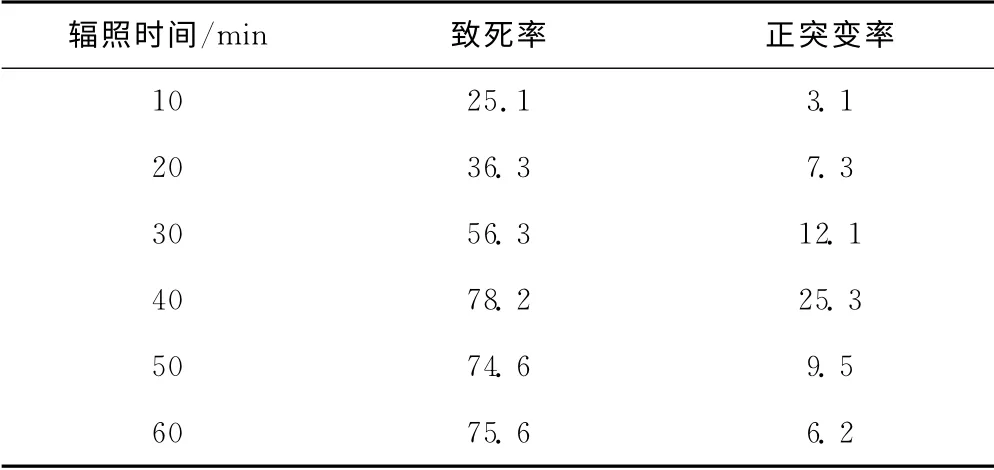
表1 氦氖激光辐照不同时间后的致死率和正突变率/%Tab.1 Death rate and positive mutation rate after irradiating different time by He-Ne laser/%
由表1可知:随着氦氖激光辐照时间的延长,菌株的致死率逐渐升高;在辐照40min时菌株的致死率达到78.2%,此时正突变率最高,为25.3%;继续延长辐照时间,菌株的致死率趋于平稳,但正突变率逐渐降低。因此,氦氖激光辐照诱变时间以40min为宜。
出发菌株HK402 经氦氖激光辐照不同时间后,筛选得到了发酵单位比出发菌株提高10%的正突变菌株共68株,其中有7株为诱变40min的菌株,其发酵单位较出发菌株高20%以上,菌株14-8-102发酵单位最高,比出发菌株高25%。
2.2 亚硝基胍诱变筛选达托霉素高产菌株
将HK402的无菌菌悬液用不同浓度的亚硝基胍溶液处理后,计算致死率和正突变率,结果见图1。
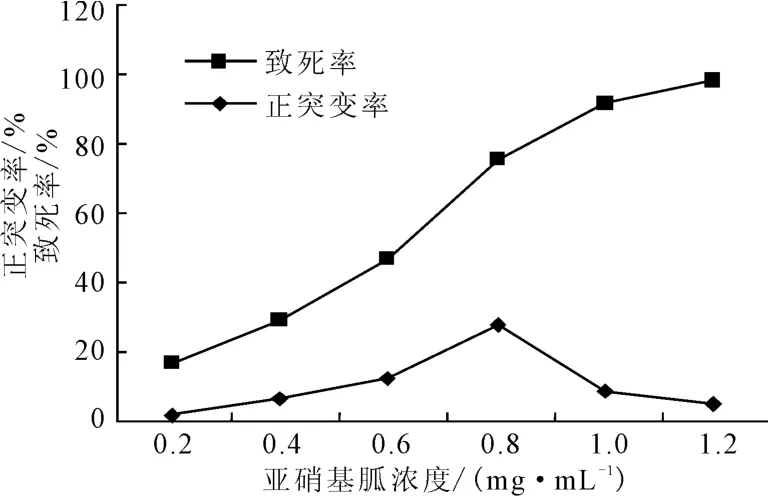
图1 不同浓度亚硝基胍诱变后的致死率和正突变率Fig.1 Death rate and positive mutation rate after mutated by different concentrations of NTG
由图1可知:随着亚硝基胍浓度的增大,菌株的致死率逐渐升高;在亚硝基胍浓度为0.8mg·mL-1时菌株的致死率达到75.5%,此时正突变率最高,为28.1%;继续增大亚硝基胍浓度至1.2mg·mL-1时,菌株的致死率接近100%,正突变率却降低到5.3%。因此,亚硝基胍诱变浓度以0.8mg·mL-1为宜。
HK402经亚硝基胍诱变后,从0.8mg·mL-1剂量组中筛选到了发酵单位最高的菌株14-9-196,比出发菌株高19%。
2.3 氦氖激光辐照-亚硝基胍复合诱变筛选达托霉素高产菌株
用氦氖激光辐照和0.8mg·mL-1的亚硝基胍溶液复合处理出发菌株HK402,氦氖激光辐照时间为40min,亚硝酸胍处理时间为30 min,筛选得到了10株高产菌株,结果见图2。
由图2可见,复合诱变得到的高产菌株14-10-98的发酵单位最高,比出发菌株HK402高35%,比单用氦氖激光辐照诱变得到的高产菌株14-8-102高8%,比单用亚硝基胍诱变得到的高产菌株14-9-196高13%。
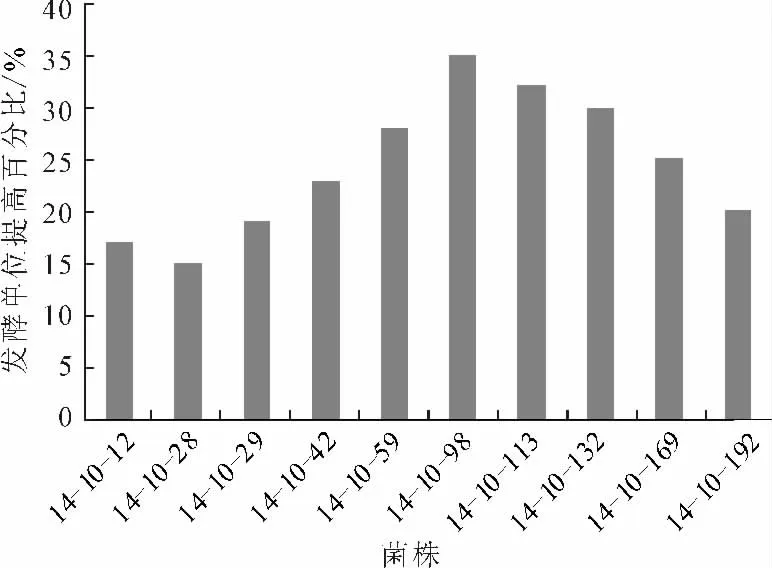
图2 氦氖激光辐照-亚硝基胍复合诱变结果Fig.2 Results of complex mutagenesis of He-Ne laser irradiation and NTG
2.4 高产菌株的遗传稳定性考察
将诱变高产菌株进行传代实验,以出发菌株HK402为对照(发酵单位以100计),考察其遗传稳定性,结果见图3。
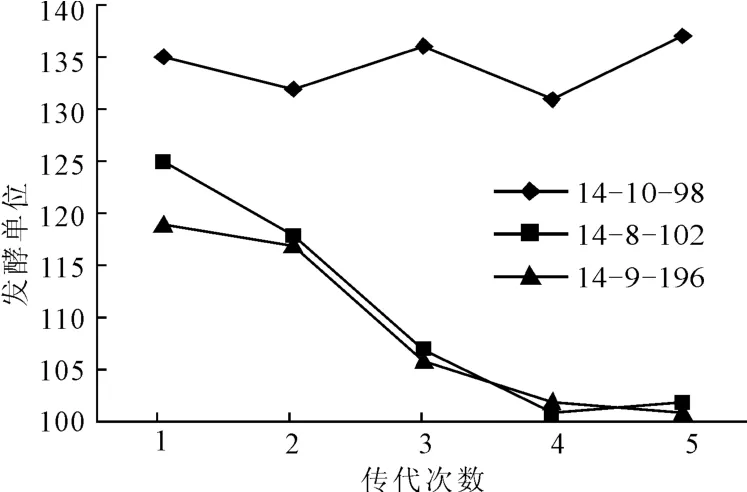
图3 高产菌株的遗传稳定性Fig.3 Genetic stability of the high producing strains
由图3可见:单一诱变得到的高产菌株14-8-102和14-9-106的遗传稳定性都不好,发酵单位从2代斜面开始就发生回落,传代4次以上菌株的高产特性基本消失;而复合诱变得到的高产菌株14-10-98在斜面传代5次的遗传稳定性仍然较好,是一株已具备上罐条件的高产菌株。
3 结论
用氦氖激光辐照和亚硝基胍诱变达托霉素产生菌HK402,发现单独使用氦氖激光辐照诱变得到的高产菌株14-8-102的发酵单位比出发菌株高25%;单独使用亚硝基胍诱变得到的高产菌株14-9-196的发酵单位比出发菌株高19%;采用氦氖激光辐照-亚硝基胍复合诱变得到的高产菌株14-10-98的发酵单位比出发菌株高35%。采用氦氖激光辐照-亚硝基胍复合诱变较单一诱变的效果好,而且高产菌株传代5代后遗传稳定性良好。
[1]RICHARD A L,WILLIAM V C,DONALD B B.Lipodepaipeptide antibiotics and methods of preparation:US,6767718[P].2004-07-27.
[2]RAJA A,LaBONTE J,LEBBOS J,et al.Fresh from the pipeline:Daptomycin[J].Nat Rer Drug Discor,2003,2(12):943-944.
[3]CUNHA B A,HAMID N,KESSLER H,et al.Daptomycin cure after cefazolin treatment failure of Methicillin-sensitiveStaphylococcusaureus(MSSA)tricuspid valve acute bacterial endocarditis from a peripherally inserted central catheter(PICC)line[J].Heart Lung,2005,34(6):442-447.
[4]卢文玉,闻建平,范晶华,等.癸酸抗性突变株流加发酵法生产达托霉素[J].天津大学学报,2006,39(B06):20-24.
[5]刘伯宁,石磊,蒋沁.环脂肽类抗生素研究进展[J].中国抗生素杂志,2007,32(9):520-524.
[6]赵增任,唐巍,赵晋.新型抗生素药物——达托霉素[J].科教文汇,2008,(4):197.
[7]JOHNSON A P,MUSHTAQ S,WAMER M,et al.Activity of daptomycin against multi-resistant Gram-positive bacteria including enterococci andStaphylococcusaureusresistant to linezolid[J].International Journal of Antimicrobial Agents,2004,24(4):315-319.
[8]HOJATI Z,MILNE C,HARVEY B,et al.Structure,biosynthetic origin,and engineered biosynthesis of calcium-dependent antibiotics fromStreptomycescoelicolor[J].Chemistry and Biology,2002,9(11):1175-1187.
[9]BELL J M,TURNIDGE J D.High prevalence of oxacillin-resistantStaphylococcusaureusisolates from hospitalized patients in Asia-Pacific and South Africa:Results from SENTRY antimicrobial surveillance program,1998-1999[J].Antimicrobial Agents and Chemotherapy,2002,46(3):879-881.
[10]李荣杰.微生物诱变育种方法的研究进展[J].河北农业科学,2009,13(10):73-76,78.
[11]VASSELLE B,GOUSSET G,BOUNINE J P.Development and validation of a high-performance liquid chromatographic stabilityindicating method for the analysis of Synercid in quality control,stability and compatibility studies[J].J Pharm Biomed Anal,1999,19(5):641-657.
