多菌种混合制曲提高麦曲品质*
2015-12-25余培斌张波陆健陈建新
余培斌,张波,陆健,陈建新
1(江南大学粮食发酵工艺及技术国家工程实验室,江苏无锡,214122)
2(江南大学生物工程学院,江苏无锡,214122)3(浙江经贸职业技术学院,浙江杭州,310018)
麦曲是以小麦为原料,经过粉碎、加水、拌和、成型、堆放,在一定的温度和湿度的环境条件下,富集培养酿酒有益微生物而制成的糖化发酵剂。在工厂的实际生产中,根据制曲工艺的不同,将黄酒麦曲分为生麦曲和熟麦曲。生麦曲根据生料成型过程是通过机械还是人工又分为手工曲和机制曲。生麦曲接种方式为自然接种,由于生麦曲网罗了自然界的多种微生物,形成了特定的微生物群落,多种微生物相互作用,代谢产物丰富,所酿成酒口味醇厚,香气较浓。但生麦曲由于是自然培养,主要产酶微生物生长较弱,曲中主要酶类酶活都较低,在实际生产中用量较大,且酿造过程中发酵缓慢,残糖高,后续处理时,压榨困难[1],同时生麦曲的制曲时间长且受季节限制,这些缺陷都严重制约着黄酒的规模化生产。20世纪60年代初浙江的一些黄酒厂为达到提高出酒率,节约粮食,降低成本的目的,同时也为适应黄酒机械化的要求,开始推广应用熟麦曲。熟麦曲是将小麦蒸熟杀死原料中的大多数微生物,接种纯种的米曲霉苏-16进行培养,制曲过程中利用通风机供给空气,调节温、湿度,促使米曲霉在较厚的曲料上生长繁殖并大量积累代谢产物,熟麦曲培养条件可人为控制,制曲时间较短仅需44 h左右,且麦曲的液化力、糖化力、蛋白质分解力远高于生麦曲。在黄酒酿造过程中,能够缩短发酵周期,提高原料利用率,但由于菌种较为单一,酶系简单,微生物有益代谢产物较少,熟麦曲酿成的黄酒会产生一股特殊的熟麦味,口感较淡薄,香气较差,对黄酒的质量有一些影响。
为了结合生麦曲和传统熟麦曲的优势,将生物强化技术应用于黄酒熟麦曲的制作过程中,通过传统的生物学手段从黄酒麦曲及黄酒厂环境中筛选影响麦曲品质的主要微生物,多菌种混合制作黄酒熟麦曲。一方面,它可以大大提高水解酶(主要为α-淀粉酶,糖化酶,蛋白酶)的酶活,弥补传统生麦曲糖化力弱,用量大的缺陷;另一方面,多菌种混合麦曲,由于菌种多样,较传统熟麦曲代谢产物丰富,形成大量的风味前体物质,可缓解传统熟麦曲菌种单一,所酿黄酒口味寡淡,杂味较重的状况。因此,多菌种制作黄酒熟麦曲,对于黄酒行业提高原料利用率和生产效率,降低生产成本,同时保证黄酒质量具有重要的实际意义。
在前期的研究中[2],作者从酒厂环境中分离得到1株米曲霉(编号真菌ZW12),与米曲霉苏-16混合接种制备了强化曲,并优化了制曲条件,在提高酶活方面有较好的效果,但在改善黄酒风味方面效果欠佳。本文以酒厂环境中分离得到的细菌入手,筛选优良的制曲菌株,采用细菌与真菌混合接种制备强化曲,并探讨其对黄酒酿造的影响。
1 材料与方法
1.1 材料
1.1.1 培养基
1.1.1.1 斜面培养基
PDA培养基:取去皮马铃薯200 g,切块,加1 000 mL蒸馏水,煮沸20 min后纱布过滤,补加蒸馏水至1 000 mL,加葡萄糖20 g,琼脂20 g,pH 自然。
LB培养基(g/L):蛋白胨10,酵母膏10,NaCl 5,琼脂20,pH自然。
1.1.1.2 初筛培养基
产淀粉酶微生物初筛培养基(g/L):可溶性淀粉3,蛋白胨10,牛肉膏3 ~5,NaCl 5,琼脂20,pH 7.2 ~7.4。
产蛋白酶微生物初筛培养基(g/L):牛肉膏5,蛋白胨 10,NaCl 5,脱脂奶粉 3,琼脂 20,pH 7.0 ~7.2。
1.1.2 原料与试剂
(1)粉碎小麦由绍兴某黄酒厂制曲车间提供,麸皮购自无锡三里桥农贸市场。初筛菌株从绍兴某黄酒厂环境中分离得到,由实验室保藏。
(2)试剂:3,5-二硝基水杨酸、福林试剂、淀粉、三氯乙酸、酪素、Na2CO3、琼脂粉等均为分析纯,甲酸己酯、乙醚、戊烷为色谱纯,购自上海国药化学试剂有限公司。
1.2 实验方法
1.2.1 高产淀粉酶及蛋白酶微生物的筛选
(1)初筛:取9 cm灭菌过的培养皿,每个加入初筛培养基20 mL,将原有保藏的菌种点植法接种到培养皿中,每皿点种5株细菌,37℃培养箱培养2~3 d,观察并定期测量菌落周围水解透明圈大小。
(2)复筛:根据初筛结果,从平板中挑选透明圈明显的菌株制作种子培养液,做纯种熟麦曲,以糖化酶、α-淀粉酶、酸性蛋白酶酶活为筛选指标,挑选酶活最高者作为目标菌株。
1.2.2 菌种鉴定
(1)菌株形态鉴定:根据伯杰氏系统细菌学手册进行分类鉴定。
(2)细菌16S rDNA基因测序分析:细菌总DNA的提取采用试剂盒,PCR等扩增引物,PCR反应体系和程序,产物割胶回收,16S rDNA分子的回收,T-A克隆等试验的具体方法及操作参考文献[3]。最后将比对正确的单阳性克隆子送上海生工测序,测序结果在NCBI上进行Blast序列比对,找出对应序列的种属信息。
1.2.3 制曲菌种的制备
(1)真菌菌种的接种使用孢子悬浮液,制备方法为:将活化后菌种的分生孢子用无菌水洗入三角瓶中,在超净台上四层擦镜纸过滤,旋涡振荡均匀,血球计数板计数,孢子浓度调为107个/mL。接种量以孢子悬浮液体积与原料质量比值计算(v/w)。
(2)细菌菌种的接种使用液体种子培养液,培养基为LB培养基,细菌生长曲线的绘制参照文献[4]进行。接种量以细菌培养液体积与原料质量比值计算(v/w)。
1.2.4 纯种熟麦曲制曲工艺流程
参照某黄酒企业生产实际而定。

具体制曲工艺要点见参考文献[5]。
1.2.5 麦曲粗酶液制备
参照文献[2]
1.2.6 麦曲酶活的测定及定义
酶活的测定方法参照文献[2],酶活的定义为:
(1)糖化酶酶活定义:1 g干曲经缓冲液提取后的粗酶液,在40℃ pH 4.6条件下,1 h分解可溶性淀粉产生1 mg葡萄糖为1个酶活单位(U/g)。
(2)α-淀粉酶酶活定义:1 g干曲经缓冲液提取后的粗酶液,在60℃pH 4.6条件下,每分钟分解淀粉产生1 mg麦芽糖为1个酶活单位(U/g)。
(3)蛋白酶酶活定义:1 g干曲经缓冲液提取后的粗酶液,在40℃条件下1 min水解酪素产生1 μg酪氨酸为1个酶活单位(U/g)。
1.2.7 气质联用(GC-MS)定量分析黄酒香气物质
(1)样品前处理方法:取50 mL酒样加入5 g NaCl使其饱和,加入50 μL内标溶液(L-薄荷醇质量浓度为192.50 μg/L、丙酸辛酯质量浓度为398.5 μg/L、甲酸己酯质量浓度为378.34 μg/L)混匀,然后用50 mL萃取剂[V(乙醚)∶V(戊烷)=2∶1]萃取3次,分别为20、15、15 mL,然后将50 mL萃取液用氮气温和吹扫浓缩到10 mL左右。
(2)GC-MS 条件:参照文献[6]。
1.2.8 黄酒理化指标的测定
参照 GB/T 13662-2008[7]。
1.3 麦曲培养条件优化
1.3.1 细菌与真菌混合制取接种方法
通过借鉴在多菌种混合发酵饲料领域采用的细菌滞后接种方法,经过前期的摸索和实践,确定混合接种方法为:真菌菌种先接入培养,湿度设定在较高水平,一段时间后接入细菌,将湿度降低,升温至一定温度培养一段时间后放入45℃烘干出曲。
1.3.2 单因素实验方法
(1)细菌菌种添加时间的确定:将筛选得到的细菌菌种使用LB培养基培养过夜,根据细菌生长曲线及计数结果调节OD值,使菌悬液浓度为107个/mL,参照文献[2]中优化的真菌制曲条件,接入真菌开始制曲,真菌培养(20,24,28,32,36,40,44,48 h)后接入细菌菌种,接种量最初设定为1%,细菌接入后调整培养温度至37℃,湿度80%。48 h后出曲烘干,测定麦曲酶活,确定细菌菌种的最佳接入时间。
(2)细菌接入后培养温度的确定:在(1)单因素的基础上,研究培养温度对混合菌种产酶的影响,细菌接入后,将制曲温度设定为 30,31,32,33,34,35,36,37℃,接种量1%,湿度80%。48 h后出曲烘干,测定麦曲酶活,确定细菌与真菌混合培养的最佳温度。
(3)细菌菌种接种量的确定:在前两个单因素的基础上,确定细菌菌种的接种量,接种量分别取1%,2%,3%,4%,5%,6%,7%,研究细菌接种量对麦曲酶活的影响,确定真菌与细菌混合培养中细菌菌种的最佳接种量。
1.3.3 均匀设计优化细菌与真菌混合制曲条件
选定对真菌和细菌混合制曲产酶影响较大的3个因素:培养温度、细菌接种量、细菌接入时间作为试验因素,每个因素设定8个水平,按照DPS 9.5软件的试验设计功能确定的3因素8水平混合水平均匀设计方案进行试验,设置2个平行样品,取平均值。
1.4 小型黄酒酿造工艺
浸米:28℃保温条件下浸米3 d。
蒸饭:上汽后蒸25 min左右,无生心,用潮湿的手摸饭不粘手即可。
酒母制备:取实验室保藏黄酒速酿酵母斜面1支,接入1 mL液体麦汁培养基培养过夜,转移到装有9 mL麦汁培养基的试管进行二级活化,培养过夜后转移到装有90 mL麦汁培养基的三角瓶培养过夜进行三级活化,接种用三级种子液。
拌曲:饭冷却至室温,拌曲接种(配方质量比:糯米∶水为1∶1.7,麦曲为糯米量的15%,速酿酒母为糯米量的11.4%)。
发酵:30℃主酵3~4 d,每天搅拌2次;12 h称重1次,记录数据。15℃后酵20 d,每2~3 d称量1次,记录数据。
2 结果与分析
2.1 高产淀粉酶及蛋白酶细菌菌种的筛选
出发菌株为2010~2012年间从绍兴某黄酒厂环境中分离得到的127株细菌,经平板初筛得到产酶能力较强菌株18株。
将初筛得到的18株细菌制纯种熟麦曲,培养条件为:培养时间为48 h,温度37℃,湿度95%,接种量4%,培养过程中需要间歇性摇晃。培养结束后,45℃烘干10 h出曲,测定3种主要水解酶类酶活,进行复筛。得产酶能力较强菌株5株,编号分别为:MRS8G,MRS12,A49,D19,D38。5 株细菌的产酶能力见表1。

表1 不同细菌菌株酶活比较Table 1 Comparison of enzyme activities of different bacteria
2.2 细菌菌株的分子鉴定
使用Ezup柱式基因组DNA抽提试剂盒提取细菌基因组DNA,以基因组DNA为模板,采用细菌通用引物27F和1492R扩增序列,PCR产物经琼脂糖凝胶电泳验证无误后,割胶回收,TakaRa试剂盒回收DNA分子,T-A克隆,挑取阳性克隆子,PCR验证无误后送上海生工有限公司测序。所测的序列代入GeneBank数据库进行比对,得到的相似序列的登陆号、菌株名称及相似性见表2。可以看出,5株细菌的序列比对相似性都达到了99%及以上,因此可以确定MRS8G,MRS12,A49为解淀粉芽孢杆菌;D38,D19为枯草芽孢杆菌。
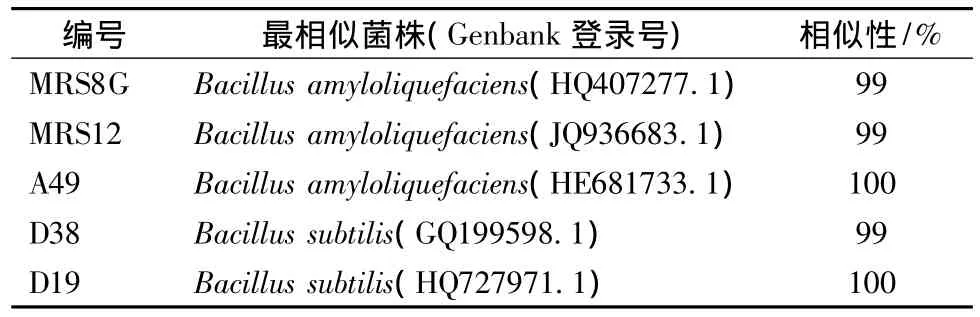
表2 复筛细菌分子鉴定结果Table 2 Molecule genetics test of bacteria
从表2中可以发现,复筛得到的细菌主要为芽孢杆菌。枯草芽孢杆菌能分泌蛋白酶、淀粉酶、抗菌素等物质。在工业生产中,是α-淀粉酶和中性蛋白酶的重要生产菌,解淀粉芽孢杆菌是一种与枯草芽孢杆菌亲缘性很高的细菌,在产酶方面与枯草芽孢杆菌十分相似,产淀粉酶能力较强。
2.3 制曲细菌菌种的确定
按照1.3.1中确定的细菌与真菌混合接种方法,在真菌接入后不同时间点(24,28,32,36,40,44 h)分别接入细菌菌种,接种量1%,细菌接入后,将温度升高至37℃培养,总制曲时间到达48 h后,开始烘干,水分含量降到25%以下出曲,测定主要水解酶酶活,通过比较确定用于制曲的细菌菌种,结果如图1所示。

图1 各时间点添加不同细菌麦曲酶活比较Fig.1 Comparison of enzyme activities of different bacteria in different time points
总体比较添加解淀粉芽孢杆菌和枯草芽孢杆菌后麦曲样品的酶活,可以发现前者效果比后者好。同时在制曲过程中发现:①添加枯草芽孢杆菌后麦曲样品会产生一种较难闻的气味,添加的时间越早,这种气味越重,严重影响麦曲的感官品评;虽然添加解淀粉芽孢杆菌的麦曲样品也会产生少许气味,相比而言要弱得多,只要添加的时间控制准确,这种气味对麦曲曲香影响不大。②添加枯草芽孢杆菌发酵一段时间后,曲料会严重发黏、结团,影响通气性,对真菌菌种生长不利。综合考虑选取解淀粉芽孢杆菌作为制曲菌种。
2.4 真菌与细菌混合制曲培养条件优化
在DPS 9.5系统中,输入因子数和水平数,设定DPS系统随机优化过程的最大迭代次数和寻优运行时间(min),进行均匀试验设计并利用系统自带的优化均匀设计对已得的均匀设计表进行优化(表3)。

表3 3因素8水平均匀试验设计方案Table 3 Table of uniform design(U8(83))
试验方案的中心化偏差CD=0.102 4,为了降低均匀试验设计的中心化偏差,更好地建立回归模型,将试验次数设定为水平数的2倍,即16次试验,采用DPS 9.5系统中的混合水平均匀试验设计制作均匀设计表并优化,试验方案的中心化偏差CD=0.078 4,通过预实验确定因素的高低水平值,输入均匀设计表中生成试验方案,按照试验方案试验,结果如表4。

表4 3因素8水平混合水平均匀试验设计方案及结果Table 4 Table of mixed level uniform experimental design and result(U16(83))
分别以糖化酶酶活、α-淀粉酶酶活、酸性蛋白酶酶活为考察对象,对均匀设计试验数据进行二次逐步回归拟合分析,获得对3个考察因素的多元回归方程。
(1)以糖化酶酶活为考察对象,对试验数据进行二次多项式逐步回归分析。得回归方程为:

对模型进行显著性检验,结果如表5。
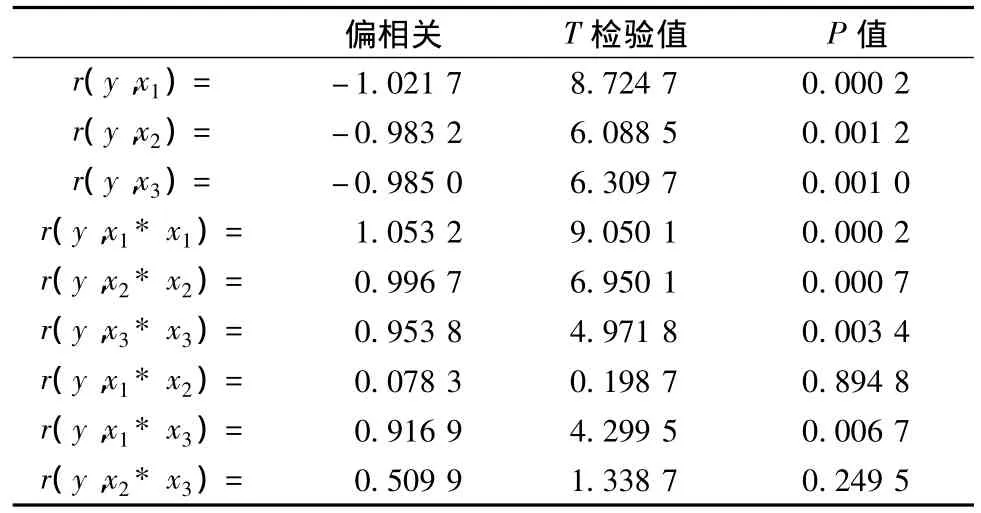
表5 对糖化酶回归方程的显著性分析Table 5 Analyses of significance of regress equtation about glucoamylase
其中,相关系数R=0.973 7,F值=12.22,显著水平P=0.003 2,方程显著,说明该方程能很好地拟合出各因素对糖化酶酶活的影响,对方程取一阶偏导值,得到糖化酶酶活最高时的制曲条件,即:培养温度36℃,细菌接种量3.5%,细菌接入时间为36 h,预测糖化酶最优结果1 428.06 U/g。
(2)以α-淀粉酶为考察对象,得回归方程:

对模型进行显著性检验,其中:相关系数R=0.977 1,F 值 =14.03,显著水平 P=0.002 2,方程显著,说明该方程能很好地拟合出各因素对α-淀粉酶酶活的影响,对方程取一阶偏导值,得到α-淀粉酶酶活最高时的制曲条件,即:培养温度36℃,细菌接种量3.5%,细菌接入时间为36 h,预测α-淀粉酶最优结果15.5 U/g。
(3)以酸性蛋白酶为考察对象,得回归方程为:

对模型进行显著性检验,其中:相关系数R=0.964 5,F 值 =8.89,显著水平 P=0.007 5,方程显著,说明方程能很好地拟合出各因素对酸性蛋白酶酶活的影响,对方程取一阶偏导值,得到酸性蛋白酶酶活最高时的制曲条件,即:培养温度35℃,细菌接种量4%,细菌接入时间为28 h,预测酸性蛋白酶最优结果656.27 U/g。
对回归模型进行验证:制曲条件为培养温度36℃,细菌接种量3.5%,细菌接入时间为36 h,试验重复3次,取平均值。糖化酶、α-淀粉酶、酸性蛋白酶酶活分别为1 425.95、14.45、427.88 U/g。与模型预测吻合较好,表明模型能够较好地预测试验结果。
2.5 强化麦曲与普通麦曲的比较
2.5.1 酶活力的比较
对于黄酒工厂来说,麦曲的理化指标反映的是麦曲作为粗酶制剂在黄酒酿造过程中转化淀粉质原料和蛋白质原料的能力,在实验室的检测过程中主要测定麦曲糖化酶、α-淀粉酶和酸性蛋白酶酶活来反映转化能力的大小。测定的样品分别为绍兴某酒厂的手工生麦曲、机制生麦曲、米曲霉苏-16纯种熟麦曲(熟麦曲1)、米曲霉苏-16与米曲霉ZW12混合熟麦曲(熟麦曲2)、以及细菌与真菌混合熟麦曲(熟麦曲3)。结果如图2所示。

图2 几种麦曲样品3种主要酶活的比较Fig.2 Comparison of enzyme activities of different wheat Qu
从图2可见,与生麦曲相比,熟麦曲糖化酶活提高不是特别明显,只提高15%左右,而液化型淀粉酶即α-淀粉酶有了显著提高,提高了150%,这是由于小麦原料对酶活的影响。小麦中虽没有α-淀粉酶,却存在丰富的 β-淀粉酶[8],β-淀粉酶能够水解 α-1.4-糖苷键,从淀粉链非还原性端开始,依次切下一个麦芽糖分子,所以小麦本身存在一定的糖化酶酶活。麦芽、甘薯、大豆粕中β-淀粉酶的最适作用温度为60~65℃,钝化温度为70℃[9],甘薯与小麦中的β-淀粉酶为同一类。生麦曲制曲过程中温度最高不会超过55℃,β-淀粉酶在这样的温度下比较稳定,而且生麦曲在制曲过程中水分较低,在低水分下酶不易失活,使β-淀粉酶得到保存。周恒刚[10]在研究生麸曲糖化酶酶活比熟麸曲高的原因时认为与麸皮中β-淀粉酶部分保存有关。这也从另一个方面说明了生麦曲中β-淀粉酶的存在,β-淀粉酶在某种程度上丰富了生麦曲酶系组成,这也可能是使用生麦曲能生产出质量较好黄酒的原因之一。
比较生麦曲和熟麦曲产酸性蛋白酶能力,熟麦曲酸性蛋白酶有很大的提高,这是因为:熟麦曲为熟料接种,人工培养,强化了微生物的生长优势,产酸性蛋白酶的真菌能够大量繁殖并产酶。比较几种熟麦曲的产酶能力可以发现:随着制曲微生物的增加,3种酶酶活都有不同幅度提高,特别是能够影响黄酒风味前体物质形成的酸性蛋白酶提高最为明显,从而表明多菌种混合接种的熟麦曲较单一菌种的熟麦曲更利于黄酒品质的提高。
2.5.2 发酵结束后黄酒理化指标检测
表5是发酵结束后,添加5种麦曲样品所酿黄酒的几项主要指标,根据国家标准(GB/T 13662-2008)中对黄酒的分类,试验酿造的5种黄酒均属于传统型干黄酒,5种麦曲酿造的黄酒中除熟麦曲1,2,3中pH值略高于标准规定的3.5~4.6外,基本各项指标均符合国家标准,其中3种熟麦曲所酿的黄酒中α-氨基态氮含量约为国标定义的优级干黄酒标准(≥0.5)的4倍,分析原因为:一方面,熟麦曲本身短肽含量和游离氨基酸含量远远高于生麦曲,随着麦曲的添加进入酒体中;另一方面,熟麦曲酶活高,酿造过程中原料糖化较彻底,促进了酵母的大量繁殖,后期酵母自溶也会产生大量α-氨基态氮。

表5 不同麦曲对黄酒酿造的影响Table 5 The influence of different wheat Qu in rice wine brewing
研究发现,与米曲霉苏-16纯种熟麦曲相比,细菌与真菌混合熟麦曲酒精度相对提高17.4%,具有很高的潜在应用价值。
2.5.3 黄酒风味物质检测
通过GC-MS定量试验对添加不同麦曲黄酒样品中挥发性香气化合物进行定量分析,检测出的香气化合物主要为醇类、酯类、脂肪酸、芳香族化合物、此外还有部分酚类及其衍生物、酯化合物、硫化物等。
图3列出了添加不同麦曲酿造所得黄酒样品中挥发性物质总含量情况。添加手工曲酿造的黄酒中挥发性化合物含量最高,达到122 423.62 μg/L,分析原因为:手工曲为生料,小麦原料本身也含有较多的香气成分,比较添加几种熟麦曲的黄酒样品中挥发性化合物含量,发现随着麦曲中接入菌种的增多,所酿造的黄酒中挥发性化合物总量也不断增加,并且增加部分主要为酸类化合物,是由于熟麦曲3中酶活较高,酿造过程中糖化、液化速度较快,使得酵母较快完成发酵过程而衰老,抑制杂菌能力减退,后期产酸细菌大量繁殖,酸类化合物合成增多。

图3 不同黄酒样品挥发性香气成分总含量Fig.3 Amount of volatiles quantified in different rice wine
在测定出的挥发性化合物中,含量最多的物质是乙酸和苯乙醇,他们对黄酒香气的形成有比较重要的贡献,熟麦曲1酿造的黄酒中未检测到苯乙醇。从化合物种类上看,醇类、酸类和酯类化合物是含量较多的3类化合物,特别是挥发性风味物质不仅含量丰富并且数量也较多,包括乙酸乙酯、乳酸乙酯、乙酸辛酯、甲氧基乙酸乙酯、苯乙酸酯、邻氨基苯甲酸肉桂酯等10几种,几种麦曲样品酿造的黄酒样品相比而言,熟麦曲1和熟麦曲2酒样中酯类化合物种类和含量都少于熟麦曲3和手工曲酒样。酸类化合物中乙酸和异丁酸在几种酒样中普遍存在,但相比而言熟麦曲3酒样中含量和数量都较多,还包括甲氧基乙酸、N-乙酰胞壁酸、乙酰氧基乙酸、D-丝氨酸等多种其他酸类。总体来说,熟麦曲3酿造的黄酒中香气物质明显增多,较接近手工曲酿造的黄酒,但是香气物质较集中,实际生产中要控制好麦曲用量,平衡好发酵速度,才能保证较好的黄酒质量。
3 结论
(1)对从酒厂环境中分离得到的细菌进行筛选,获得了5株产淀粉酶和蛋白酶能力较强的菌株,经分子生物学鉴定,主要为芽孢杆菌属微生物。
(2)均匀设计优化细菌与真菌混合制曲条件为:培养温度36℃,真菌与细菌接种量分别为5.5%和3.5%,细菌接入时间为真菌菌种培养36 h后,接入细菌后强化麦曲3种主要水解酶酶活较米曲霉苏-16纯种熟麦曲分别提高了38.6%,106%,100%。
(3)将强化后的麦曲应用于黄酒酿造,实验结果显示:强化麦曲能够加快黄酒酿造速度,缩短主酵时间,原料利用较彻底,酒精度相对提高17.4%,提高了原料利用率。由于强化麦曲属于细菌与真菌混合接种,弥补了单一菌种熟麦曲的劣势,黄酒样品指标测试结果表明:强化麦曲所酿造的黄酒中氨基态氮含量大量增加,是生麦曲酿造的黄酒样品的7倍,同时黄酒样品中挥发性物质总含量也有所增加,与单一菌种熟麦曲相比,更有助于保持黄酒风味。
[1] 寿泉洪.生麦曲和熟麦曲在黄酒生产中的应用研究[D].无锡:江南大学,2006:12-18.
[2] 余培斌,陈亮亮,张波,等.双菌种制曲改善黄酒麦曲品质的研究[J].食品与发酵工业,2012,38(9):1-6.
[3] 张中华.绍兴黄酒麦曲中微生物群落结构的研究[D].无锡:江南大学,2012:10-16.
[4] 王刚.微生物发酵改善菜籽粕品质的初步研究[D].无锡:江南大学,2011:3-15.
[5] 谢广发.黄酒酿造技术[M].北京:中国轻工业出版社2010:51-54.
[6] 罗涛,范文来,徐岩,等.我国江浙沪黄酒中特征挥发性物质香气活力研究[J].中国酿造,2009(2):14-18.
[7] GB/T 13662-2000.黄酒[S].
[8] 酿酒编辑部.白酒生产技术[J].酿酒增刊,1982.
[9] 顾国贤.酿造酒工艺学[M].第2版.北京:中国轻工业出版社,2007:454-517.
[10] 周恒刚.根霉漫谈[J].酿酒科技,1993(3):7-11.
