牛血与肌原纤维蛋白混合物的凝胶特性*
2015-12-25高雷卢士玲张冬冬田盼
高雷,卢士玲,张冬冬,田盼
(石河子大学食品学院,新疆石河子,832000)
我国畜血资源丰富,然而,在我国绝大多数屠宰厂,牲畜屠宰后的血液,除极少量用于制作血豆腐或饲料外,大部分畜血被废弃,不仅蛋白质资源流失,还造成严重的环境污染[1]。畜血的蛋白质含量很高,和肉相近,被称为“液体肉”,有很大的利用价值。若能将畜血应用到肉与肉制品加工中,则可以充分利用其营养价值。
肌原纤维蛋白是肌肉中一类具有重要生物学功能特性的盐溶结构蛋白群,主要由肌球蛋白、肌动蛋白、原肌球蛋白、肌钙蛋白等构成[2]。肌原纤维蛋白热诱导凝胶对肉制品的硬度、保水性、质地等特性有重要的影响,而这些功能特性是量化产品的质量和开发新的肉制品的关键因素,因此研究肌原纤维蛋白凝胶特性对肉制品加工很重要[3-4]。近年来,国内外学者研究了pH、温度、离子强度和谷氨酰胺转氨酶等因素对肌原纤维蛋白功能特性的影响[5-7]。本实验将不同量的牛血添加到肌原纤维蛋白中,通过测定牛血-肌原纤维蛋白混合物的乳化能力、凝胶保水性和凝胶强度的变化情况,来研究血液添加量对牛血-肌原纤维蛋白混合物凝胶特性和乳化能力的影响。
1 材料和方法
1.1 材料与仪器
1.1.1 材料与试剂
猪里脊肉,石河子好家乡超市;牛血,石河子西部牧业屠宰场;EGTA、牛血清蛋白(BSA)Sigma试剂公司,分析纯;其他试剂,均为国产分析纯。
1.1.2 主要仪器设备
Neofuge台式高速冷冻离心机(15R),方康发展有限公司;T25-DS25匀浆机,UCTRA-TURRAX;Uvmini-1240紫外可见分光光度计,SHIMADZU CORPORATIDN;H18424NEW pH计,北京哈纳科技有限公司;CT3质构仪,北京东林昌盛生物科技公司。
1.2 实验方法
1.2.1 肌原纤维蛋白的提取
参照韩敏义等[8]的方法提取肌原纤维蛋白,100 g解冻的肌肉打碎匀浆后,加入4倍体积的僵直提取缓冲液(100 mmol/L Tris,10 mmol/L EDTA,pH 8.3),1 000×g离心20 min收集沉淀。把沉淀分散在4倍体积的标准盐溶液(SSS)(100 mmol/L KCl,20 mmol/L K2HPO4/KH2PO4,2 mmol/L MgCl2,1 mmol/L EGTA,1 mmol/L NaN3,pH 7.0),1 000×g离心10 min收集沉淀,重复3次,在2次离心之间用高速分散器分散约30 s。沉淀重新分散在4倍体积含1%Triton X-100的SSS中,而后1 500×g离心10 min收集沉淀,重复2次,沉淀加入4倍体积0.1 mol/L KCl,重复2次。最后沉淀加入4倍体积0.l mol/L NaCl,1 500×g离心10 min收集沉淀,得到纯化的肌原纤维蛋白。将肌原纤维蛋白溶解于磷酸盐缓冲溶液(0.6 mol/L NaCl,50 mmol/L Na2HPO4/NaH2PO4)中,蛋白质浓度用双缩脲法测定[9],用牛血清白蛋白做蛋白质浓度标准曲线,提取的肌原纤维蛋白在24 h内用完。
1.2.2 牛血的采集
从牛羊屠宰场采集牛血,用1%柠檬酸钠为抗凝剂,牛血存放在4℃的冰箱内备用。
1.2.3 肌原纤维蛋白凝胶的制备
将肌原纤维蛋白溶液调整到一定浓度,并将牛血和肌原纤维蛋白溶液以 0∶10(对照组)、1∶9、2∶8、3∶7、4∶6、5∶5的体积比混合,最终控制混合物中肌原纤维蛋白的浓度分别为 10、20、30、40、50、60 mg/mL。研究不同肌原纤维蛋白浓度下,牛血添加量对混合物凝胶特性的影响。凝胶制备步骤:将10 mL的混合溶液装于离心管中,置于水浴锅中以大约1℃/min的速率从20~70℃线性升温,而后在70℃保温20 min形成凝胶,于4℃冰箱内冷却过夜,然后进行凝胶强度和保水性的测定。
1.2.4 乳化能力的测定
取一定浓度的肌原纤维蛋白溶液,添加不同量(体积比0∶10~5∶5)的血液,得到的混合溶液测定乳化能力。以乳化活性指数(EAI)和乳化稳定性(ESI)表示肌原纤维蛋白的乳化能力,采用浊度法测定[10]。将混合蛋白溶液用磷酸盐缓冲溶液稀释,使混合物蛋白浓度为1 mg/mL(已用凯氏定氮法测定牛血含量为21%)。测定时,分别取2.0 mL大豆油和8.0 mL混合蛋白溶液置于体积为50 mL的塑料离心管中,高速匀浆1 min,立即从距离心管管底0.5 cm的地方用微量取样器取出50 μL匀浆液,加入到含有5 mL 0.1%的SDS溶液的试管中,振荡均匀后用紫外分光光度计在500 nm处测定吸光值记作A0,匀浆后10 min再次在相同位置取匀浆液50 μL,加入到另一个含有5 mL 0.1%的SDS溶液的试管中,振荡混匀后测定吸光值记做A10,同时用0.1%的SDS溶液作空白对照。根据公式计算EAI和ESI:
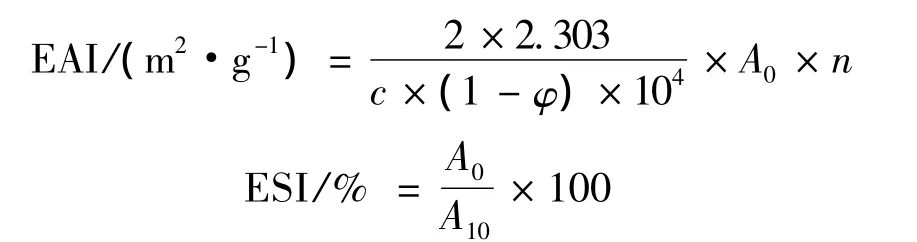
式中:c为蛋白质浓度;φ为乳化液中油所占的体积比;n为乳状液稀释的倍数;A0、A10为乳状液在0 min和10 min的吸光值。
1.2.5 凝胶强度的测定
利用CT3质构仪测定样品的凝胶强度[11],计算公式为:
凝胶强度/(g·mm)=断裂强度(g)×凹陷深度(mm)。
1.2.6 凝胶保水性的测定
凝胶保水性的测定基于Kocher和Foegeding的离心法[12]。将制备的混合物凝胶于0~4℃下经10 000×g离心10 min去除离出的液体,记录空离心管的重量以及离心前后离心管与凝胶的总重。根据公式计算凝胶保水性(WHC):
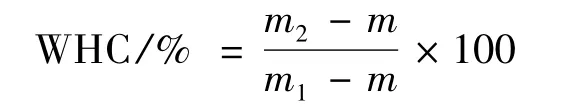
式中:m为离心管重,质量为离心前离心管与凝胶质量;m2为离心后离心管与凝胶质量。
1.2.7 数据处理
每个实验重复3次。数据统计分析采用SPSS 19进行方差分析,如果方差分析效应显著,使用Duncan multiple range test进行多重比较。
2 结果和分析
2.1 血液添加量对牛血-肌原纤维蛋白混合物凝胶强度的影响
不同肌原纤维蛋白浓度下血液添加量对混合物凝胶强度的影响(如图1),添加血液后,混合物的凝胶强度比肌原纤维蛋白凝胶的凝胶强度明显增加。随着血液添加比例的不断增加,混合物的凝胶强度呈现增加的趋势。通过比较发现,添加体积比为1∶9时与对照组相比,混合物的凝胶强度增加不显著(P>0.05);当添加比例在2∶8~4∶6时,混合物的凝胶强度随着血液添加比例的增加而显著增加(P<0.05)。继续添加血液后,比例5∶5与比例4∶6相比,混合物的凝胶强度差异不显著(P>0.05)。
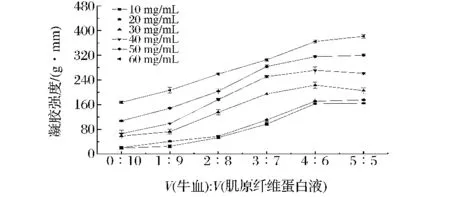
图1 不同肌原纤维蛋白浓度下血液添加量对混合物凝胶强度的影响Fig.1 Effect of blood on gel strength of the mixture at different concentration of myofibrillar protein
当比例一定时,凝胶的凝胶强度随着蛋白浓度的增加呈现增加的趋势。通过比较发现,当浓度为10和20 mg/mL时,两者凝胶的凝胶强度大小差异不显著(P>0.05),当浓度为20~60 mg/mL时,随着浓度的增加,随着浓度的增加凝胶的凝胶强度大小增加差异显著 (P<0.05)。因血液本身具有凝胶性,加入到肌原纤维蛋白后,两者共同交联形成三维网络结构,使肌原纤维蛋白凝胶的凝胶强度有了较大的提高。可以看出,在体积比0∶10~4∶6时,随着血液添加量的增加,血液-肌原纤维蛋白混合物的凝胶强度明显增加;但体积比在4∶6之后继续添加血液,混合物的凝胶强度变化不显著。
2.2 血液添加量对牛血-肌原纤维蛋白混合物凝胶保水性的影响
不同肌原纤维浓度下血液添加量对混合物凝胶强度的影响(如图2),随着血液添加量不断增加,混合物凝胶的保水性基本呈现先减小后增加的趋势。加入血液后,凝胶的保水性减小且差异不显著(P>0.05)。体积比0∶10~2∶8,凝胶的保水性逐渐减小且在比例为2∶8时,凝胶保水性达到最低;从比例2∶8到4∶6,凝胶的保水性逐渐增大,并且凝胶的保水性增加显著(P<0.05)。比例为5∶5与4∶6,相比较差异不显著(P>0.05)。因此,当添加血液比例在0∶10~3∶7时,与对照组相比凝胶的保水性减小;当添加比例达到4∶6以上时,与对照组相比,混合物凝胶的保水性增大。因此选择4∶6以上的比例进行添加血液,可提高凝胶的保水性。当添加少量血液时,凝胶的保水性下降,可能是因为少量的血液可以阻碍肌原纤维蛋白凝胶网状结构的形成,使凝胶网状结构截留水分减少,从而使凝胶保水性降低,当添加量加大时,血液凝胶保水性的逐渐显现,占据主要地位,从而混合凝胶的保水性增大。还可从图2中看出,随着肌原纤维蛋白浓度的增加,凝胶的保水性不断增加。Xiong[13]和徐幸莲等[14]都曾提出,增大蛋白质的溶解度,能够提高凝胶的保水性。
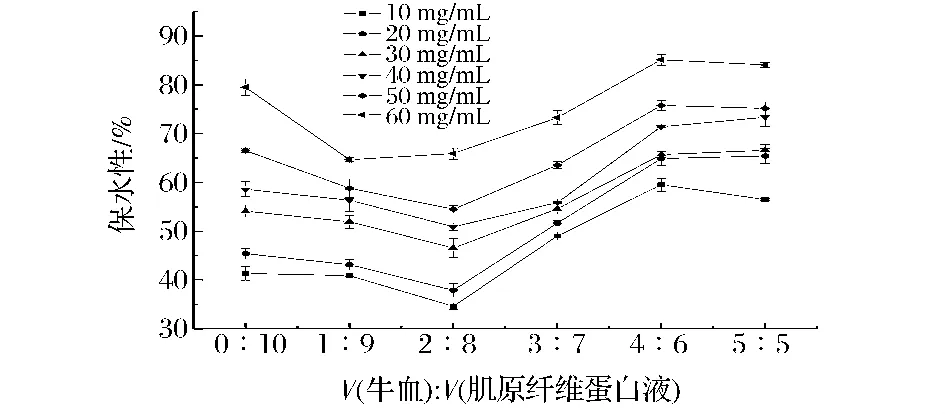
图2 不同肌原纤维浓度下血液添加量对混合物保水性的影响Fig.2 Effect of blood on water-holding capacity of the mixture gel at different concentration of myofibrillar protein
2.3 血液添加量对牛血-肌原纤维蛋白混合物乳化活性和乳化稳定性的影响
乳化能力是指蛋白质乳化脂肪的能力,通常以EAI和ESI反映乳化能力的大小。血液添加量对牛血-肌原纤维蛋白混合液 EAI和 ESI的影响(如图3),随着血液添加量的增加,混合物的EAI呈现先增加后减小的趋势。在体积比为4∶6时,混合物的EAI达到最大。添加血液后,混合物的EAI与对照组相比显著增加(P<0.05)。但在比例1∶9~5∶5,肌原纤维蛋白EAI变化差异不显著(P>0.05)。根据Agyare等[10]:乳化活力指数(EAI)是表示蛋白质作为乳化剂乳化效力的一种方法。在高蛋白浓度时,蛋白在油水界面的吸收是被限制扩散的。在低浓度时,由于肽的快速吸收,使得有较大的扩散系数,促进了油与样品溶液的相互作用,而样品浓度的增加会导致样品溶液中肽的聚集,进而使乳化活力下降。因血液中含有蛋白,少量添加后可提高EAI,但添加量过多时,体系中蛋白浓度增大,因而EAI又减小。
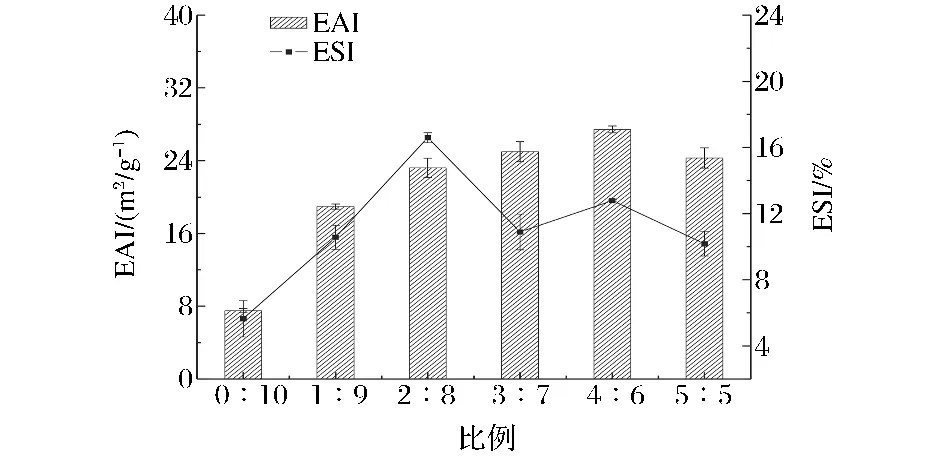
图3 血液添加量对牛血-肌原纤维蛋白混合液EAI和ESI的影响Fig.3 Effect of blood on EAI and ESI ofthe mixture
牛血-肌原纤维蛋白混合物的ESI随着添加比例的增加先增加后减少,在体积比2∶8时,混合物的ESI最大。但在体积比3∶7之后继续添加,混合物的ESI变化差异不显著(P>0.05)。与对照组相比,血液-肌原纤维蛋白混合物的ESI明显提高。
3 结论
将牛血添加到肌原纤维蛋白后,混合物的乳化能力和凝胶强度明显增强。与对照组相比,添加血液后混合物的凝胶强度显著提高(P<0.05),且随着比例的增加凝胶强度不断增大,但比例4∶6之后继续添加变化不显著(P>0.05);混合物的凝胶保水性先降低后增加,当添加比例达到4∶6以上时,与对照组相比凝胶的保水性明显增大;添加血液后混合物溶液的EAI和ESI显著增加(P<0.05)且在体积比为4∶6时混合物的EAI最大。由此看出,当添加牛血比例为4∶6时,牛血-肌原纤维蛋白混合物具有较好的凝胶强度、保水性和乳化活性指数。
[1] 钟耀广,南庆贤.国内外畜血研究动态[J].中国农业科技导报,2003,5(3):26-29.
[2] 夏秀芳,孔保华,张宏伟.肌原纤维蛋白凝胶形成机理及影响因素的研究进展[J].食品科学,2009,30(9):264-268.
[3] Westphalen A D,Briggs J L,Lonergan S M.Influence of muscle type on rheological properties of porcine myofibrillar protein during heat-induced gelation[J].Meat Science,2006,72(4):697-703.
[4] Gordon A,Barbut S.Effect of chloride salts on protein extraction and interfacial protein film formation in meat batters[J].Journal of the Science of Food and Agriculture,1992,58(2):227-238.
[5] CHIN K B,GO M Y,XIONG Y L.Konjac flour improved textural and water retention properties of transglutaminasemediated,heat-induced porcine myofibrillar protein gel:Effect of salt level and transglutaminase incubation[J].Meat Science,2009,81(3):565-572.
[6] Bertram H C,Kristensen M,Andersen H J.Functionality of myofibrillar proteins as affected by pH,ionic strength and heat treatment-a low-field NMR study[J],Meat Science,2004,68(2):249-256.
[7] Sun X D,Arntfield S D.Gelation properties of chicken myofibrillar protein induced by transglutaminase crosslinking[J].Journal of Food Engineering,2011,107(2):226-233.
[8] HAN M Y,ZHANG Y J,FEI Y,et al.Effect of microbial transglutaminase on NMR relaxometry and microstructure of pork myofibrillar protein gel[J].European Food Research and Technology,2009,228(4):665-670.
[9] Gomall A G,Bardawill C J,David M M.Deterrnination of serum Proteins by means of the biuret reaetion[J].Journal of Biological Chemistry,1949,177(2):751-766.
[10] Agyare K K,Addo K,Xiong Y L.Emulsifying and foaming properties of transglutaminase treated wheat gluten hydrolysate as influenced by pH,temperature and salt[J].Food Hydrocolloids,2009,23(1):72-81.
[11] 王卫芳.鱼肉猪肉复合凝胶制品的开发及其影响因素研究[D].武汉:华中农业大学,2006.
[12] Kocher P N,Foegeding E A.Microcentrifuge-based method for measuring water holding of Protein gels[J].Journal of Food Science,1993,58(5):1 040-1 046.
[13] XIONG Y L,Brekke C J.Changes in protein solubility and gelation properties of chicken myofibrils during storage[J].Journal of food science,1989,54(5):1 141-1 146.
[14] 徐幸莲,周光宏,黄鸿兵,等.蛋白质浓度、pH值、离子强度对兔骨胳肌肌球蛋白热凝胶特性的影响[J].江苏农业学报,2004,20(3):159-163.
