枯草芽孢杆菌二步发酵法生产5’-肌苷酸*
2015-12-25何菊华吴雪娇谢希贤徐庆阳张成林陈宁
何菊华,吴雪娇,谢希贤,2,3,徐庆阳,2,3,张成林,2,3,陈宁,2,3
1(天津科技大学生物工程学院,天津,300457)
2(天津市氨基酸高效绿色制造工程实验室,天津,300457)
3(代谢控制发酵技术国家地方联合工程实验室,天津,300457)
5’-肌苷酸(inosine 5’-monophosphate,5’-IMP)常以二钠盐形式存在,为5’-肌苷酸二钠(disodium 5’-inosinate,IMPNa2),广泛存在于肉类和蘑菇中。1913年,日本的小玉新太郎发现煮沸的金枪鱼辅汤带有的鲜味来自于5’-IMP,随后其作为鲜味剂广泛使用[1]。5’-IMP作为膳食核苷酸,对婴幼儿的肠道发育也十分重要,常被添加到婴幼儿配方奶粉中[2]。
5’-IMP的生产最早主要是依靠化学合成法和水解法。随着学者们对微生物发酵法的不断深入研究,发酵技术越来越成熟,人们开始尝试用微生物发酵法直接发酵生产5’-IMP[3]。直接发酵法中,由于肌苷酸是一种羰基磷酸酯,极性大,难以透过细胞膜排出胞外,而产氨棒杆菌(Corynebacterium ammoniagenes)具有“分段式”合成5’-IMP的能力,即利用分泌到胞外的补救合成途径酶系以及次黄嘌呤和5-磷酸核糖-1-焦磷酸重新合成肌苷酸,能够有效解决肌苷酸跨膜运输困难的问题[4],因此利用微生物发酵法工业化生产中主要以产氨棒杆菌为生产菌。但该工艺发酵周期较长(约120 h)且发酵工艺复杂、成本高。
目前化学磷酸化法生产5’-IMP也被广泛应用。该方法是选用适当的有机溶剂、POCl3和吡啶混合液,在适宜温度下高选择性地对核苷5’-羟基磷酸化。然而由于化学磷酸化方法所使用的溶剂量很大,其中还包括昂贵及有剧毒试剂(如POCl3)安全控制难度大、工艺要求高、生产成本高且在生产过程中会产生大量废水严重污染[5]。
现阶段酶法、化学合成法等生产5’-IMP均以商品化的肌苷为底物进行,该过程无疑增大了生产成本且商品化肌苷常经过一系列化学修饰处理,生物源亲和性不及微生物细胞自身代谢产生的肌苷。酶法催化虽具有大量优点,但相对于直接发酵法生产5’-IMP,增加了处理发酵液、收集酶源细胞等大量工作。因此,如何将发酵产生的肌苷低成本、高选择性、高转化率地转化为肌苷酸成为了5’-IMP生产工艺的关键问题。
本文在研究来源于摩氏摩根菌Morganella morganii的酸性磷酸酶AP/PTaseM催化条件基础上,将该酶编码基因phoCYM克隆至肌苷生产菌株Bacillus subtilis JG,根据重组菌株合成肌苷和酸性磷酸酶特性通过调控发酵条件实现了枯草芽孢杆菌二步发酵法生产5’-IMP。本文可为5’-IMP及其他核苷酸的生产提供了新思路和新方法。
1 材料与方法
1.1 菌株及质粒
表1为本研究所用菌株及质粒。

表1 本研究所用菌株Table 1 Strains in this study
1.2 引物
表2为本研究所用引物,均由Primer Premier 5.0软件设计。

表2 本研究所用引物Table 2 Primers in this study
1.3 主要试剂和仪器
Solution I连接酶、限制性内切酶BamHI和PstI,大连宝生物工程有限公司;Taq DNA聚合酶,北京全式金生物技术有限公司;1 kb DNA marker,Fermentas公司;PCR产物纯化试剂盒和胶回收试剂盒,北京天恩泽基因科技有限公司;引物合成与基因测序,苏州金唯智生物技术有限公司;电穿孔仪,Eppendorf公司;高效液相色谱系统,美国安捷伦公司。
1.4 感受态的制备及转化
大肠杆菌化转感受态制备、载体连接及连接体系转化均按照相关试剂盒说明书进行操作。枯草芽孢杆菌感受态的制备参见参考文献[9]。
1.5 培养基
LB培养基(g/L):NaCl 10,酵母粉5.0,蛋白胨10,氨苄青霉素100 mg。
B.subtilis摇瓶种子培养基(g/L):葡萄糖20,酵母浸膏15,玉米浆 12,尿素 2.0,NaCl 2.5,卡那霉素50 mg。
B.subtilis发酵培养基(g/L):葡萄糖100,酵母浸出粉 16,(NH4)2SO422,MgSO4·7H2O 5.0,KH2PO45.0,卡那霉素 50 mg。
1.6 培养方法
1.6.1 E.coli诱导培养条件
按1%接种量将摇管培养的菌液接种于100 mL摇瓶中,37 ℃,200 r/min培养至OD600=0.6~0.8,加入终浓度为0.1 mmol/L的IPTG,30℃诱导培养6 h。
1.6.2 B.subtilis发酵生产肌苷培养条件
斜面活化培养:取单菌落划线接种于活化斜面,32℃培养20~24 h。
种子培养:用接种环从第3代活化斜面上挑取2环菌于30 mL种子培养基中(9层纱布封口),32℃140 r/min振荡培养7~10 h。
摇瓶分批发酵培养:按10%接种量取3 mL种子培养液接入30 mL发酵培养基中(9层纱布封口),0~18 h:32℃,200 r/min;18~30 h:34℃,200 r/min;30~68 h:36℃,200 r/min,全程用氨水控制pH 6.4。
1.6.3 二步发酵法实验操作流程
利用方法1.6.2对B.subtilis JAB和B.subtilis JAF进行发酵培养,积累肌苷;发酵结束用冰乙酸调节发酵体系pH至5.2,添加200 mmol/L焦磷酸钠作为磷酸供体,35℃下进行第二步发酵催化反应。
1.7 发酵过程参数测定
菌体生物量测定:用蒸馏水按适当倍数稀释发酵液,采用752分光光度计测定OD600。
残糖浓度测定:取发酵液1 mL,13 000 r/min离心1 min,取上清 10 μL,用去离子水稀释至 1 000 μL,取25 μL稀释后样品进样,采用SBA-40E多功能葡萄糖-谷氨酸分析仪测定葡萄糖含量。
肌苷和5’-IMP浓度测定:利用HPLC进行测定。条件:柱温30℃,检测波长245 nm,流动相总流量1.0 mL/min,色谱柱为 PuXiang C18柱(250 mm ×416 mm,5 μm),流动相为 V(甲醇)∶V(磷酸盐缓冲液)=1∶9。
1.8 大肠杆菌表达酸性磷酸酶酶学性质分析
1.8.1 酶源细胞的制备
将菌液于4℃,5 000 r/min离心10 min后收集菌体细胞并用磷酸盐缓冲液洗涤3次后重悬,调整其OD600=25,所得溶液即为酶源细胞悬浮液。
1.8.2 酶活力测定
标准酶活测定条件:反应体系为 10 mL,100 mmol/L肌苷,200 mmol/L十水合焦磷酸钠,0.1 mol/L醋酸盐缓冲液,2 mL酶源细胞悬浮液。反应混合物充分混合均匀后立即置于30℃水浴恒温振荡器中,反应7 h后加入250 μL 25%NaOH终止反应。催化生成的5’-肌苷酸二钠采用HPLC定量分析。按标准酶活测定条件配制10 mL反应体系混合物于不同温度或pH条件下反应7 h后终止反应并计算酶活,以测定酸性磷酸酶的最适反应温度和pH。
酶活力单位定义为:在标准酶活测定条件下,1 h催化底物肌苷生成1 mmol 5’-肌苷酸钠所需的酶量为1个酶活力单位,即1 U。
2 结果与讨论
2.1 基因序列的优化及酶活力验证
根据相关文献报道[6],以公布的phoC基因为出发序列(NCIB 10466),根据枯草芽孢杆菌密码子偏爱性对其密码子进行优化,并对两个位点的氨基酸进行替换(G92D,I171T)[7],切除前端信号肽,全基因合成序列phoCYM,通过BamHI和PstI连接表达载体pQE30。将获得的重组质粒 pQE30-phoCYM转化入XL1-Blue中,构建能够表达酸性磷酸酶重组菌XL1-Blue+pQE30-phoCYM,并通过SDS-PAGE分析目的蛋白和进行最适催化条件优化。SDS-PAGE凝胶电泳结果如图1所示。温度及pH对酶活的影响见图2和图3。
由图1可知,构建的重组菌XL1-Blue+pQE30-phoCYM在IPTG诱导条件下能够表达目的蛋白,泳道2在27.0 kDa附近有目的蛋白条带出现。说明重组菌XL1-Blue+pQE30-phoCYM构建成功。
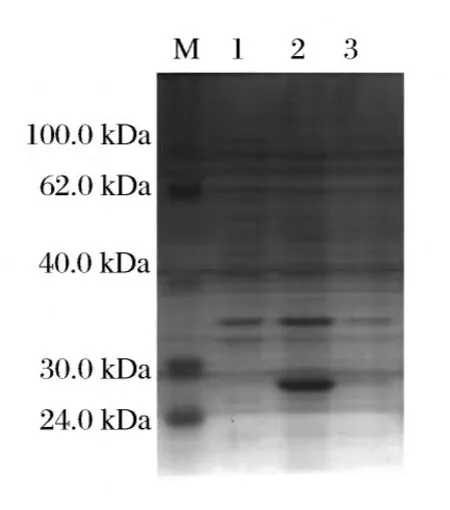
图1 E.coli XL1-Blue+pQE30-phoCYM蛋白电泳分析Fig.1 SDS-PAGE analysis of expression proteins of E.coli XL1-Blue+pQE30-phoCYM
温度和pH是酶催化反应过程中的重要影响因素。由图2和图3可知,酸性磷酸酶催化生成5’-IMP的最适反应温度为35℃,最适反应pH为5.2。
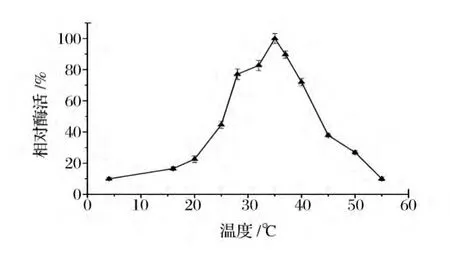
图2 温度对全细胞催化的影响Fig.2 Effect of temperature on whole-cell catalysis
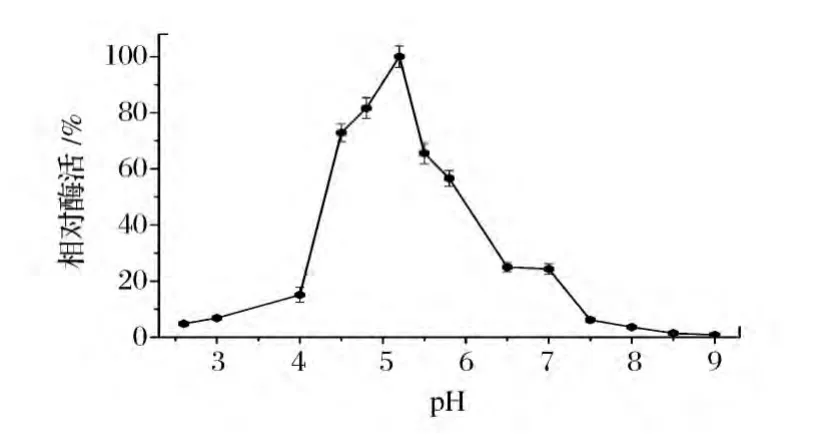
图3 pH对全细胞催化的影响Fig.3 Effect of pH on whole-cell catalysis
2.2 重组质粒pBE43-phoCYAM及pBSA43-phoCY -CM的构建
pBE43及pBSA43均含有强转录能力的P43启动子,且P43启动子是一种组成型启动子,外源蛋白基因在质粒上的转录无需诱导。pBSA43与pBE43的最大区别在于前者有一段sacB信号肽序列,为分泌型表达载体,后者为胞内型表达载体。
根据phoCYM序列,采用Primer Premier 5.0软件分别设计引物,以质粒pQE30-phoCYM为模板,分别P1-P3,P2-P3为引物获得目的片段phoCYAM和phoCYCM。将获得的目的片段连接质粒pMD19-TS,并转化E.coli DH5α,构建大肠杆菌-枯草芽孢杆菌穿梭质粒pBE43-phoCYAM和pBSA43-phoCYCM。以pBE43-phoCYAM为例,构建步骤简图如图4所示。
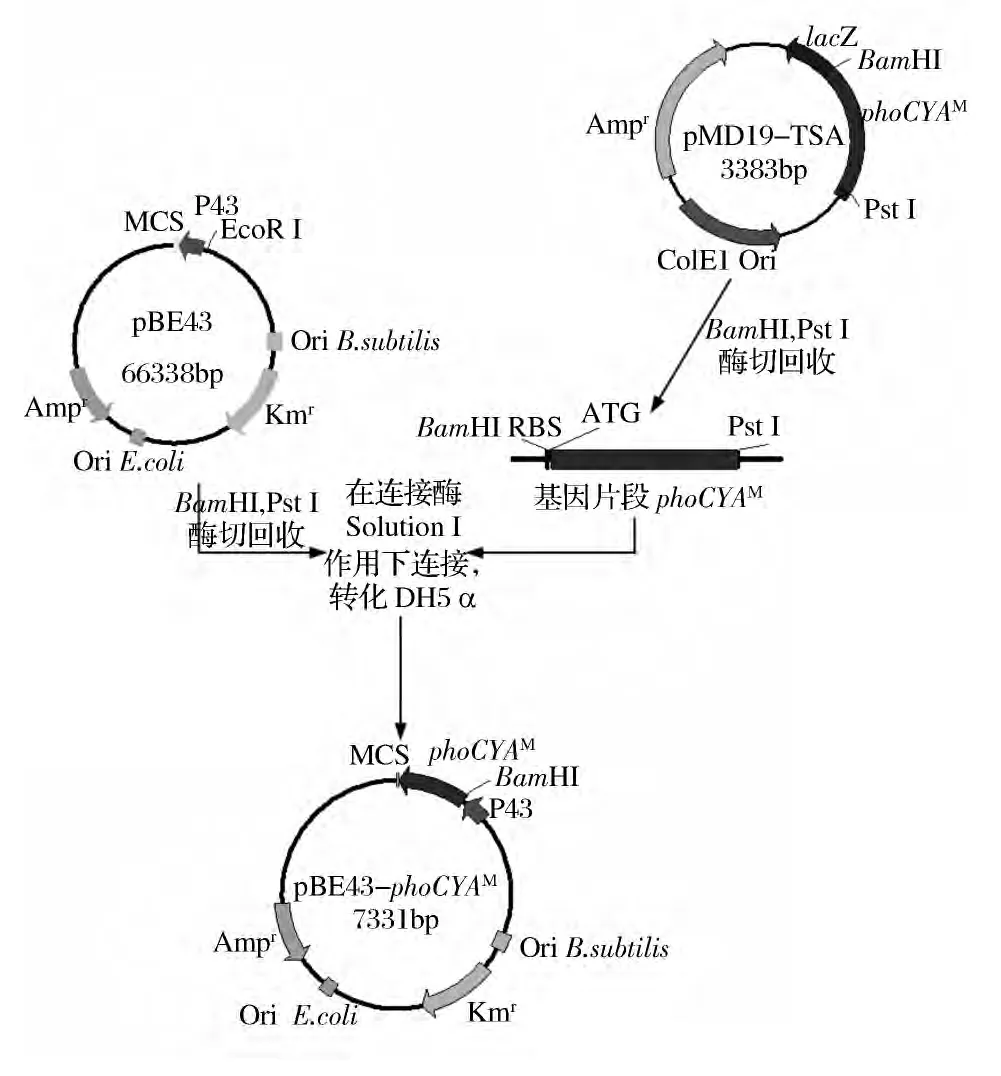
图4 重组质粒pBE43-phoCYAM构建图Fig.4 Construction of recombinant plasmid pBE43-phoCYAM
2.3 重组菌B.subtilis JAB和B.subtilis JAF的构建
将重组质粒pBE43-phoCYAM和pBSA43-phoCYCM分别电转化入B.subtilis JG中,用终浓度5 μg/mL卡那霉素LB抗性平板进行阳性克隆子的筛选,鉴定引物为P4,P5。对获得的阳性克隆子进行酶切验证。验证结果如图5所示。
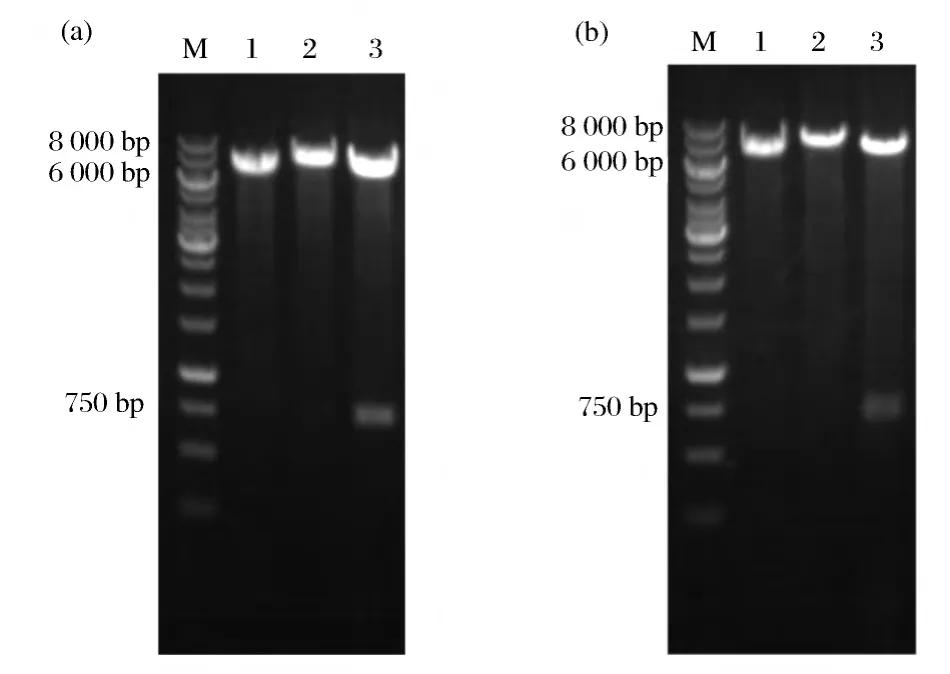
图5 重组质粒pBE43-phoCYAM(a)和pBSA43-phoCYCM(b)酶切验证Fig.5 Identification of recombinant plasmids pBE43-phoCYAM(a)and pBSA43-phoCYCM(b)by digestion
由酶切结果可知,重组菌B.subtilis JG+pBE43-phoCYAM,B.subtilis JG+pBSA43-phoCYCM构建成功,分别命名简称为B.subtilis JAB和B.subtilis JAF。
2.4 重组菌B.subtilis JAB和B.subtilis JAF蛋白电泳分析
通过SDS-PAGE蛋白电泳分析验证了AP/PTaseM在重组菌内的表达情况。结果如图6所示,与空白对照B.subtilis JG+pBE43(泳道1)相比较,重组菌B.subtilis JG+pBE43-phoCYAM(泳道2)在20.1~29.0 kDa处出现明显蛋白条带,与目的基因编码AP/PTaseM的蛋白分子质量理论值27.0 kDa接近,说明重组菌B.subtilis JG+pBE43-phoCYAM构建成功。同上,重组菌B.subtilis JG+pBSA43-phoCYCM与空白对照菌 B.subtilis JG+pBSA43(泳道 3)相比较,在20.1~29.0 kDa处出现较明显蛋白条带(泳道4),与理论值27.0 kDa接近,说明重组菌B.subtilis JG+pBSA43-phoCYCM构建成功。综上所述 AP/PTaseM在两株重组菌内成功表达。

图6 B.subtilis重组菌蛋白电泳图谱Fig.6 SDS-PAGE analysis of expression proteins in all recombinant B.subtilis
2.5 B.subtilis重组菌二步发酵法生产5’-IMP验证
肌苷发酵条件为32~36℃、pH 6.4,而酸性磷酸酶AP/PTaseM催化肌苷生成5’-IMP最适反应条件为35℃,pH 5.2,因此,采用二步法进行5’-IMP的生产,即先在肌苷发酵条件下发酵,待肌苷产量和酸性磷酸酶活力达到最高值时,投入底物焦磷酸钠并调节发酵液pH至5.2,温度降至35℃,使肌苷转化为5’-IMP。
为确定两个阶段最佳转换时刻,分别将B.subtilis JAB和B.subtilis JAF发酵培养72 h并间隔取样测定肌苷产量、酸性磷酸酶活性以及生物量。结果如图7和图8所示,二者生物量均随着发酵时间的延长而增加;发酵60 h时,B.subtilis JAB的肌苷产量(14.7 g/L)和相对酶活均达到最高值;发酵54 h时,B.subtilis JAF相对酶活达到最高,后续发酵过程中酶活为92%~94%,60~72 h时,肌苷含量达到最高值(15.5 g/L)。
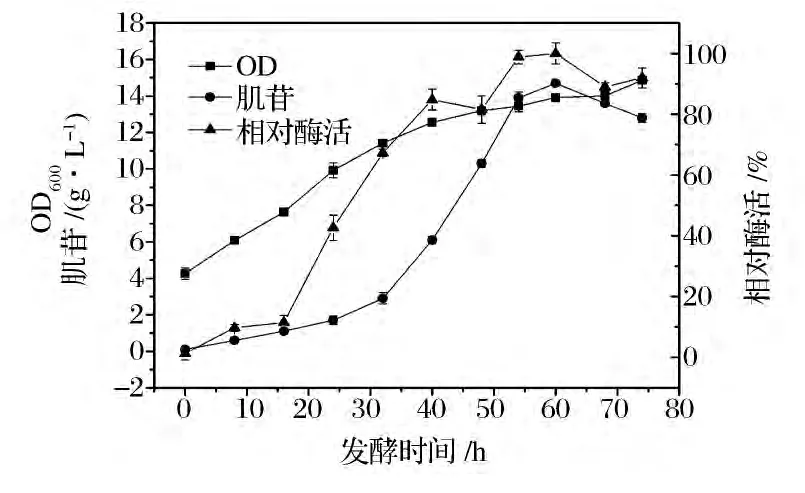
图7 B.subtilis JAB发酵过程曲线Fig.7 Fermentation process of B.subtilis JAB

图8 B.subtilis JAF发酵过程曲线Fig.8 Fermentation process of B.subtilis JAF
因此,选定60 h为两个阶段最佳转换时间点,以分别利用 B.subtilis JG,B.subtilis JG+pBE43,B.subtilis JG+pBSA43,B.subtilis JAB 及 B.subtilis JAF进行二步法发酵生产5’-IMP并测定5’-IMP产量、肌苷残留量。结果如图9所示,5株菌株均能够生成5’-IMP,尽管 B.subtilis JG,B.subtilis JG+pBE43和B.subtilis JG+pBSA43无酸性磷酸酶编码基因,但5’-IMP为肌苷的前体物,因此有 5’-IMP生成。B.subtilis JAB和B.subtilis JAF的5’-IMP产量约为3株对照菌株的近2倍。B.subtilis JAF较 B.subtilis JAB提高了25.96%,可能原因是JAF分泌表达了AP/PTaseM,与胞内表达AP/PTaseM相比,前者增加了与发酵液中肌苷的结合[8],从而能够转化生成更多5’-IMP。
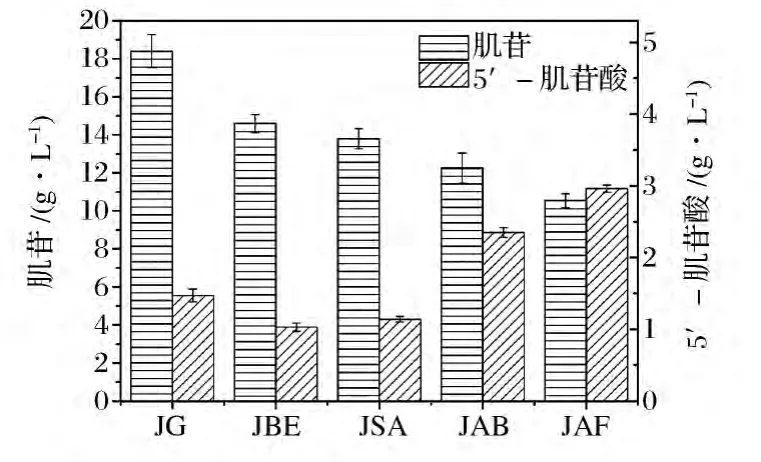
图9 不同枯草芽孢杆菌菌株生产肌苷和5’-IMP的比较Fig.9 Production of inosine and 5’-IMP with different B.subtilis strains
尽管JAB,JAF能够有效积累5’-IMP,但其产量较低(分别为2.4 g/L和3.0 g/L),其原因可能是:(1)B.subtilis JG菌株的5’-核苷磷酸酶活性较强,使得合成的5’-IMP去磷酸化生成肌苷;(2)JAB,JAF在发酵条件下表达的酸性磷酸酶AP/PTaseM与常规培养条件下获得的酶源细胞酶活较低,直接影响了5’-IMP的转化高效率;(3)发酵液环境中的复杂成分(如离子等)影响酶的催化效率,从而导致5’-IMP产量偏低。
3 结论
本文在获得酶催化最适条件的基础上,首次提出了枯草芽孢杆菌二步发酵法生产5’-IMP,结果表明利用肌苷生产菌表达的酸性磷酸酶能够将微生物自身积累产生的肌苷转化生成5’-IMP。在后续研究过程中,可对其二步发酵法工艺进行进一步的研究和优化,提高5’-IMP产量。
[1] 杜琨,张亚宁,方多.呈味核苷酸及其在食品中的应用[J].中国酿造,2005(10):50-52.
[2] Echarri P P,Saseta C F,Bermudez C G,et al.Effect of nucleotides used as enrichment of infants formulas on intestinal cell ultrastructure and microbiota[J].Annals of Nutrition and Metabolism,2011,58:93-93.
[3] 张志军,温明浩,王克文,等.核苷酸生产技术现状及展望[J].现代化工,2004(11):19-23.
[4] Furuya A,Abe S,Kinoshita S.Production of nucleic acid-related substances by fermentative processes.28.Accumulation of 5'inosinic acid by a manganese-insensitive mutant of Brevibacterium ammoniagenes[J].Applied Microbiology,1969,18(6):977-984.
[5] 戚娜,朱利民.5'-核苷酸的合成方法比较[J].生物技术通报,2006(S1):242-245;250.
[6] Asano Y,Y Mihara,H Yamada.A novel selective nucleoside phosphorylating enzyme from Morganella morganii[J].Journal of Bioscience and Bioengineering,1999,87(6):732-738.
[7] Mihara Y,Utagawa T,Yamada H,et al.Phosphorylation of nucleosides by the mutated acid phosphatase from Morganella morganii[J].Applied and Environmental Microbiology,2000,66(7):2 811-2 816.
[8] Lee S-K,Mo S,Suh J-W.Erratum to:An ABC transporter complex containing S-adenosylmethionine(SAM)-induced ATP-binding protein is involved in antibiotics production and SAM signaling in Streptomyces coelicolor M145[J].Biotechnology Letters,2013,35(6):985.
[9] XUE G P,Jennifer S J,Brian P D.High osmolarity improves the electro-transformation efficiency of the gram-positive bacteria Bacillus subtilis and Bacillus licheniforms[J].Journal of Microbiological Methods,1999,34(3):183-191.
