‘神农菊’挥发油提取优化及其在牛奶中的抑菌性能*
2015-12-25宋彦丽蒋细旺王金新张建
宋彦丽,蒋细旺,王金新,张建
(江汉大学 生命科学院,湖北武汉,430056)
‘神农香菊’(Dendranthema indicum(L.)Des Moul.var.aromaticum Q.H.Liu et S.F.Zhang)原产于湖北神农架,为武汉植物研究所刘启宏先生于1982年发现并命名的一种新资源植物,全株具有浓郁的香气[1]。研究发现,‘神农香菊’中含有丰富的挥发油[2],挥发油存在于植物的油室、油管、分泌细胞或树脂道中,由萜烯类化合物、醛酯类及醇类化合物等化学成分组成。国内外研究表明挥发油具有抗菌消炎、抗氧化、抗肿瘤、抗病毒等多种药理功能[3-6],这引起了现代化食品、烟草、医药等行业的广泛关注[7~9]。
在植物性天然香料生产方法中,用于提取挥发油的方法主要有水蒸气蒸馏法[10]、超临界流体萃取法[11]、有机溶剂萃取法[12]等,从提取成本、产量、操作、环保、安全等多方面综合考虑,选用成本低、操作简单、环保、产品安全系数高的水蒸气蒸馏法来提取菊花挥发油在相关行业最具普遍性。
为了进一步开发‘神农香菊’,项目组在引种栽培、建立其体细胞胚胎发生体系的基础上[13-15],利用细胞工程技术以产于湖北省神农架地区的‘神农香菊’为材料获得了相应的耐热体细胞无性系变异体[16-18],经过9 a的筛选、种植,获得了性状稳定的茶用菊花新种质(待发表),暂命名为‘神农菊’。迄今为止,对‘神农菊’挥发油的提取工艺与其在牛奶中的应用尚未见报道。本研究以‘神农菊’挥发油提取率为评价指标,在蒸馏提取时间、提取料液比、提取氯化钠浓度的单因素试验基础上,根据Box-Benhnken中心组合试验设计原理,运用响应面分析法(Response Surface Methodology,RSM)[19-20]对‘神农菊’挥发油的提取条件进行了分析和优化,根据试验数据建立了二次多项式回归方程,得到了提取‘神农菊’挥发油的最佳工艺条件,在其工业化生产中具有深远意义。同时,为了进一步开发应用‘神农菊’挥发油,对最优化条件下提取的挥发油进行了体外抑菌试验。
1 材料与方法
1.1 试验材料
供试材料:‘神农菊’,采自江汉大学生命科学学院实验基地,处理后材料的含水率低于8%,用高速中药粉碎机粉碎过60目筛,保存于4℃冰箱备用。鲜牛乳,市售已经过消毒灭菌的光明鲜牛乳(距生产日期2 d)。
NaCl、吐温-80(乳化剂)等化学试剂均为分析纯。
1.2 实验方法
1.2.1 ‘神农菊’挥发油的提取方法
取粉碎度为60目的‘神农菊’试样50 g,配制一定浓度的NaCl溶液,在烧杯中与‘神农菊’充分混匀,置2 000 mL圆底烧瓶中,加数粒玻璃珠并振摇混合。参照中国药典一部附录XD并做一定的改动,连接挥发油测定器与回流冷凝管,自冷凝管上端加氯化钠溶液使其充满挥发油测定器的刻度部分,然后将烧瓶置电热套中加热至微沸,调压并保持微沸状态,自冷凝管滴下第1滴水开始计时,蒸馏一定时间,收集挥发油并精密称重,计算提取率:

1.2.2 ‘神农菊’提取物挥发油在牛奶中的抑菌效果
取750 mL的鲜牛乳均分为15份,分成3组,每组处理分别为空白对照、阴性对照、挥发油(最优条件下提取),10%吐温-80溶液稀释挥发油至适宜浓度(过滤除菌),添加适量于鲜牛乳中使其浓度分别为0.05%、0.1%、0.2%作为试验组,25℃水浴敞口放置。采用平板菌落计数法(参照GB4789.2-2010《食品微生物学检验菌落总数测定》),分别按照一定的稀释梯度稀释,并涂于固体培养基上于37℃恒温培养箱培养48 h。为减少偶然误差,分别在试样处理时与24 h水浴后在超净工作台上各测定一次,计算菌落总数:

1.3 数据处理
相同提取条件与相同处理条件下,对样品均进行3次平行试验,试验结果取其平均值。
2 结果与分析
2.1 挥发油的提取优化
2.1.1 单因素试验
分别就浸泡时间、蒸馏时间、料液比、NaCl浓度等实验因素对‘神农菊’挥发油得率的影响进行了预试验。结果显示,浸泡时间对挥发油得率的影响不显著,而蒸馏时间、料液比、NaCl浓度对挥发油的得率影响较大。为进一步了解蒸馏时间、料液比、NaCl浓度3种因素对挥发油提取率的影响特性,项目组通过单因素试验对3种因素进行了研究。
2.1.1.1 蒸馏时间对‘神农菊’挥发油提取率的影响
按照1.2.1节的方法,设6组试验,溶剂为5%氯化钠溶液,料液比为1∶10,而蒸馏时间分别设置为2、3、4、5、6、7 h,进行水蒸气蒸馏,称重并计算提取率,结果见图1。
从图1可以看出,随着蒸馏时间的增加,挥发油提取率不断提高,蒸馏时间为5 h时得率最高,当提取时间达到6 h时,挥发油的得率反而有缓慢下降的趋势。
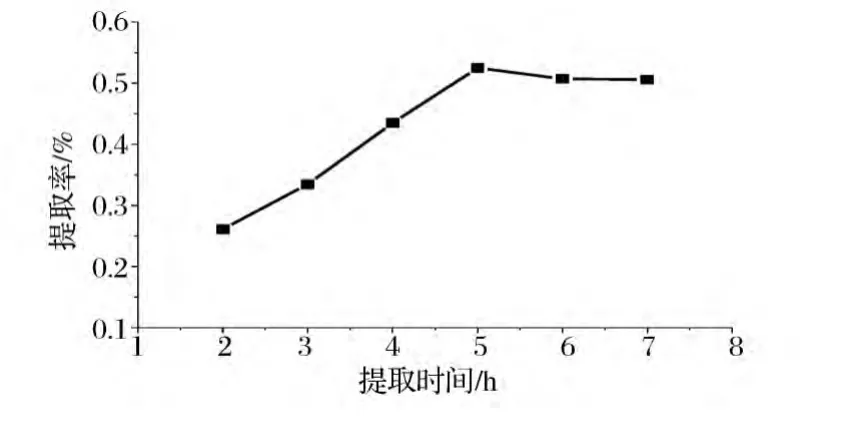
图1 提取时间对挥发油得率的影响Fig.1 Effect of extraction time on the extraction rate of the volatile oil from the C.morifolium cv Shennongju
根据盐析法原理及传热传质原理[21-22],随着提取时间的增加,无机盐离子在与挥发性成分争夺水分子过程中逐渐占据主导地位,这使得从溶液中分离出来的挥发性物质越来越多,并在提取时间5 h时提取率达到最大;但随着时间的增加,无机盐离子与水分子结合的过程达到动态平衡,且由于高温环境破坏了部分沸点较高的挥发性成分,从而导致提取率下降。
综合考虑提取效率和提取质量,选择提取时间为4~6 h作为进一步研究的有效水平区间。
2.1.1.2 料液比对‘神农菊’挥发油提取率的影响
按照1.2.1节的方法,设6组试验,溶剂为5%NaCl溶液,蒸馏时间3 h,料液比分别设置为1∶8、1∶10、1∶12、1∶14、1∶16、1∶18(g∶mL),进行水蒸气蒸馏,称重并计算提取率,结果见图2。
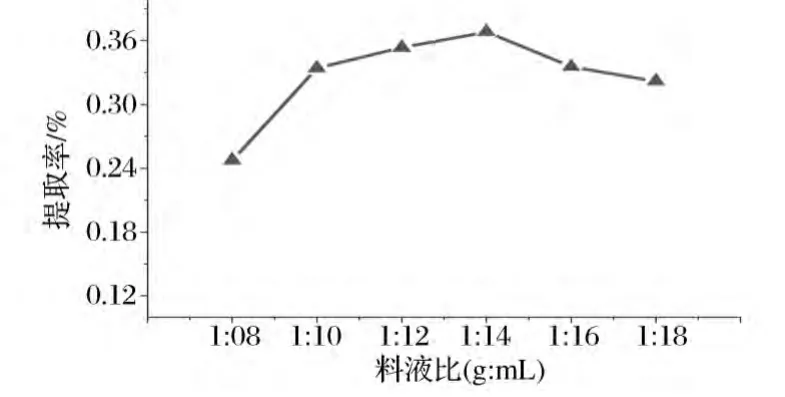
图2 料液比对挥发油的率的影响Fig.2 Effect of fliquid to material ratio on the extraction rate of the volatile oil from the C.morifolium cv Shennongju
由图2可得随着料液比的加大,挥发油得率不断提高,当料液比为1∶14时达到最高,随着料液比的继续加大,挥发油的得率缓慢减少。
由于无机盐离子在提取体系中争夺水分子能力有限,随着料液比的增加,有效的挥发性分子量增加,在8~14倍溶剂倍量内,挥发油的提取率持续增加;但在14~18倍溶剂倍量范围内,由于其他成分的析出阻碍了挥发性成分的有效析出,故继续增大溶剂倍量,反而降低了挥发油的提取率。
综合考虑提取的效率及挥发油的纯度,选择料液比为1∶12~1∶16作为进一步研究的有效水平区间。
2.1.1.3 NaCl浓度对‘神农菊’挥发油提取率的影响
按照1.2.1节的方法,设6组试验,料液比为1∶10,蒸馏时间为3 h,NaCl浓度分别设置为0%、5%、10%、15%、20%、25%进行水蒸气蒸馏,称重并计算提取率,结果见图3。
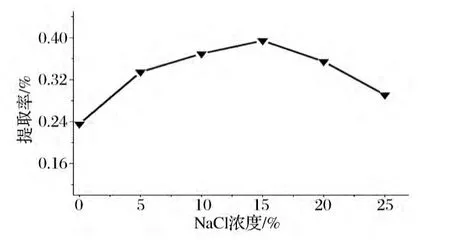
图3 NaCl浓度对挥发油得率的影响Fig.3 Effect of concentration of sodium choride on the extraction rate of the volatile oil from the C.morifolium cv Shennongju
由图3可以看出随着NaCl浓度的不断加大,挥发油的得率不断提高,当NaCl浓度为15%是时,挥发油的得率达到了最高,随着NaCl的浓度继续加大,挥发油得率反而减少。
随着NaCl浓度的增加,试验体系中无机盐离子争夺水分子的能力不断增加,导致挥发性物质的溶解度不断降低,故NaCl浓度在0% ~15%浓度内,挥发油的得率不断增加;但无机盐浓度大于15%,随着NaCl浓度的增加,由于样品中其他难溶性成分析出阻碍了挥发性成分的分离,从而出现了持续增加无机盐浓度,挥发油得率反而降低的现象。
综合考虑提取的效率及挥发油的纯度,选择挥发油提取NaCl浓度为10% ~20%。
2.1.2 采用响应面分析法对‘神农菊’挥发油提取工艺的优化
2.1.2.1 响应面分析因素水平的选取
依据Box-Benhnken的中心组合试验设计原理,综合2.1.1节单因素影响试验结果,选取提取时间、溶剂倍量(即液料比)、NaCl浓度对‘神农菊’挥发油得率影响显著的3个因素,在单因素试验的基础上采用3因素3水平的响应面分析方法做了进一步的实验研究。试验因素与水平设计见表1。

表1 响应面实验因素与水平Table 1 Code values and actual values of the optimzation variables used in Box-Benhnken experimental design
2.1.2.2 响应面分析试验设计方案
以提取时间A、溶剂倍量B、氯化钠浓度C为自变量,以变异菊花挥发油得率Y为响应值,进行响应面分析实验。实验方案及实验结果见表2。
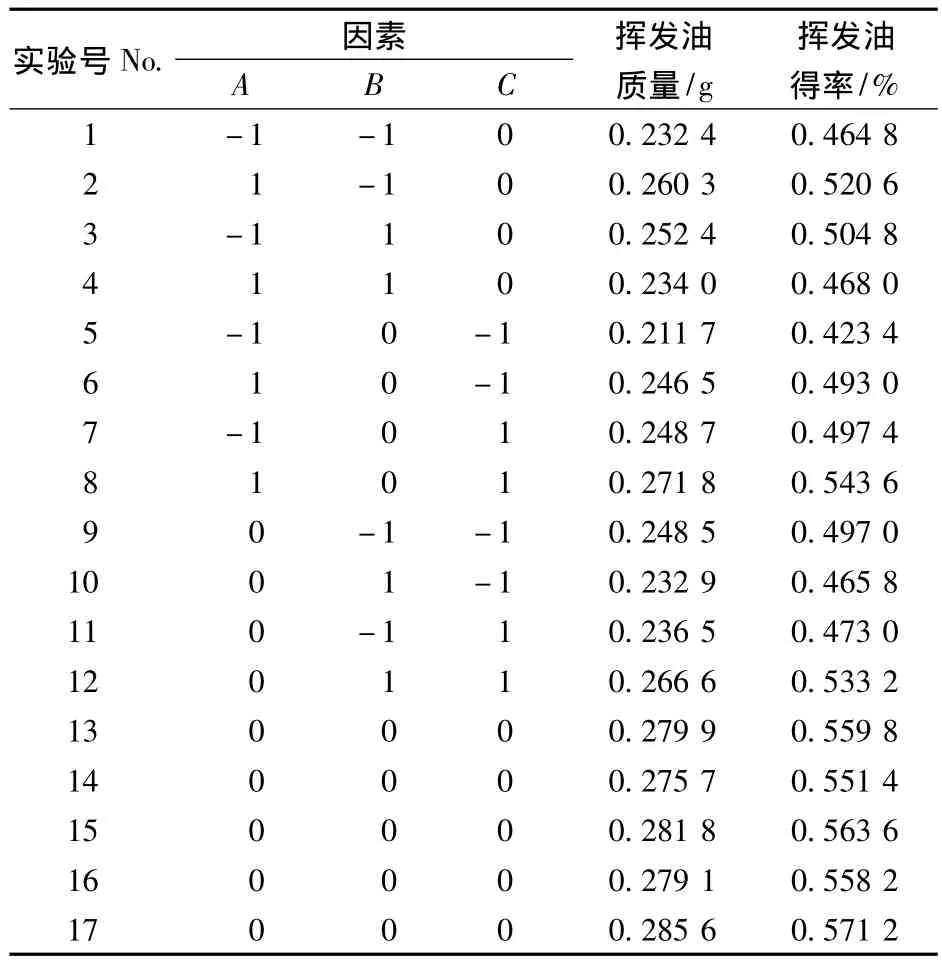
表2 ‘神农菊’挥发油萃取响应面实验设计及结果Table 2 Box-Benhnken experimental design and corresponding result of the extraction rate of the volatile oil from the C.morifolium cv Shennongju
2.1.2.3 多元二次响应面回归模型的建立与分析
用RAM软件对表2试验结果进行二次回归响应面分析,建立多元二次响应面回归模型:
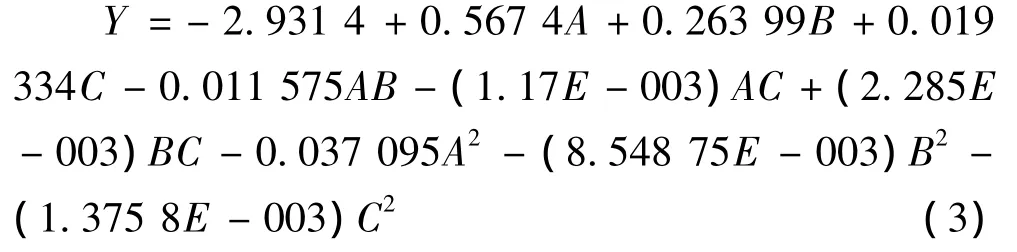
式(3)中:Y为‘神农菊’挥发油提取率的预测值;A、B、C分别为蒸馏时间、溶剂倍量与NaCl浓度的编码值。
各因素的方差分析见表3。
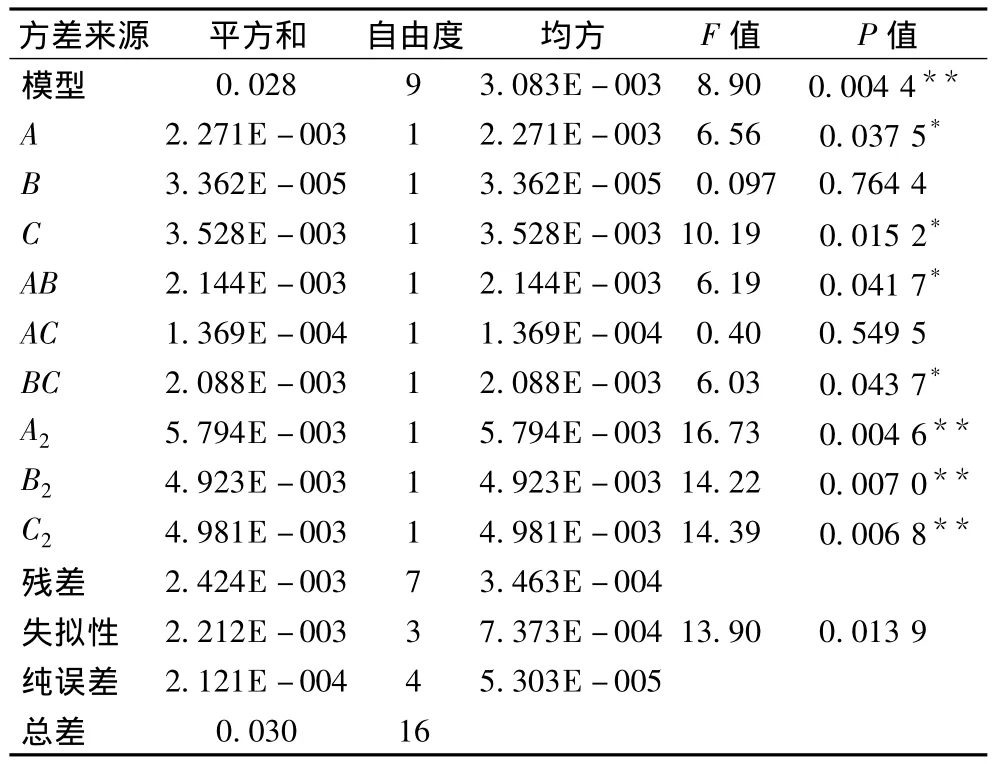
表3 响应面方差分析Table 3 ANOVA of response surface parameters
从表3的方差分析可见,回归方程各因子与响应值之间的线性关系具有显著性。蒸馏时间A、NaCl浓度C、蒸馏时间与溶剂倍量的交互作用AB、溶剂倍量与NaCl浓度之间的交互作用BC均对‘神农菊’挥发油的提取率有显著性影响,其 Prob值分别为0.037 5、0.015 2、0.041 7、0.043 7。
溶剂倍量B、蒸馏时间与NaCl浓度的交互作用AC对‘神农菊’挥发油的提取率无显著性影响,Prob值分别为0.764 4、0.549 5。同时可以看出影响‘神农菊’挥发油提取率的各因素大小为C>A>B。由响应面软件SAS8.0.6得到的分析结果可知:模型的R=93.3%,证明这种实验方法是可靠的,使用该方程模拟真实的3因子3水平的分析是可行的。
从表3可以看出,蒸馏时间与溶剂倍量的交互作用、溶剂倍量与NaCl浓度之间的交互作用显著,实验结果见图4和图6,蒸馏时间与NaCl浓度的交互作用见图5。
2.1.2.4 模型的验证性试验
通过解‘神农菊’挥发油得率的二次多项数学模型,得出最佳提取条件为:提取时间为5.18 h、溶剂倍量为14.15倍、NaCl浓度16.58%。在最佳化提取条件下,‘神农菊’挥发油提取率的预测值为0.566%。
为检验RSM法的可靠性,根据上述最优提取条件,对‘神农菊’挥发油进行了提取。同时为方便实际操作,节约生产成本,将‘神农菊’挥发油的提取最佳条件修正为提取时间为5 h、溶剂倍量为15倍、氯化钠浓度为16.5%,并在此条件下进行3次平行试验,实际测得的提取率均值为0.559%,与理论预测值比较接近,说明采用RSM法优化得到挥发油的提取工艺条件准确可靠,具有实用价值。
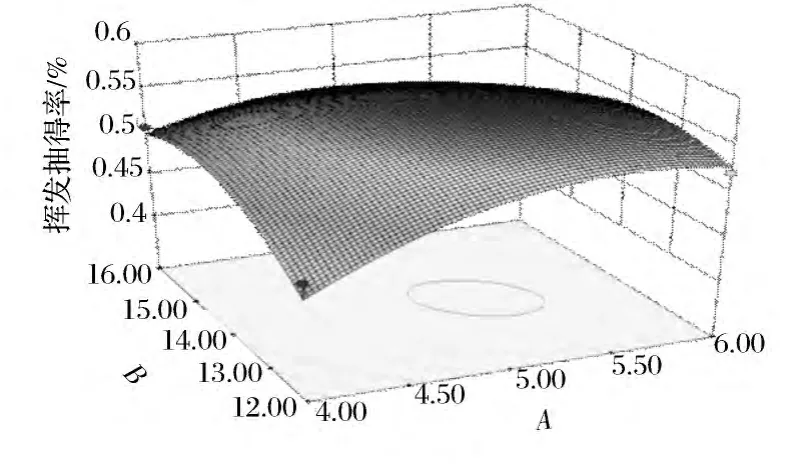
图4 蒸馏提取时间与溶剂倍量交互作用对变异菊花挥发油提取率影响的响应面图Fig.4 Response surface plots for the interactive effects of extraction time and fliquid to material ratio on the extraction rate of the volatile oil from the C.morifolium cv Shennongju

图5 蒸馏提取时间与NaCl浓度交互作用对变异菊花挥发油提取率影响的响应面图Fig.5 Response surface plots for the interactive effects of extraction time and concentration of sodium choride on the extraction rate of the volatile oil from the C.morifolium cv Shennongju
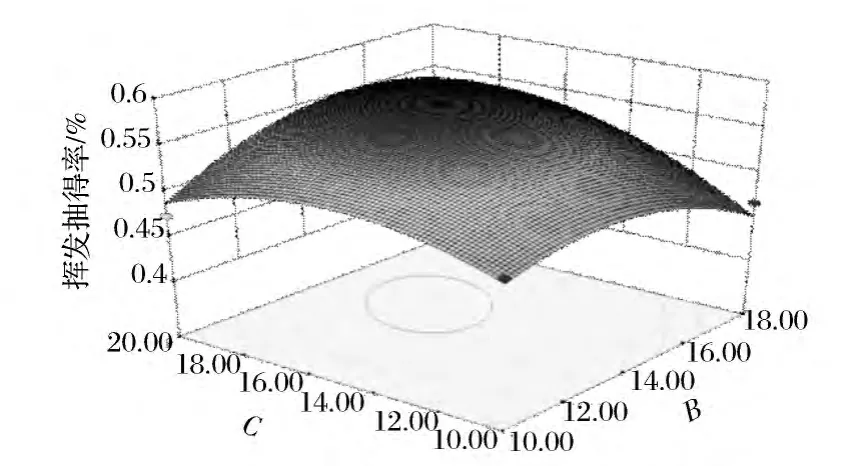
图6 NaCl浓度与溶剂倍量交互作用对变异菊花挥发油提取率影响的响应面图Fig.6 Response surface plots for the interactive effects of concentration of sodium choride and liquid to material ratio on the extraction rate of the volatile oil from the C.morifolium cv Shennongju
2.2 ‘神农菊’挥发油对牛乳中微生物的抑制作用
通过平板菌落计数法,测出每板菌落数,利用公式(2)计算出鲜牛乳在处理时与24 h敞口放置后总菌数。详情见图7和图8。

图7 处理时牛乳中微生物的总菌数Fig.7 The total count of microorganisms in milk processing

图8 24 h后牛乳中微生物的总菌数Fig.8 The total count of microorganisms in milk after 24h
由图7可以看出,处理时各个试样的微生物数量相差不显著;图8试验结果显示,25℃恒温水浴24 h后微生物的数量达到107CFU/mL,空白对照与阴性对照牛乳中总菌数没有明显差异,加入‘神农菊’提取物挥发油后较未加挥发油的牛乳中的总菌数明显减少,且与挥发油浓度呈正相关。
试验结果表明,在温度高于25℃的夏天,鲜牛乳开盖24 h后微生物数量已严重超标,不再适宜饮用;‘神农菊’挥发油对微生物有明显的抑制作用,但抑制作用有限。有相关研究报道植物挥发油具有一定的抗菌活性[23-24],但对不同菌种的抑制程度差异较大,且抑菌成分及抑制机理等问题尚不明确,需要进一步研究。
3 结论
RSM法是一种优化反应条件和加工工艺参数的方法,具有周期短、试验次数少、求得的回归方程精度高等优点。通过RSM法得到提取‘神农菊’挥发油的最佳条件:提取时间5.18 h、溶剂倍量为14.15倍、NaCl浓度16.58%;兼顾操作性及生产成本,选取提取时间5 h、溶剂倍量为15倍、NaCl浓度16.5%的提取条件,得到实际提取率为0.559%,与理论预测值0.566%相差仅为0.11%;在试验过程中选择NaCl溶液代替蒸馏水来提取挥发油明显改善了挥发油贴壁与下沉的现象,这一结论对‘神农菊’进一步的开发、加工提供较好的理论基础和实践指导。
体外抑菌实验结果显示‘神农菊’挥发油具有一定的抑菌作用,并与挥发油的浓度成正相关。添加适量的挥发油除能延长牛乳保质期外又增添了挥发油的保健功能。这一研究结论为挥发油作为天然防腐剂来替代食品防腐剂提供了一定的理论参考,具有较高的应用价值。
[1] 刘启宏,张红旗,贾卫疆.湖北新资源植物——神农香菊的地理分布、生态习性与蕴藏量的调查研究[J].武汉植物学研究,1983,1(2):239-246.
[2] 姜从良,芦金清,李竣,等.神农香菊中挥发油、总黄酮与杭菊花、贡菊花的比较研究[J].湖北中医学院学报,2001,3(3):48-49.
[3] Ukiya M,Akihisa T,Yasukawaet K,et al.Constituents of compositae plants.2.Triterpene diols,triols,and their 3-ofatty acid esters from edible chrysanthemum flower extract and their anti-inflammatory effects[J].J Agric Food Chem,2001,49(7):3 187-3 197.
[4] P.Alvarez Castellanos P,D Bishop C,Jpascual Villalobos M.Antifungal activity of the essential oil of flowerheads of garland chrysanthemum(Chrysanthemum coronarium)against agricultural pathogens[J].Phytochem,2001,57(1):99-102.
[5] Lee J S,Kim H J,Lee Y S.A new anti-HIV Flavonoid Glucuronide from Chrysanthemum morifolium[J].Planta Med,2003,69(9):859-861.
[6] SU J,TAN L,LAI P,et al.Experimental study on anti-inflammatory activity of a TCM recipe consisting of the supercritical fluid CO2extract of Chrysanthemum indicum,patchouli oil and zedoary turmeric oil in vivo[J].J Ethnopharmacol,2012,141(2):608-614.
[7] 房海灵,郭巧生,申海进.在5种食用油中野菊花挥发油的抗氧化能力研究[J].植物资源与环境学报,2010,19(2):54-59.
[8] 谢超.神农香菊抗氧化活性及其应用研究[D].武汉:湖北中医药大学,2012:57-74.
[9] 田硕,苗明三.菊花的研究及应用现状[J].中医学,2014,29(190):378-380.
[10] Mustafa Z.Ozel﹒ HilalKaymaz.Superheated water extraction,steam distillation and Soxhlet extraction of essential oils of Origanumonites[J].Anal Bioanal Chem,2004,379(7/8):1 127-1 133.
[11] JU Hen-yi,HUANG Kuo-chuan,Chen Jiann-Hwa,et al.Optimization of the extraction of Alpiniaoxyphylla essence oil in supercritical carbon dioxide[J].J Am Oil ChemSoc,2010,87:1 063-1 070.
[12] 蒋红梅,卢向阳,方俊,等.石香薷挥发油提取工艺研究[J].中药材,2007,9(30):1 135-1 139.
[13] 蒋细旺,张启翔.地被菊间接体细胞胚发生途径的转基因受体体系的研究[J].林业科学研究,2007,20(3):328-333.
[14] 蒋细旺,陈发菊,陆苗,等.地被菊直接体细胞胚发生研究[J].北京林业大学学报,2008,30(2):65-70.
[15] JIANG X W,ZHANG Q X,ZHANG P,et al.Heat tolerance of ground-cover Chrysanthemum[J].Acta Horticulturae,2008,766:89-96.
[16] JIANG X W,YANG X.High semi-lethal temperature and heat tolerance of tea Chrysanthemum[J].Acta Horticulturae,2013,977:369-376.
[17] 杨小秋,韩磊,傅厚暾,蒋细旺.高效液相色谱紫外检测法测定茶(药)用菊花的绿原酸含量[J].分析仪器,2013(1):12-15.
[18] 蒋细旺.花草茶的种类、保健功能及使用[J].长江大学学报:自然科学版,2013,10(17):62-66.
[19] Macros A B,Ricardo E.S,Eliane P O,et al.Response surface methodology(RSM)as a tool for optimization in analytical chemistry[J].Talanta,2008,76(5):965-977.
[20] LI Quan-hong,FU Cai-li.Application of response surface methodology forextraction optimization ofgerminant pumpkin seeds protein[J].Food Chem,2005,92(4):701-706.
[21] 杨义芳.中药与天然活性产物分离纯化和制备[M].北京:科学出版社,2011.
[22] Frank P Incropera.Fundamentals of heat and mass Transfer[M].The United States of America:John Wiley &Sons Inc,2006.
[23] Ahlem Ben Sassi,Fethia Harzallah-Skhiri,Imed Chraief,et al.Chemical composition and antimicrobial activities of the essential oil of(Tunisian)Chrysanthemum trifurcatum(Desf.)Batt.and Trab.flowerheads[J].Science-Direct,2008,11:324-330.
[24] Bajpai Vivek K,Sharma Ajay,Baek Kwang-Hyun.Antibacterial mode of action of Cudrania tricuspidata fruit essential oil,affecting membrane permeability and surface characteristics of food-borne pathogens[J].Food Control,2013,32(2):582-590.
