培养基质对蛹虫草中虫草酸及核苷类物质的影响*
2015-12-25刘桂君周思静林金星
刘桂君,周思静,林金星
1(北京林业大学生物科学与技术学院,北京,100083)2(北京市辐射中心,北京,100015)
蛹虫草(Cordyceps militaris(L.)Link)[1]是我国传统的食药用菌,含有丰富的虫草酸及虫草素等核苷类活性物质[2]。虫草酸即甘露醇,是蛹虫草的重要活性成分,具有镇咳、平喘及祛痰等作用[3],对人体内羟基自由基具有良好的清除作用,还可降低颅内压和眼内压,也是良好的利尿剂和食品甜味剂[4]。虫草素(cordycepin)即3'-脱氧腺苷,是 Cunningham 等在1950年从蛹虫草寄生的昆虫不腐烂组织中分离得到的抗菌物质,也是第一个从真菌中分离出来的核苷类抗菌素[5-6]。虫草素具有免疫调节、抗肿瘤、抗菌、抗病毒和治疗白血病等功效[7-11]。此外,蛹虫草还含有腺苷、尿苷、鸟苷、胸苷及腺嘌呤等核苷类成分。
目前,虫草素等核苷类物质的主要来源还是蛹虫草培养物,因此蛹虫草固体培养方法优化一直是蛹虫草研究中的热点。顾冬艳等按照大豆粉与麦麸4∶1的质量比,再添加特定配方的营养液,得到蛹虫草的虫草素产量为 5 499.12 μg/g[12],此研究仅是单一的对培养基配方进行优化,且以虫草素一种物质的含量作为衡量指标;张红霞等研究蛹虫草不同栽培菌株之间虫草素及腺苷的差异,虫草素含量为600~3 900 μg/g,腺苷含量为1 000 ~1 700 μg/g[13],该研究仅以虫草素和腺苷2种物质为衡量指标,考察不同菌株之间的差异,并未考虑培养基质的影响;李辰等研究蛹虫草及其培养残基中腺苷和虫草素含量的快速测定方法,采用高效液相色谱法仅同时测定腺苷及虫草素2种物质的含量[14];乐昕等研究不同栽培基质对蛹虫草子实体中腺苷、虫草素、SOD及粗多糖含量的影响[15],未对核苷类物质全面测定;郭涛等研究糯米、粳米及添加家蚕蛹浸提液对蛹虫草中虫草素和腺苷的影响[16];温鲁等以大米为主要原料,添加豆粉、奶粉、鱼粉、蛹粉等,进行试管斜面培养,仅测定固体培养物中虫草素和腺苷含量[17];史敏等建立了多糖以及虫草素、腺苷、尿苷3种核苷类物质的测定方法[18];雷宁等建立了虫草素、腺苷、尿苷及腺嘌呤的测定方法[19]。现有研究主要是集中在蛹虫草活性成分的分离提取、测定方法优化、核苷类物质中1种或2种成分含量的测定等方面。
本实验研究了不同种类培养基质对蛹虫草子座中虫草酸及5种主要核苷类物质含量的影响。实验表明,不同种类培养基质对蛹虫草子座中虫草酸及虫草素等核苷类物质含量影响各有不同,因此,可根据不同的实验目的,选择适合的培养基质。
1 材料与方法
1.1 材料与仪器设备
菌种:蛹虫草(Cordyceps militaris)CM-7,北京市辐射中心微生物实验室保存。
培养基质:大麦、燕麦、大米、小米,均为食品级材料,由超市购得。
蛹虫草液体培养基配方:葡萄糖20 g,蛋白胨20 g,KH2PO41 g,MgSO40.5 g,蒸馏水 1 000 mL,pH 值自然,121℃灭菌30 min。
固体培养基:将培养基质(大麦、燕麦、大米、小米)70 g放入培养瓶中,加入90 mL蛹虫草液体培养基,121℃灭菌30 min。
试剂:甘露醇、高碘酸钠、L-鼠李糖、醋酸铵、冰醋酸、盐酸、乙酰丙酮(均为分析纯),购自国药集团北京化学试剂公司;甲醇(色谱纯),购自CNW公司;尿苷(尿嘧啶核苷,uridine)、鸟苷(鸟嘌呤核苷,guanosine)、胸苷(胸腺嘧啶核苷,thymidine)、腺苷(腺嘌呤核苷,adenosine)、虫草素(cordycepin)为液相色谱纯,购自Sigma试剂公司。
仪器:M3型多功能酶标仪,美国分子仪器公司;1260型高效液相色谱仪,美国安捷伦仪器公司;A10型纯水价,美国密理博仪器公司;REX-500A型人工气候箱,宁波江南仪器厂;ZHWY-2112B型摇床,上海智诚分析仪器制造有限公司。
1.2 蛹虫草固体培养方法
首先培养蛹虫草种子液,将PDA平板上蛹虫草菌种用打孔器打成直径为1 cm的接种块,装有400 mL蛹虫草液体培养基的1 000 mL的三角瓶中每瓶接入5块,摇床180 r/min,25℃培养7 d。将蛹虫草种子液用无菌移液器吸取5 mL均匀的接种到灭菌的固体培养基质表面,25℃恒温避光培养7~10 d,待菌丝布满取出,在超净台中用无菌镊子将上层的菌丝皮翻开打散,使长满菌丝的米粒均匀的分散,然后移入人工气候箱中进行光照培养,温度为20~23℃,设定白天黑夜交替,培养35~40 d,将蛹虫草子座收集,50℃烘干后粉碎备用。
1.3 甘露醇测定方法
1.3.1 标准曲线的制作
标准溶液制备:甘露醇标样100 mg,加蒸馏水100 mL配制成浓度为1 000 μg/mL的甘露醇溶液,然后用蒸馏水分别稀释成所需浓度。取浓度分别为0、31.25、62.5、125、250、500 μg/mL 的甘露醇标准溶液各 1 mL,置于不同试管中,加入1 mL 15 mmol/L高碘酸钠溶液混匀,室温放置10 min,加2 mL 0.1%L-鼠李糖溶液以除去过多的高碘酸盐,混合后加4 mL新配制的Nash试剂(150 g醋酸铵+2 mL冰醋酸+2 mL乙酰丙酮,用蒸馏水稀释定容1 000 mL),53℃水浴加热15 min显色,冷却,在412 nm处测定吸光度值(OD值)[20],根据样品浓度与OD值关系制作标准曲线。
1.3.2 样品处理及甘露醇测定方法
分别准确称量蛹虫草子座粉末1.0 g,各加入20 mL超纯水沸水浴提取1 h,将提取液离心取上清液补水至20 mL,保存样品,待测。取样品提取液1 mL,分置不同试管中,按照1.3.1中的方法,依次加入试剂,水浴加热,测定412 nm时吸光度值,每个样品测定3个平行。
1.4 核苷类物质测定方法
1.4.1 标准曲线的制作
分别准确称取虫草素、腺苷、尿苷、鸟苷及胸苷标样,梯度稀释得到不同浓度标准溶液,腺苷、尿苷、鸟苷及胸苷均为:0、5、10、20、40、80、100 μg/mL,虫草素为:0、31.25、62.5、125、250、500 μg/mL,采用高效液相色谱法(HPLC)测定核苷类物质的含量,具体测定条件如下:DAD检测器;检测波长为260 nm;色谱柱:XDB-C18,4.6 ×250 mm,5 μm;流动相∶V(甲醇)∶V(水)=15∶85;流速 1 mL/min;进样量 10 μL;柱温箱温度为25℃。根据标样浓度与峰面积响应值制作标准曲线。
1.4.2 样品处理及核苷类物质测定方法
分别准确称量蛹虫草子座粉末1.0 g,加入20 mL甲醇,放入磨口三角瓶中,连接回流冷凝装置,70℃回流提取1 h,将提取液8 000 r/min离心5 min,取上清液补甲醇至20 mL,0.22 μm无菌滤膜过滤待测。
2 结果与分析
2.1 甘露醇标准曲线及样品含量测定结果
根据甘露醇浓度 0、31.25、62.5、125、250、500 μg/mL与吸光度值(OD值)之间的关系,得到标准曲线方程为:y=0.005 4x+0.031,R2=0.999 0,表明甘露醇浓度在0~500 μg/mL线性关系良好,适宜测定甘露醇浓度在该区间范围内的样品。将样品测定得到的OD值代入标准曲线方程,计算溶液中甘露醇浓度,再根据溶液浓度计算子座粉末中虫草酸(甘露醇)含量,结果如图1所示。由图1得到,4种培养基质培养获得的子座中,小米子座虫草酸(甘露醇)含量最高,为9.00 mg/g,大米子座含量最低,为7.43 mg/g,燕麦子座和大麦子座虫草酸(甘露醇)含量分别为7.46 mg/g和8.28 mg/g;小米培养基质最利于子座中虫草酸的合成。
2.2 核苷类物质标准曲线
根据尿苷、鸟苷、胸苷、腺苷、虫草素浓度与峰面积响应值之间的关系,得到标准曲线方程分别为:y=30.941x-16.477,R2=0.999 9;y=28.704x+2.589 7,R2=0.999 9;y=31.122x-24.159,R2=0.999 7;y=43.035x-42.977,R2=0.999 7;y=46.317x-20.774,R2=0.999 7。这5种核苷类物质在测定的浓度范围内峰面积响应值与浓度线性关系良好。
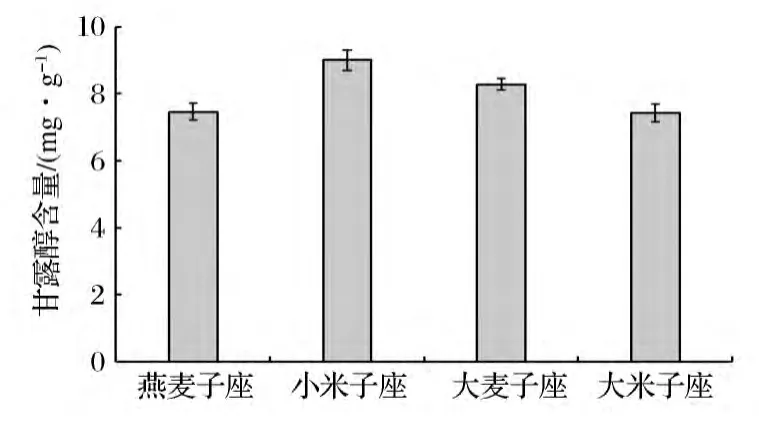
图1 蛹虫草子座中甘露醇含量Fig.1 Content of mannitol in stromata of Cordyceps militaris
2.3 核苷类物质混合标样图谱
将100 μg/mL的虫草素、腺苷、尿苷、鸟苷及胸苷5种标准液等体积混合,得到终浓度为20 μg/mL的混合标样标准溶液,HPLC测定得到混合标样的色谱峰及保留时间图谱,5个色谱峰所代表的化合物依次为:尿苷、鸟苷、胸苷、腺苷、虫草素,保留时间分别为,3.315、4.402、6.199、8.622、11.232 min,在此条件下5种核苷类化合物分离效果好,能够准确测定含量,如图2所示。
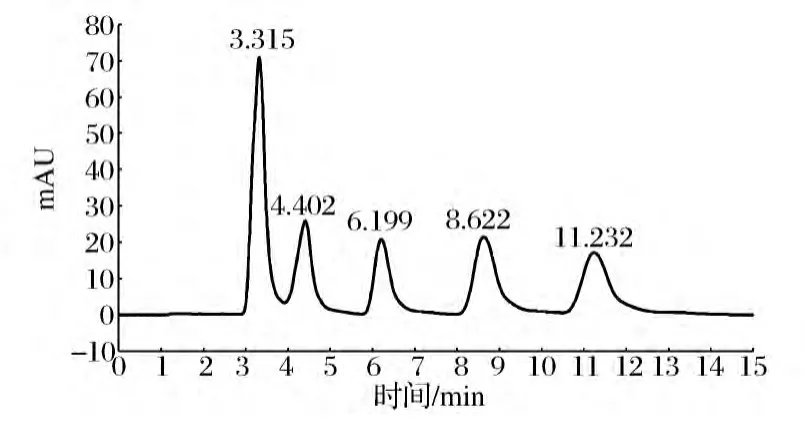
图2 核苷标样图谱Fig.2 Chromatogram of standard nucleosides samples
2.4 样品中核苷类物质含量测定
蛹虫草子座甲醇回流提取液经HPLC测定,在260 nm波长下得到的各个化合物的色谱峰分离较好(如图3所示)。图3中横坐标为化合物保留时间,采用相同范围的纵坐标能够更清晰的判断同一位置的色谱峰的峰高及峰面积,也就是提取液中化合物含量的高低,与子座中化合物含量的高低一致。并且可以看出小米子座和大麦子座中虫草素含量远远高于另外两种子座。
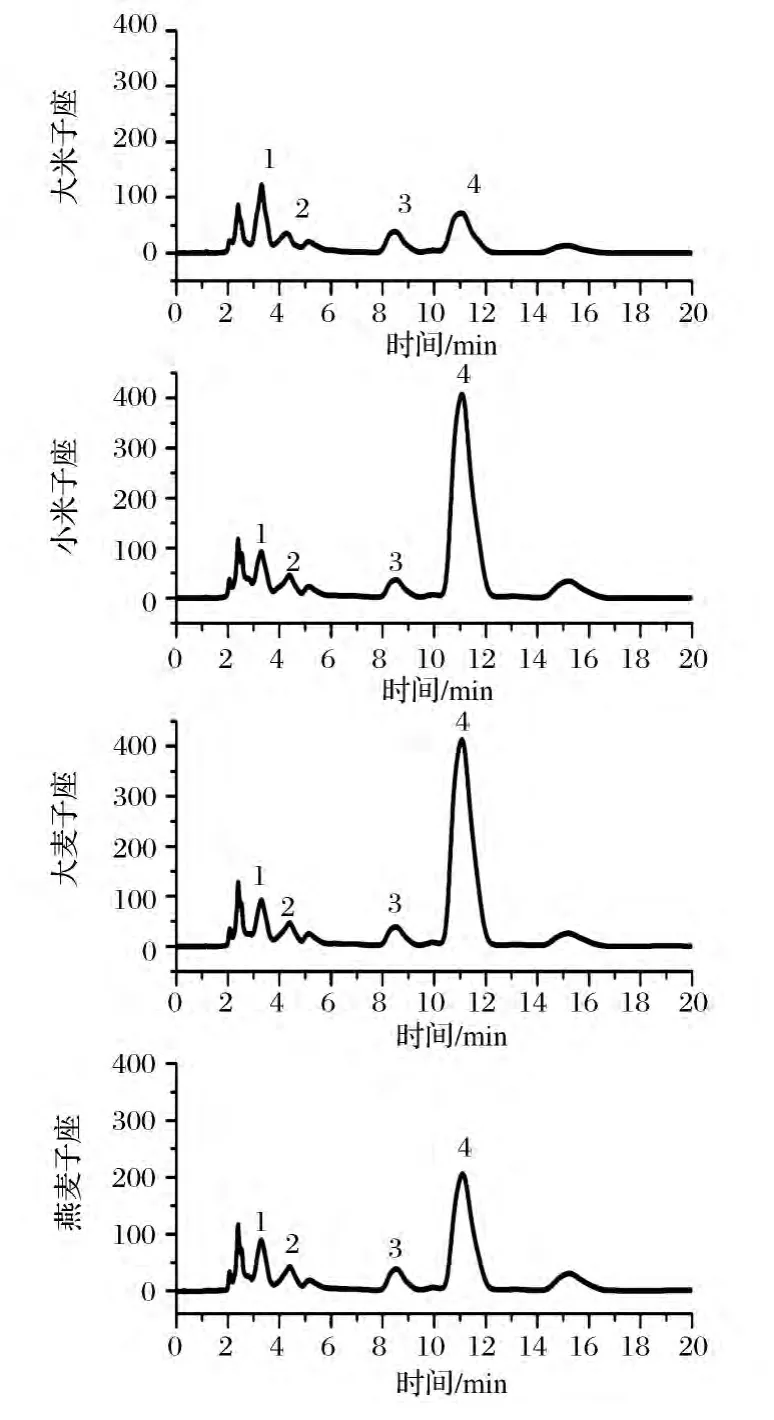
图3 不同子座中核苷图谱Fig.3 Chromatogram of nucleosides in different stromata
2.5 不同培养基质获得的子座中成分含量测定结果
将4种子座提取液样品测定的虫草酸、虫草素、腺苷、尿苷、鸟苷及胸苷的数据分别代入标准曲线方程,计算提取液中虫草酸及核苷类物质含量,折算后得到每克子座粉末中成分含量,结果如表1所示,数据统计分析采用DPS7.05版软件,采用Duncar新复极差法比较。
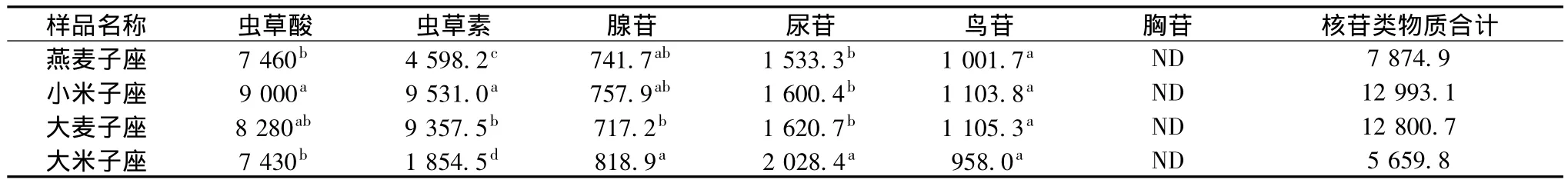
表1 不同培养基质培养蛹虫草子座中虫草酸及核苷类物质的含量μg/gTable 1 Content of cordycepic acid and nucleosides in stromata of Cordyceps militaris cultured by different solid culture medium μg/g
表1中数据说明,不同培养基质的子座中核苷类物质含量差别较大,尤其是虫草素含量差别最大,虫草素含量最高的为小米子座,最低的为大米子座,两者相差7 676.5 μg/g,表明培养基质的种类对虫草素含量的影响很大。小米培养基最利于虫草素合成,其次为大麦培养基,然后是燕麦培养基和大米培养基。文献[15]报道高粱米作为培养基虫草素含量最高,虫草素含量为2 482 μg/g,小米作为培养基虫草素含量最低为1 163 μg/g,本研究结果与报道不同,反而得到小米作为培养基虫草素含量最高为9 531.0 μg/g,远远高出文献[15]报道结果,而腺苷含量大米子座最高为818.9 μg/g,比含量最低的大麦子座高101.7 μg/g,但低于文献[15]中 1 861 μg/g。分析可能是由于菌株、培养基配方及培养条件的不同引起的。小米子座和大麦子座中尿苷、鸟苷的含量比较接近,差异不显著,大米子座中尿苷含量最高,鸟苷含量最低。4种子座经甲醇回流所得的提取物中均未检测到胸苷,可能是由于其含量低于本方法的检测限值。
3 结论
不同培养基质(燕麦、小米、大麦、大米)对蛹虫草子座中虫草酸、虫草素及其他核苷类物质含量影响各不相同,子座中虫草酸与虫草素含量高低顺序相同,依次为:小米子座>大麦子座>燕麦子座>大米子座;5种核苷类物质合计与虫草素含量高低顺序一致,依次为:小米子座>大麦子座>燕麦子座>大米子座。核苷物质合计与虫草素含量高低顺序之所以一致主要是由于虫草素是核苷类物质中主要成分,故其含量决定核苷类物质含量的总和。
小米子座和大麦子座中虫草酸和虫草素等核苷类物质含量最高,因此,小米和大麦适合于人工培养高产虫草素、虫草酸的蛹虫草子座,采集子座后的培养基质还可以作为食品或保健食品的原料开发利用,不足之处是与大米相比价格高导致培养成本较高,生产中可以根据需求选择适合的培养基质。
[1] 戴玉成,李玉.中国六种重要药用真菌名称的说明[J].菌物学报,2011,30(4):515-518.
[2] 梁宗琦.中国真菌志第32卷-虫草属[M].北京:科学出版社,2007:10-47.
[3] 蔡仲军,尹定华,秦松云.水提取法测定冬虫夏草甘露醇含量[J].重庆教育学院学报,2002,15(6):42-44.
[4] 张晓卿,李媚,蓝丽红,等.比色法测定发酵液中甘露醇的含量[J].化工技术与开发,2004,33(2):33-35.
[5] Cunningham K G,Manson W,Spring F S,et al.Cordycepin,a metabolic product isolated from cultures of Cordyceps militaris(Linn.)Link[J].Nature,1950,166(4 231):949.
[6] Cunningham K G,Hutchinson S A,Manson W,et al.Cordycepin,a metabolic product from cultures of Cordyceps militaris Link.Part I.Isolation and characterization [J].Journal of Chemical Society,1951,2:2 299-3 000.
[7] 蔡友华,刘学铭.虫草素的研究与开发进展[J].中草药,2007,38(8):1 269-1 272.
[8] Fan B Y,Zhang H B.Cordycepin:pharmacological properties and their relevant mechanisms[J].TANG,2012,2(2):e14,1-7.
[9] 康冀川,康超,文庭池,等.虫草菌素药理学研究进展[J].菌物学报,2011,30(2):191-197.
[10] REN Z H,CUI J H,HUO Z R,et al.Cordycepin suppresses TNF-α-induced NF-κB activation by reducing p65 transcriptional activity,inhibiting IκBα phosphorylation,and blocking IKKγ ubiquitination[J].International Immunopharmacology,2012,14(4):698-703.
[11] 吴勇,陈卫东.蛹虫草药理作用研究概述[J].中国药师,2011,14(5):732-734.
[12] 顾冬艳,尹永祺,杨润强,等.北虫草固态发酵产虫草素培养基优化[J].食品科学,2013,34(21):254-258.
[13] 张红霞,黄开华,陈伟,等.蛹虫草不同栽培菌株产虫草素及腺苷差异性研究[J].食用菌,2011,(5):63-64.
[14] 李辰,闫爱国,蔡春燕,等.蛹虫草及其培养残基中腺苷和虫草素含量的快速测定[J].色谱,2012,30(7):711-715.
[15] 乐昕,袁蜜,支月娥,等.栽培基质及碳源对蛹虫草子实体中主要有效成分的影响[J].食品科技,2014,39(2):2-7.
[16] 郭涛,张龙,王兵,等.不同培养基培育蛹虫草中的虫草素和腺苷含量测定[J].蚕业科学,2011,37(6):1117-1122.
[17] 温鲁,夏敏,宋虎卫,等.固体培养蛹虫草核苷类次生代谢物的产率[J].食品科学,2005,26(11):65-68.
[18] 史敏,赵宇,温学森.人工培养北虫草子座和培养基中多糖和核苷类成分的含量分析[J].食品与药品,2009,11(1):45-47.
[19] 雷宁,杜树山,倪雪梅,等.RP-HPLC测定天然虫草与人工虫草中核苷类成分的含量[J].中国药学杂志,2006,41(12):948-951.
[20] 刘桂君,尚宏忠,李赛飞,等.细脚拟青霉甘露醇含量的测定[J].食品科学,2011,32(22):226-229.
