2型糖尿病患者尿液的代谢组学研究
2015-12-23苏君梅葛卫红许广艳张宇
苏君梅 葛卫红 许广艳 张宇
2型糖尿病患者尿液的代谢组学研究
苏君梅 葛卫红 许广艳 张宇
目的 从代谢组学角度分析并寻找2型糖尿病(T2DM)患者可能的代谢标记物。方法选取30例初诊、或有糖尿病史经药物治疗控制不理想且无并发症的T2DM患者,另选取30例性别、年龄匹配的健康者为正常对照。收集清晨空腹中段尿,以气相色谱-质谱联用(GC-MS)技术对尿液样本进行代谢图谱分析,正交偏最小二乘法判别研究尿液内源性化合物在两组间的差异。结果T2DM组和正常对照组尿液代谢谱明显分离。与正常对照组比较,T2DM组尿液2,3,4-三羟基丁酸、肌醇、D-葡萄糖、D-葡萄糖酸及尿素含量升高(P<0.05或0.01),马尿酸含量减少(P<0.01)。结论代谢组学检查提示T2DM患者尿液中代谢标志物为2,3,4-三羟基丁酸、肌醇、马尿酸、D-葡萄糖、D-葡萄糖酸及尿素,观察这些标志物含量的变化有助于T2DM的临床诊断及发病机制研究。
代谢组学 2型糖尿病 气相色谱-质谱联用 正交偏最小二乘法判别
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种以胰岛素抵抗伴胰岛素分泌缺陷或胰岛素敏感性降低而引起的、以糖代谢失常为主的内分泌代谢性疾病,表现为整体的代谢紊乱。作为一种代谢综合征,T2DM很难用单一的评价指标和发病机制来反映其发生及变化,而代谢组学作为一种全面研究生物机体或组织细胞动态代谢的技术手段,在疾病的诊断、标志物筛查、发病机制以及药物研发等方面的应用正成为研究的前沿领域[1-2]。近年研究报道,利用代谢组学技术对糖尿病患者组织或体液中代谢物种类及含量的变化进行分析,寻找主要的差异代谢物,对监测糖尿病的发生、发展和辅助其临床早期诊断、探索发病机制具有重要意义[3-4]。笔者采用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)代谢组学技术对T2DM患者尿液中内源性小分子代谢物进行分析,探索T2DM的代谢组学特征,寻找与其密切相关的潜在代谢标记物,通过分析相关代谢物信息,为T2DM临床检测和诊断提供新的思路,现将结果报道如下。
1 资料和方法
1.1 一般资料 选取2011年6月至2013年5月浙江省中医院内分泌科确诊的T2DM患者30例,均为初诊T2DM或有糖尿病史经药物治疗控制不理想者,均符合1999年世界卫生组织(WHO)糖尿病诊断标准[5],并排除应激及冠心病、溶血性疾病、肝肾功能异常及感染者。其中男15例,女15例,年龄36~73岁,平均(54.7±10.3)岁。另选取浙江省中医院与T2DM患者性别、年龄匹配的30例健康体检者作为正常对照组,均无肥胖、高血压、糖脂代谢紊乱等病史,男15例,女15例,年龄33~78岁,平均(52.1±14.1)岁。根据知情同意原则采集尿液,所有受试者禁食12h,留取清晨空腹中段尿,样品密封,储存于-80℃的超低温冰箱中,待测。
1.2 试剂和仪器 MSTFA含1%TMCS、盐酸甲氧胺、十七烷酸、脲酶购自美国Sigma公司;吡啶等试剂(分析纯)购自成都科龙化工试剂厂;正庚烷(色谱纯)购自美国Fluka公司;日本岛津GCMS-QP2010气相色谱-质谱联用仪、Agilent色谱工作站。色谱柱:Agilent ZB-5MS(0.25mm×30mm,0.25μm)。数据处理软件:美国国家标准技术研究院NISTl05标准物质质谱数据库,瑞典U-metrics公司Simca-P12.0软件。
1.3 方法
1.3.1 样本前处理 将冻存的尿样在室温下解冻。取200μl尿样置于离心管中,加入20μl脲酶混匀,于37℃水浴。再加入20μl十七烷酸及400μl丙酮,涡旋混匀冰浴,以10 000r/min、4℃低温高速离心。取上清液400μl于进样瓶中,氮气吹干,加入50μl甲氧胺吡啶溶液置于70℃烘箱中反应1h后加入75μl衍生化试剂 [V(MSTFA)∶V(TMCS)=100∶1],于室温下继续反应1h,加入150μl的正庚烷以终止衍生化反应,待进样。
1.3.2 GC-MS分析 色谱条件:色谱柱DB-5MS,毛细管柱(0.25mm×30mm,0.25μm),进样口温度270℃,离子源温度230℃。程序升温起始温度85℃,保持5min;以8℃/min升至125℃,保持7min;以10℃/min升至190℃,保持10min;再以10℃/min升至300℃,保持5min。氦气作为载气,流速设为1ml/min,不分流,进样量为1μl。质谱条件:电离方式EI,电子能量70eV,扫描范围60~600m/z,全扫描方式。
1.4 统计学处理 原始GC/MS数据文件通过运用本实验室自定义MATLAB(Matlab7.1,The MathWorks,Inc. Popularity)脚本进行基线矫正、峰判别和匹配、内标和系统杂峰的排除和峰的归一化等计算过程,最终得到由指定的峰序列号(保留时间/质荷比)、观测点(样品号)以及归一化后的峰面积组成的三维矩阵数据集,导入Simca-P12.0软件进行OPLS-DA分析,运用变量投影重要性分析(variable importance for the projection,VIP)方法区分两组间代谢轮廓贡献较大的代谢物。多维统计中找到的差异代谢物应用SPSS13.0统计软件进行Kruskal-Wallis检验和单因素ANOVA分析的验证,结合VIP值>1并差异有统计学意义(P<0.05)的代谢物确定为潜在标记物。
2 结果
2.1 样品总离子流图 使用GC-MS为基础的代谢指纹谱分析方法对T2DM组和正常对照组样本进行分析,得到各组代表性样本总离子流图(total ion chromatogram,TIC),见图1。从总离子流图可直观识别出两组之间在同一保留时间色谱峰大小、高低表达有差异。
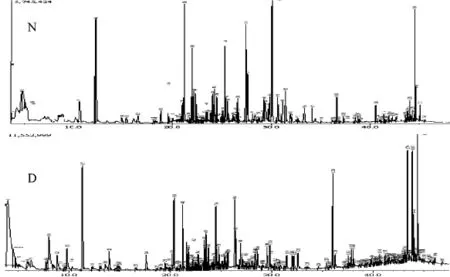
图1 总离子流图(N:正常对照组;D:T2MD组)
2.2 样本的OPLS-DA分析 OPLS-DA分析可以除去非实验因素对实验结果的干扰,提高判别的灵敏度,是在代谢组学研究中比较理想的数据分析手段。因此为深层次研究T2DM代谢轮廓的改变,寻找与T2DM相关的差异代谢产物,本实验建立OPLS-DA得分图,见图2。在建模之前,预先设定一个Y值,用来提取代谢物矩阵(X矩阵)中与Y值最相关的数据信息,将正常对照组样本的Y值设定为0,T2DM组样本的Y值设定为1。图中显示,两组的尿液代谢谱明显分离,表明该方法得到了很好的区分模型,且这种监督的方法建立的模型,可以找到对模型影响较大的代谢物变量。此外,利用OPLS-DA建模,得到R2X1与R2X2的累计量为0.638,而Q2Ycum达到了0.851,说明模型的区分程度和预测程度较好。为了进一步分析引起组间类别差异的特征峰,确定浓度在T2DM组和正常对照组样本中变化很大的潜在标志物,本研究给出T2DM组与正常对照组尿液的OPLS-DA载荷图,见图3。图中每一个点代表一个代谢物,若该点偏离中心越远表明该变量对模型的贡献越大。结合分析模型的VIP数据,共发现20种含量变化明显的内源性化合物。

图2 正常对照组与T2DM组尿液样本OPLS-DA得分图

图3 正常对照组与T2DM组尿液样本OPLS-DA载荷图
2.3 潜在标记物 为寻找与T2DM高度相关的代谢物,采用OPLS-DA法对正常对照组和T2DM组尿液样本共有的20种代谢物重新建模,寻找VIP>1的高度相关代谢物。将得到的VIP>1的代谢物通过NIST05标准质谱图库和标准品对照,进行质谱信息匹配,对可能的潜在标记物进行初步鉴定,共发现6种含量变化明显的内源性化合物,且6种物质两组间差异有统计学意义(P<0.05),确定为潜在的生物标记物,详见表1。
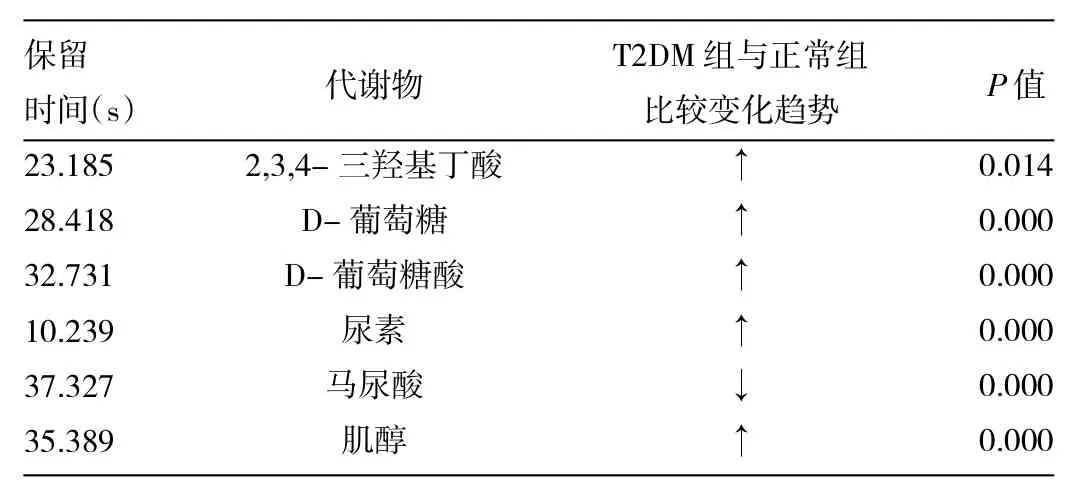
表1 尿液代谢谱中6种主要代谢物的变化
3 讨论
代谢组学通过分析生物体中内源性物质代谢的动态变化,描绘出生物体代谢轮廓,探索内源性物质代谢与疾病的关系。T2DM是整体代谢紊乱的内分泌代谢性疾病,因此,应用代谢组学技术从生物体液中代谢物的角度研究T2DM患者尿液中代谢物的变化,探寻与疾病相关的生物标记物,对于辅助临床早期诊断、疾病的治疗、监测等具有重要意义。
Zhao等[6]采用超高效液相色谱-四极杆-飞行时间质谱(UPLC-qTOF-MS)的非靶向代谢组学方法研究糖耐量降低者和正常者血样和尿样代谢指纹图谱,结果显示对照组和病理组能完全区分开,血浆脂肪酸、色氨酸及尿酸等代谢异常,尿液中与肠道菌群相关的代谢物变化明显,认为是T2DM的特征性变化,对糖尿病早期诊断和预防意义重大。Han等[7]应用GC-MS技术检测糖尿病患者血浆代谢物轮廓,发现血浆中脂肪酸水平的变化与糖尿病及糖尿病肾病的发生、发展有关,认为这些代谢物的变化可用于监测糖尿病及其并发症的发生、发展。因此,本研究利用GC/MS-OPLS-DA分析方法对T2DM组和正常对照组尿液代谢图谱进行数据预处理和建模,结果显示,T2DM组与正常对照组完全分离,表明两组间尿液代谢轮廓图谱存在着明显差异;采用NIST05标准质谱图库和标准品对比鉴定,尿液中6种内源性化合物含量变化两组间差异明显。由此认为,利用代谢组学技术可寻找、检测T2DM潜在代谢标志物;提示从代谢水平分析T2DM尿液代谢图谱、筛选疾病相关标志性代谢物将有助于T2DM的临床诊断和治疗,同时这些代谢物的变化与T2DM的发生、发展密切相关,利于从小分子代谢物角度对T2DM的发生机制进行深入理解。
本研究结果显示,T2DM患者尿液中多种代谢物含量发生了变化。从潜在生物标记物的鉴定结果来看,生物标记物的变化与糖、能量及氨基酸等代谢有关。本研究中,两组间2,3,4-三羟基丁酸、肌醇、马尿酸、D-葡萄糖、D-葡萄糖酸及尿素含量差异显著。在T2DM组,β-羟丁酸的前体2,3,4-三羟基丁酸含量明显高于正常对照组。而β-羟丁酸作为酮体的主要组分(78%),是临床诊断潜在致命性糖尿病酮症酸中毒的可靠指标。T2DM患者中酮症酸中毒较常见,提示2,3,4-三羟基丁酸是T2DM潜在代谢标记物之一,尤其对糖尿病酮症酸中毒的及时诊断、早期治疗具有重要意义[8]。
肌醇作为合成磷脂酰肌醇的底物,由葡萄糖合成,有类似维生素样物质的作用。糖尿病患者尿液中肌醇含量显著增加,认为糖尿病时代谢紊乱而致肌醇流失,最终造成胰岛素作用的信号转导受阻[9]。也有学者发现,糖尿病患者神经组织中肌醇缺乏,影响了神经能量代谢,致神经传导速度减慢,认为肌醇代谢障碍与糖尿病神经病变有关[10]。本研究结果显示,T2DM组尿液肌醇含量明显增高,这可能与糖尿病时多元醇通路受损以及细胞渗透压增高使肌醇的摄入量代偿性减少有关,提示肌醇可能为T2DM及其并发症的潜在代谢标记物[11]。
马尿酸是尿液中的一种正常成分,是肠道菌群代谢产生的含苯环的化合物,由苯甲酸与甘氨酸在肝药酶细胞色素p450催化合而产生,马尿酸的变化与肠道菌群的改变有关,也与肝功能变化相关联[6,12]。研究发现,肥胖大鼠尿液中马尿酸较正常大鼠的表达水平有显著差异;在糖尿病大鼠,尿液中马尿酸水平明显降低,认为糖尿病大鼠肠道内菌群代谢发生紊乱[13-14]。本研究中T2DM组尿液中马尿酸含量也明显减少,提示T2DM时肠道微生物环境可能遭到破坏,肝药酶细胞色素p450活性下降,影响了马尿酸的代谢[6]。也有学者认为,尿液中马尿酸的改变可作为肾脏毒性损伤的生物学标记[15]。新近研究发现,肠道菌群是控制体重与能量平衡的一个重要环境因素,肠道菌群可能与肥胖、T2DM等代谢性疾病的发生、发展有密切联系[16-18],这对糖尿病的病理生理机制提出了新的研究思路。
正常情况下,葡萄糖主要通过糖酵解和TCA循环分解供能,T2DM患者由于存在胰岛素抵抗,葡萄糖分解减少而糖原分解和糖异生增强。本研究中T2DM患者尿液中葡萄糖水平显著增加,表明T2DM患者存在糖代谢通路紊乱,而尿液中出现葡萄糖依然是糖尿病诊断的重要标志物。D-葡萄糖酸是葡萄糖氧化产物,与葡萄糖对应,可视为T2DM的潜在代谢标记物。尿素是在尿素循环中产生的蛋白质代谢的主要最终产物。本研究中T2DM患者尿液尿素水平的升高,提示患者体内蛋白质和氨基酸分解产生的含氮代谢物的代谢过程发生紊乱[8,19]。此外,T2DM患者尿液中D-葡萄糖酸、尿素浓度的升高,提示随病情进展肾功能有损伤[20],这也为深入研究糖尿病肾脏病变提供了代谢组学依据。
代谢组学技术能够更全面的反映生物体的代谢变化,帮助人们更好地了解生物体中各种复杂的代谢通路。本研究基于GC-MS的代谢组学技术分析T2DM患者尿液内源性小分子代谢产物的变化,显示T2DM发生、发展过程中的代谢特征,为T2DM临床检测和诊断提供了新的思路,同时在分子水平为T2DM及其并发症病理机制的探讨提供理论依据。
[1]Nicholson J K,Lindon J C.Systems Biology:Metabonomics[J].Nature,2008,455(7216):1054-1056.
[2]Ma Y,Zhang P,Yang Y,et al.Metabolomics in thefields of oncology:a review of recent research[J].Molecular Biology Reports,2012,99(7):7505-7511.
[3]Salek R M,Maguire M L,Bentley E,et al.A metabolomic comparison of urinary changes in type 2 diabetes in mouse,rat,and human[J].Physiol Genomics,2007,299(2):99-108.
[4]Zhang S,Nagana Gowda G A,Asiago V,et al.Correlative and quantitative1H NMR-based metabolomics reveals specific metabolic pathway disturbances in diabetic rats[J].Anal Biochem, 2008,383(1):76-84.
[5]Alberti K G,Zimmet P Z.Definition,diagnosis and classification of diabetes mellitus and its complications.Part 1:diagnosis and classification of diabetes mellitus provisional report of a WHO consultation[J].Diabet Med,1998,15:539-553.
[6]Zhao X,Fritsche J,Wang J,et al.Metabonomic fingerprints of fasting plasma and spoturine reveal human pre-diabetic metabolic traits[J].Metabolomics,2010,6(3):362-374.
[7]Han L D,Xia J F,Liang Q L,et al.Plasma esterified and non-esterified fatty acids metabolic profiling using gas chromatography-mass spectrometry and its application in the study of diabetic mellitus and diabetic nephropathy[J].Anal Chim Acta,2011, 689(1):85-91.
[8]袁凯龙,石先哲,路鑫,等.洛沙坦治疗糖尿病的气相色谱代谢组学[J].中国医学科学院学报,2007,29(6):719-724.
[9]Kennington A S,Hill C R,Craig J,et al.Low urinary chiroin ositol excretion in non insulin dependent diabetes mellitus[J].N Engl J Med,1990,323(6):373-378.
[10]Zychowska M,Rojewska E,Przewocka B,et al.Mechanisms and pharmacology of diabetic neuropathy-experimental and clinical studies[J].Pharmacol Rep,2013,65(6):1601-1610.
[11]Nissen P M,Nebel C,Oksbjerg N,et al.Metabolomics Reveals Relationship between Plasma Inositols and Birth Weight:Possible Markers for Fetal Programming of Type 2 Diabetes[J].J Biomed Biotechnol,2011,2011:378268.
[12]Psihogios N G,Gazi I F,Elisaf M S,et al.Gender-related and age-related urinalysis of healthy subjects by NMR-basedmetabonomics[J].NMR Biomed,2008,21(3):195-207.
[13]Wei L,Liao P,Wu H,et al.Toxicological effects of cinnabar in rats by NMR-based metabolic profiling of urine and serum[J].Toxico Appl Phamacol,2008,227(3):417-429.
[14]袁琳,白永生,周明眉,等.2型糖尿病大鼠的尿液代谢组学改变[J].中国实验动物学报,2011,19(2):112-114.
[15]Boudonck K J,Mitchell M W,Nemet L,et al.Discovery of metabolomics biomarkers for early detection of nephrotoxicity [J].Toxicol Pathol,2009,37(3):280,292.
[16]Rosa R D,Cret I R,Baldassarr I L,et al.Relationship between biofilm formation,the enterococcal surface protein(Esp)and gelatinase in clinical isolates of Enterococcus faecalis and Enterococcus faecium[J].Cur Pharma Design,2009,15(13):1546-1558.
[17]Backhed F,Manchester J K,Semenkovich C F,et al.Mechanism sunderlying the resistance to diet-induced obesity in germ-freemice[J].PNAS USA,2007,104(1):979-984.
[18]杨晓庆,李琳琳,王烨.小鼠肠道菌群代谢产物与糖尿病的相关性研究[J].中国微生态学杂志,2011,23(2):134-140.
[19]Soedamah-Muthu S S,Colhoun H M,Thomason M J,et al.The effect of atorvastatin on serum lipids,lipo-proteins and NMR spectroscopy defined lipoprotein subclasses in type 2 diabetic patients with ischemic heart disease[J].Atherosclerosis,2003, 167(2):243-255.
[20]Guan M,Xie L,Diao C,et al.Systemic Perturbations of Key Metabolites in Diabetic Rats During the Evolution of Diabetes Studied by Urine[J].Metabonomics,2013,8(4):60649.
ObjectiveTo investigate the urinary metabonomics in patients with type 2 diabetes mellitus.MethodsThirty patients with type 2 diabetes mellitus were enrolled as study group,and 30 health subjects served as controls.The morning midstream urine samples were collected.Gas chromatography-mass spectrometry(GC-MS)was used to analyze metabonomics of the urine samples.Orthogonal partial least-squares discriminant analysis(OPLS-DA)was applied to identify potential biomarkers.ResultsThe difference of metabonomics spectra was observed between diabetic patients and normal controls.Compared with the normal controls,the contents of 3-hydroxybutyrate,inositol,D-glucose,D-gluconic acid,urea were increased(P<0.05 or P<0.01)and hippuric acid decreased significantly(P<0.01)in type 2 diabetic patients.ConclusionThe 3-hydroxybutyrate,inositol,hippuric acid,D-glucose,D-gluconic acid and urea in the urine might be the candidate biomarkers for type 2 diabetes mellitus.
Metabonomics Type 2 diabetes mellitus Gas chromatography-mass spectrometry Orthogonal partial least-squares discriminant analysis

2014-04-18)
(本文编辑:严玮雯)
浙江省钱江人才计划(2010D003)
310053 杭州,浙江中医药大学药学院(苏君梅、葛卫红、许广艳);浙江省中医院内科(张宇)
葛卫红,E-maill:geweihong@hotmail.com
