转化生长因子-β1对大鼠腹膜间皮细胞炎症因子及细胞外基质表达的影响
2015-12-23刘小贤汪卫王圳郑红霞马纪林于健宁张雯
刘小贤 汪卫 王圳 郑红霞 马纪林 于健宁 张雯
●论 著
转化生长因子-β1对大鼠腹膜间皮细胞炎症因子及细胞外基质表达的影响
刘小贤 汪卫 王圳 郑红霞 马纪林 于健宁 张雯
目的 研究转化生长因子-β1(TGF-β1)对大鼠腹膜间皮细胞炎症因子表达和细胞外基质(ECM)积聚的影响。方法体外培养SD大鼠原代腹膜间皮细胞,静止24h后,采用RT-PCR检测TGF-β1(10ng/ml)刺激后0、3、6、12、24、48h单核细胞趋化蛋白-1(MCP-1)、白介素-6(IL-6)、Ⅰ型胶原(CollagenⅠ)、纤溶酶原激活物抑制物-1(PAI-1)mRNA的表达情况;Western blot检测TGF-β1(10ng/ml)刺激后0、4、12、24、48h CollagenⅠ和PAI-1表达情况;ELISA法检测MCP-1和IL-6表达情况。结果TGF-β1处理6h后MCP-1、IL-6和PAI-1mRNA即开始逐渐升高,与0h组的差异均有统计学意义(均P<0.05),24h后显著升高(均P<0.01);TGF-β1处理12h后CollagenⅠmRNA表达开始明显升高,与0h比较差异有统计学意义(P<0.05),24h后有显著升高(P<0.01);TGF-β1处理4h后IL-6表达水平升高(P<0.05),24h后显著升高(P<0.01);处理12h后MCP-1和PAI-1表达水平较0h明显升高(P<0.05),处理24h后CollagenⅠ表达水平显著升高(P<0.05);TGF-β1显著增加MCP-1、IL-6、CollagenⅠ、PAI-1及其mRNA的表达上调。结论TGF-β1可能通过诱导大鼠腹膜间皮细胞炎症因子上调表达和ECM积聚导致腹膜纤维化。
腹膜间皮细胞 炎症因子 细胞外基质 转化生长因子-β1
长期腹膜透析患者常由于腹膜纤维化导致超滤功能丧失而退出透析治疗。腹膜纤维化是一个复杂的过程,涉及炎性细胞的浸润、细胞外基质(ECM)的积聚及腹膜间皮细胞的转分化等。转化生长因子-β1(TGF-β1)是公认的促纤维化因子,但其具体机制目前并未完全清楚。笔者之前研究已经证实,TGF-β1可以诱导腹膜间皮细胞的转分化[1];因此,笔者进一步观察TGF-β1对大鼠腹膜间皮细胞炎性因子、ECM积聚的影响,现报道如下。
1 材料和方法
1.1 材料 清洁级雄性SD大鼠(体重150~180g,由浙江中医药大学实验动物中心提供),TGF-β1(美国R&D Systems公司),羊抗Ⅰ型胶原(CollagenⅠ)抗体(美国CST公司),兔抗大鼠纤溶酶原激活物抑制物-1(PAI-1)抗体(美国Santa Cruz公司),小鼠抗β-actin抗体(美国CST公司),DPI(美国CST公司),胎牛血清、DMEM/F12(美国Gibco公司),羊抗兔IgG抗体(美国CST公司),RNA提纯试剂盒(美国Invitrogen公司),大鼠单核细胞趋化蛋白-1(MCP-1)、IL-6ELISA检测试剂盒(美国Biosource公司),其余试剂为国产分析纯。
1.2 原代大鼠腹膜间皮细胞的培养、分组及观察指标
1.2.1 分离与培养 取大鼠,予肌肉注射10%水合氯醛 0.5~0.8ml。麻醉后向大鼠腹腔内注射 20~30ml 0.25%胰蛋白酶和0.02%乙二胺四乙酸(EDTA)消化液。1h后断颈处死大鼠,75%乙醇全身浸泡消毒10min。将大鼠仰面放置于超净工作台上,沿腹白线依次剪开腹壁皮肤及肌肉,吸出腹腔内的消化液,移入15ml离心管中。1 500r/min离心15min,弃上清液,加入含10% FBS的DMEM/F12培养液,轻轻用吸管吹打使之成为细胞混悬液,分装于25cm2的细胞培养瓶中。再加入培养基使之总体积达到4~5ml,放入37℃5%CO2的培养箱中培养。每3d更换1次完全培养基。常规传代,取第2代细胞进行实验。
1.2.2 实验分组及观察指标 静止24h后,将细胞随机分成对照组(即0h组)和TGF-β1(10ng/ml)刺激组,采用半定量RT-PCR法观察记录TGF-β1处理0、3、6、12、24、48h后大鼠腹膜间皮细胞MCP-1、IL-6、PAI-1和CollagenⅠmRNA表达情况,分别采用ELISA和Western blot法观察记录TGF-β1处理0、4、12、24、48h后MCP-1、IL-6、CollagenⅠ和PAI-1表达情况。
1.3 半定量RT-PCR提取细胞总RNA 按照Trizol Reagent说明书进行操作。Biophotometry核酸测定仪(美国Eppenddorf公司)测定总RNA浓度,贮存于-80℃冰箱。按照RevertAidTM First Strand cDNA反转录试剂盒(美国MBI公司)说明书进行反转录。取约5μg的RNA样本,以多聚寡核苷酸[Oligo(dT)18]为引物,在RevertAidTM M-MuLV反转录酶作用下合成cDNA。条件为70℃变性5min,37℃退火5min,42℃延伸60min,70℃孵育10min。合成的cDNA保存于-20℃冰箱备用。采用MBI公司PCR反应试剂盒进行PCR扩增。反应条件为94℃预变性5min,94℃变性30s,53℃退火30s,72℃延伸45s,72℃孵育10min(退火温度及循环周期依据引物和PCR产物而定)。引物设计按文献[2]或自行设计,所有引物由上海生工合成,合成序列见表1。PCR产物经1.2%琼脂糖凝胶电泳,用Fluor ChemTM8900凝胶成像系统(美国Alpha Innotech公司)进行信号吸光度分析。结果由电泳图的灰度值与内参灰度值的比值表示。

表1 PCR引物序列
1.4 Western blot检测 参考文献[3],取各组细胞,弃上清液,PBS洗3遍,加入细胞裂解液,收取蛋白质,4℃12 000r/min离心15min,BCA法测定浓度。取30μg的蛋白标本,10%聚丙烯酰胺(SDS-PAGE)凝胶上电泳,电压90V 30min,140V 60min。室温100V转膜90min。5%脱脂奶粉封闭1h,TBST洗3次,加入一抗(羊抗大鼠CollagenⅠ抗体、兔抗大鼠PAI-1抗体),4℃过夜。TBST洗3次,10min/次,HRP标记的二抗(小鼠抗羊IgG抗体、羊抗兔IgG抗体)室温孵育1h,TBST洗3次,显色并曝光成像。扫描图像并用图像分析软件进行信号吸光度分析。
1.5 ELISA检测 将试剂盒室温下放置20min以上,按说明书方法对标准品进行倍比稀释。取出相应标本的上清液,离心,15min内加完全部的样品。配制不同浓度的标准品,10倍稀释链酶抗生物素蛋白,5倍稀释洗板液,每孔加50μl孵育稀释液,留1个孔作为显色剂空白,将各浓度标准品依次加入相应各孔。另1个孔标准品稀释液100μl作为零对照孔,其他孔加标准品稀释液50μl继之加样品50μl(需复孔),轻轻敲打反应板边缘混匀,除显色剂空白,每孔加50μl生物素结合的MCP-1或IL-6抗体,轻轻敲打反应板边缘混匀,覆盖反应板膜,室温下孵育90min,甩去板内液体,除显色剂空白,每孔加链酶抗生物素蛋白100μl,室温下孵育30min,甩去板内液体,,每孔加显色剂100μl,室温下孵育30min,每孔加100μl终止液,用酶标仪在450nm测定OD值,做标准曲线,计算MCP-1、IL-6水平。
1.6 统计学处理 应用SPSS11.0统计软件,计量资料以表示,组间比较采用方差分析。
2 结果
2.1 TGF-β1处理后各时点大鼠腹膜间皮细胞MCP-1、IL-6、PAI-1和CollagenⅠmRNA表达情况的比较见图1。
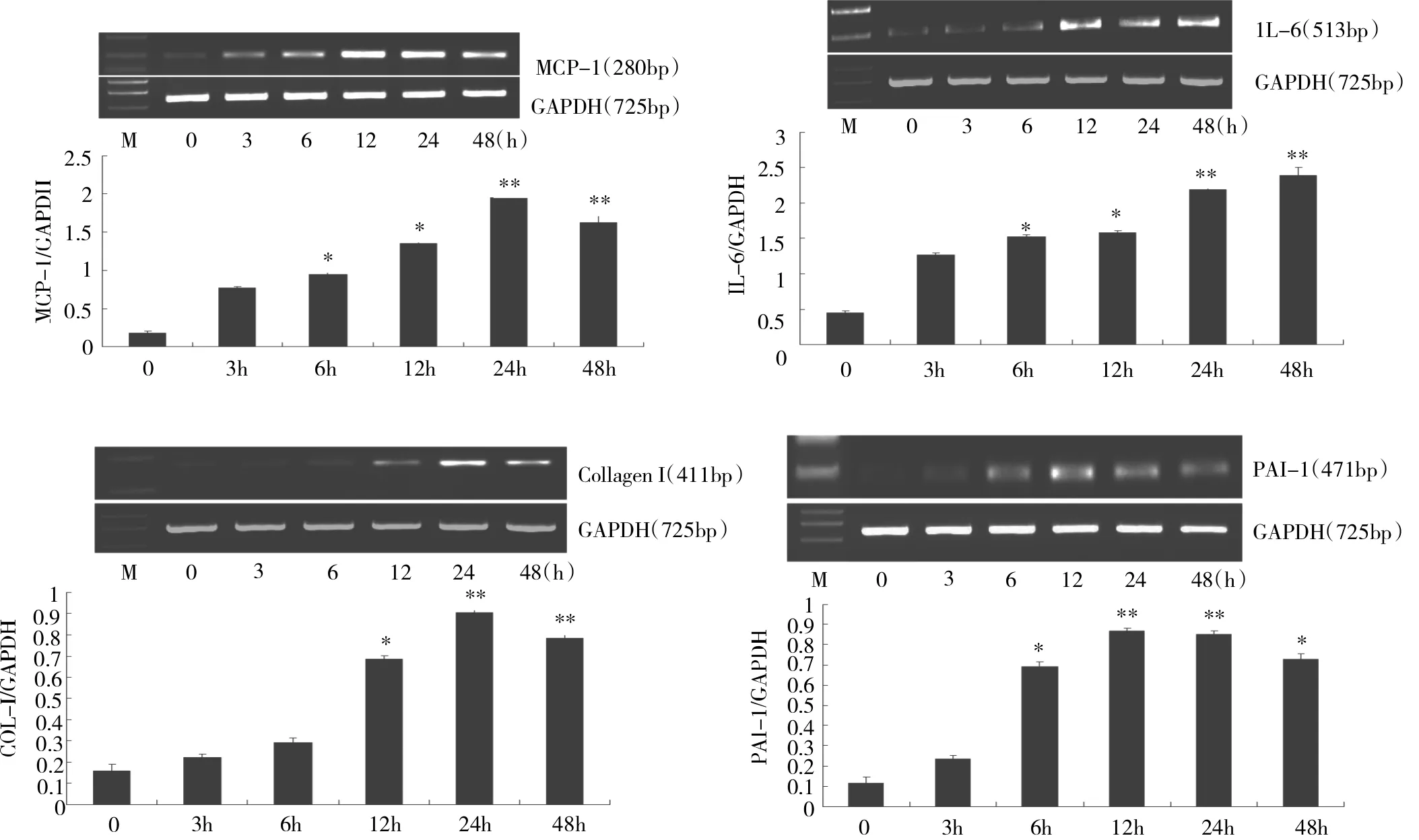
图1 TGF-β1诱导腹膜间皮细胞MCP-1、IL-6、Collagen I及PAI-1mRNA表达的情况(M:Marker;与0h比较,*P<0.05,**P<0.01)
由图1可见,TGF-β1处理6、12、24、48h后MCP-1、IL-6和PAI-1mRNA均较0h明显升高(P<0.05或0.01),处理12、24、48h后CollagenⅠmRNA表达也较0h明显升高(P<0.05或0.01)。
2.2 TGF-β1处理后各时点MCP-1、IL-6、CollagenⅠ和PAI-1表达情况的比较 见图2、表3。

表3 TGF-β1处理后各时点MCP-1、IL-6水平的比较(pg/ml)
由图2、表3可见,TGF-β1处理4、12h后IL-6水平较0h升高(P<0.05),24、48h后显著升高(P<0.01);处理12、24、48h后MCP-1和PAI-1水平较0h明显升高(P<0.05或0.01),处理24、48h后CollagenⅠ表达水平较0h明显升高(P<0.05或0.01)。
3 讨论
TGF-β1是目前公认的最强致纤维化因子,可以导致肝、肺、心脏及肾脏等诸多器官发生纤维化[4-7],主要通过下列几方面参与纤维化的病理过程:(1)促进上皮、间皮细胞向肌成纤维母细胞转分化(EMT),TGF-β1可诱导腹膜间皮细胞表型改变,向肌成纤维细胞转化,肌成纤维细胞绝对数量的增加是细胞外基质过度积聚的重要原因;(2)上调细胞外基质的合成,TGF-β1可上调CollagenⅠ、CollagenⅣ型胶原、纤连蛋白和层连蛋白的表达[8];(3)抑制降解基质蛋白酶的活性,TGF-β1能抑制基质金属蛋白酶、凝血酶原激活物和胶原酶等的活性[9];(4)活化上述蛋白酶的抑制剂,如基质蛋白酶抑制剂(TIMPs)和PAI-1[9];(5)作用于脏器固有细胞和浸润细胞,产生多种活性细胞因子包括MCP-1、IL-6、IGF、PDGF等。TGF-β1还是重要的免疫调节因子,在T细胞和其他非淋巴细胞中起抗炎因子的作用。
细胞浸润在腹膜纤维化的发生、发展中起了重要作用。MCP-1是一种对单核/巨噬细胞有强烈趋化作用的细胞因子,可在多种细胞中产生,其中包括单核细胞、内皮细胞、平滑肌细胞、上皮细胞、纤维母细胞、星形胶质细胞、肾组织细胞和某些肿瘤细胞,参与炎症和组织纤维化的形成[2,10]。IL-6是一种可由多种细胞包括单核-巨噬细胞、T细胞、系膜细胞、内皮细胞、上皮细胞分泌的具有多种功能的细胞因子,其功能包括调节免疫及炎症反应、调节急性期蛋白的产生、参与骨代谢及造血。IL-6在炎症的发生、发展中也起着重要作用。研究显示TGF-β1在多种细胞包括肾小管上皮细胞、人单核细胞、角质形成细胞、人肺成纤维细胞等细胞中均可上调IL-6的表达[11-14]。
本研究结果显示,TGF-β1可上调大鼠腹膜间皮细胞MCP-1、IL-6及其mRNA的表达,提示TGF-β1是重要的促炎症细胞因子,但TGF-β1促进MCP-1及IL-6表达的信号通路并不十分明确。Cheng等[14]报道TGF-β1通过激活ERK、p38和ROS,刺激系膜细胞表达MCP-1,但没发现NF-κB的激活。还有研究认为TGF-β1可能通过MAPK通路,激动蛋白-1(AP-1)和JunD同源二聚体使人的肺成纤维细胞生成IL-6增多[15]。纤维化除了炎症细胞和因子的参与,另外一个特点即是过量的ECM如胶原Ⅰ、Ⅱ、Ⅲ、Ⅳ型、纤维连接蛋白和层连蛋白,在腹膜间皮细胞积聚及成纤维细胞增生。细胞外基质蛋白的沉积依赖于ECM合成与分解代谢的平衡。
TGF-β1促进ECM合成的作用体现于多个环节,一方面上调基质成分基因的转录、翻译等步骤,如上调胶原和纤维粘连蛋白的基因表达,加强胶原和纤维粘连蛋白的合成,促进胞外基质受体的转录、翻译和蛋白形成等,促进ECM的沉积;另一方面通过减少基质降解蛋白酶的合成和分泌,增加降解酶阻制剂的合成和分泌抑制基质的降解。调节ECM代谢的ECM降解酶类纤溶酶原激活物/纤溶酶原激活物抑制物(PAs/PAIs)的表达与活性异常在ECM积聚中发挥重要的作用。PAs/PAIs是调节纤溶系统活性的重要物质,不仅起着维持血液中凝血与纤溶平衡的作用,而且参与维持ECM降解的动态平衡。PAs可由多种细胞生成和分泌,如T淋巴细胞、内皮细胞、肾小管上皮细胞等都可生成和分泌PAs。PAs分为组织型(tPA)和尿激酶型(uPA)两种。目前认为tPA的生理功能主要是作为纤溶的生理性激活剂,维持纤溶内环境的稳定,其在ECM降解和重塑过程中所起的作用还需进行探讨。uPA主要参与ECM降解和重塑,能够降解层粘连蛋白、纤维连接蛋白、IV胶原等多种糖蛋白。PAIs是PAs的生理性特异抑制物,现已发现4种不同类型的PAIs(PAI-1、PAI-2、PAI-3、PAI-4),均有抑制PAs的作用,其中PAI-1既是PAI的主要形式,也是PAs最重要的抑制剂,所以目前对PAIs的表达调控的研究也主要集中在PAI-1。近年来研究表明,地塞米松、LPS、IL-1、IL-6、AngⅡ、TNF-α、EGF等对PAI-1均具有上调作用,而多肽类激素如促卵细胞激素(FSH)和黄体生长素(LH)对PAI-1表达则有下调作用[16-20]。许多肾脏疾病(如肾小球肾炎、IgA肾病、狼疮性肾炎等),肾组织局部PAI-1的变化失调,表现为uPA或tPA表达下调,而PAI-1表达上调。本研究显示,TGF-β1可上调大鼠腹膜间皮细胞CollagenⅠ和PAI-1及其mRNA的表达,从而使ECM沉积增加和降解减少,证实PAs/PAI-1在腹膜纤维化的发生中也起着重要的作用。
目前已知TGF-β1可上调多种细胞PAI-1的表达,但尚不清楚TGF-β1通过怎样的信号传递途径调节PAI-1的表达。有研究显示,TGF-β1可诱导上皮细胞产生ROS,生成的ROS介导了由TGF-β1诱导的细胞PAI-1及其mRNA表达上调和活性的增强,长期给予抗氧化剂牛磺酸可有效抑制肾小球PAI-1及其mRNA表达的上升[21]。
综上所述,TGF-β1促进组织和器官纤维化的作用是多方面的,除诱导细胞转分化外,上调炎症因子表达,以及促进ECM蛋白的合成和减少ECM的降解,使ECM增多和异常沉积也发挥了作用,其具体机制尚待进一步深入研究。
[1]刘小贤,周红娟,汪卫,等.转化生长因子-β1在大鼠腹膜间皮细胞转分化中的作用及机制[J].浙江医学,2012,34(6):408-411.
[2]Wada T,Furuichi K,Sakai N,et al.Up-regulation of monocyte chemoattractant protein-1 in tubulointerstitial lesions of human diabetic nephropathy[J].Kidney Int,2000,58(4):1492-1499.
[3]Zhang H,Liu Y,Liu X X,et al.Epithelial-mesenchymal transition of rat peritoneal mesothelial cells via Rhoa/Rock pathway[J].In Vitro Cellular&Developmental Biology-Animal,2011,47(2):165-172.
[4]Sakai K,Jawaid S,Sasaki T,et al.Transforming Growth Factor-β-Independent Role of Connective Tissue Growth Factor in the Development of Liver Fibrosis[J].Am J Pathol,2014,184(10): 2611-2617.
[5]Kang H R,Cho S J,Lee C G,et al.Transforming growth factor (TGF)-beta1 stimulates pulmonary fibrosis and inflammation via a Bax-dependent,bid-activated pathway that involves matrix metalloproteinase-12[J].J Biol Chem,2007,282(10):7723-7732.
[6]Chung C C,Hsu R C,Kao Y H,et al.Androgen attenuates cardiac fibroblasts activations through modulations of transforming growth factor-β and angiotensin II signaling[J].Int J Cardiol, 2014,176(2):386-393.
[7]Nolan K A,Brennan E P,Scholz C C,et al.Paricalcitol protects against TGF-β1 induced fibrotic responses in hypoxia and stabilisesHIF-αinrenalepithelia[J].Exp CellRes,2014,7(34):27-48.
[8]Sharma K,Ziyadeh F N.Biochemical events and cytokine interactions linking glucose metabolism to the development od diabetic nephropathy[J].Semin Nephrol,1997,17(2):80-92.
[9]Ziyadeh R N,Sharma K.Role of transforming growth factor-beta in diabetic glomerulosclerosis and renal hypertrophy[J].Kidney Int,1995,51(Suppl):S34-S36.
[10]Okada H,Moriwaki K,Kalluri R,et al.Inhibition of monocyte chemoattractant protein-1 expression in tubular epithelium attenuates tubulointerstitial alteration in rat Goodpasture syndrome[J].Kidney Int,2000,57(3):927-936.
[11]Wang S N,LaPage J,Hirschberg R.Role of glomerular ultrafiltration of growth factors in progressive interstitial fibrosis in diabetic nephropathy[J].Kidney Int,2000,57(3):1002-1014.
[12]Qi W,Chen X,Polhill T S,et al.TGF-β1 induces IL-8 and MCP-1 through a connective tissue growth factor-independent pathway[J].Am J Physiol Renal Physiol,2006,290(3):F703-F709.
[13]Junn E,Lee K N,Ju H R,et al.Requirement of Hydrogen Peroxide Generation in TGF-β1 Signal Transduction in Human Lung Fibroblast Cells:Involvement of Hydrogen Peroxide and Ca2+in TGF-β1-Induced IL-6 Expression[J].The Journal of Immunology,2000,165(4):2190-2197.
[14]Cheng J,Diaz Encarnacion M M,Warner G M,et al.TGF-beta1 stimulates monocyte chemoattractant protein-1 expression in mesangialcells through a phosphodiesterase isoenzyme 4-dependent process[J].Am J Physiol Cell Physiol,2005,289 (4):C959-C970.
[15]Voloshenyuk T G,Landesman E S,Khoutorova E,et al.Induction of cardiac fibroblast lysyl oxidase by TGF-β1 requires PI3K/Akt,Smad3,and MAPK signaling[J].Cytokine,2011,55 (1):90-97.
[16]Dong J,Fujii S,Imagawa S,et al.IL-1 and IL-6 induce hepatocyte plasminogen activator inhibitor-1 expression through independent signaling pathways converging on C/EBP delta[J].Am J Physiol Cell Physiol,2007,292(1):C209-C215.
[17]Nakamura S,Nakamura I,Ma L,et al.Plasminogen activator inhibitor-1 expression is regulated by the angiotensin type 1 receptor in vivo[J].Kidney Int,2000,58(1):251-259.
[18]Gerritsma J S,van Kooten C,Gerritsen A F,et al.Transforming growth factor-β1 regulates chemokine and complement production by human proximal tubular epithelial cells[J].Kidney Int,1998,53(3):609-616.
[19]Anteby E Y,Greenfield C,Natanson-Yaron S,et al.Vascular endothelial growth factor,epidermal growth factor and fibroblast growth factor-4 and-10 stimulate trophoblast plasminogen activator system and metalloproteinase-9[J].Mol Hum Reprod,2004,10(4):229-235.
[20]Liu Y X,Peng X R,Liu K,et al.Hormonal regulation of expression of tissue type plasminogen activator and plasminogen activator inhibitor type 1 in cultured rat granulosa cells[J].Sci China B,1994,37(3):271-279.
[21]Zhang G Y,Wu L C,Dai T,et al.NADPH oxidase-2 is a key regulator of human dermal fibroblasts:a potential therapeutic strategy for the treatment of skin fibrosis[J].Exp Dermatol,2014, 23(9):639-644.
ObjectiveTo investigate the effect of TGF-β1 on expression of inflammatory factors and accumulation of extracellular matrix in rat peritoneal mesothelial cells(RPMCs).MethodsAfter growth arrest and synchronization for 24 h,primarily cultured RPMCs were treated with TGF-β1(10ng/ml)for 0,4,12,24 and 48h.The mRNA and protein expression levels of MCP-1, IL-6,CollagenⅠand PAI-1 were measured by RT-PCR and ELISA/Western blotting,respectively.ResultsCompared to 0h group, the expression of MCP-1,IL-6 and PAI-1 mRNA after 6h stimulation and the expression of CollagenⅠmRNA after 12h stimulation was up-regulated (P<0.05).TGF-β1 also significantly up-regulated the expression of MCP-1,IL-6 and PAI-1 proteins after 4h and 12h stimulation,and up-regulated expression of CollagenⅠprotein after 24h stimulation(P<0.05).TGF-β1 up-regulated mRNA and protein expression levels of MCP-1,IL-6,CollagenⅠand PAI-1 in a time-dependent manner in RPMCs.ConclusionTGF-β1 induced inflammatory factors upregulation and accumulation of extracellular matrix in RPMCs,which may be associated with peritoneal fibrosis.
Peritoneal mesothelial cells Inflammatory factors Extracellular matrix TGF-β1

2014-08-20)
(本文编辑:严玮雯)
浙江省自然科学基金项目(Y2101241)
310003 杭州,浙江省中西医结合医院肾内科
张雯,E-mail:zhangwenta@hotmail.com
