热疗通过上调基因PUMA 表达诱导胃癌MKN45凋亡
2015-12-19刘星肖凤刘彬
刘 星 肖 凤 刘 彬
(井冈山大学医学院重点实验室,江西,343009)
胃癌是人类最常见的恶性肿瘤之一。胃癌的治疗,尤其是已失去手术机会的晚期胃癌的治疗一直是临床工作的难题。肿瘤热疗是一种以非电离辐射方式作用于肿瘤的物理治疗方法,其最大优势在于较少受限于其毒副作用,并能够多次重复使用,且可以增强放射治疗和化学药物治疗的效果,目前在肿瘤综合治疗中被受关注[1]。热疗作为一种新的肿瘤治疗方法[2],不用开刀,无副作用,被誉为治疗肿瘤的“绿色疗法”,其治疗胃癌浆膜浸润与腹膜转移有一定疗效,但关于其对不同分化程度胃癌细胞的作用机制,尤其是热疗如何诱导不同分化程度胃癌细胞凋亡以及凋亡调控基因在热疗过程中如何表达等方面仍知之甚少。组织和细胞发生癌变总是从构成它们的分子开始[3],但其发生机制目前仍未完全阐述清楚。为此,本研究通过热疗(43℃)处理胃癌MKN45细胞后,应用MMT检测MKN45细胞增殖情况,应用流式细胞仪和AO/EB荧光双染色观察胃癌细胞的凋亡情况,并采用免疫印迹方法评价了热疗对胃癌细胞促凋亡蛋白PUMA表达的影响。
材料和方法
1.材料
人胃癌细胞株MKN45细胞由江西省消化系疾病研究所馈赠。0.25%胰蛋白酶、高糖DMEM培养液 (美国GIBCO公司)。DMSO(美国Amresco公司)。胎牛血清(杭州四季青公司)。四甲基偶氮唑盐(MTT,美国Amresco公司)。BCA蛋白浓度测定试剂盒(北京普利莱基因技术有限公司)。HRP辣根酶标记山羊抗兔IgG(北京中杉金桥公司)。ECL发光试剂盒(美国Thermo公司)。抗荧光淬灭封片液(南京碧云天试剂公司)。细胞凋亡检测试剂盒 (Annexin V-FITC/PI)、细胞凋亡吖啶橙检测试剂盒(KGA213)及细胞凋亡EB检测试剂盒(KGA216)均购置南京凯基公司。鼠抗Actin单抗、Puma单抗、甲叉双丙烯胺、过硫酸胺(APS)及TEMED(四甲基乙二胺)均购置美国Sigma公司。
2.细胞培养
用含10%胎牛血清的DMEM培养液常规培养(37℃、5%CO2饱和湿度),取对数生长期的细胞进行加热处理。
3.加热实验
对照组37℃,常规培养,不给予加热处理。实验组加热温度设置43℃,加热时间分别为0.5h、1 h、2h及3h,根据加热时间不同分为43℃0.5h、1 h、2h及3h等亚组。将处于对数生长期内的SGC7901细胞常规消化、离心、重悬混匀,计数后,接种于35mm NEST培养皿,置37℃、5%CO2恒温孵育箱培养至贴壁。用封口膜封口后放入43℃的电热恒温水浴箱加热(温度波动<士0.1℃)。确保整瓶细胞平放淹没于水中,将热疗处理后的细胞换新鲜的10%FBS-高糖DMEM 培养液,并放置37℃、5%CO2恒温孵育箱培养24h。
4.MTT法
非热疗处理组作为常温对照,同时设不加细胞的背景对照。取热疗处理后培养24h的各组细胞于倒置显微镜下观察细胞生长情况和形态变化。然后用0.25%的胰蛋白酶消化离心,用培养液重悬细胞计数,稀释成1×104/ml,按每孔200μl接种到96孔培养板中,每组设6个复孔。再将每孔加入MTT溶液20μl,避光条件下继续培养4h,终止培养,小心吸弃孔内培养基上清液,每孔加入150μl DMSO,振荡10min,用酶联免疫检测仪测定每孔的光密度(OD)值,波长为570nm。细胞增殖抑制率=[1-实验组OD值/对照组OD值]×100%.
5.透射电镜
各组细胞热处理后于37℃、5%CO2恒温孵育箱继续培养24h后,用0.25%胰蛋白酶消化并收取细胞,1000r/min,离心3min,弃上清后,经3.5%戊二醛、1%锇酸双固定,丙酮逐级脱水,环氧树脂包埋,超薄切片后柠檬酸铅、醋酸铀双染色,透射电镜观察及拍照。
6.AO/EB荧光双染色
热疗处理后培养24h的各组细胞,用4%多聚甲醛室温固定10min,加入AO和EB混合溶液染色,避光风干,用抗荧光淬灭封片液封片。荧光显微镜观察细胞形态结构及胞核的变化并拍照。细胞凋亡率=凋亡细胞/细胞总数×%。细胞坏死率=坏死细胞/细胞总数×%。
7.Annexin-V和PI双染色法
收集前述热疗处理后继续培养24h的MKN45细胞置于10ml离心管中,各样本的细胞密度为5×105,1000r/min离心5min后弃去培养液,PBS洗涤细胞2次,加入500μl的Binding Buffer悬浮细胞,室温下避光孵育15min,1000r/min离心5 min沉淀细胞,PBS洗涤细胞2次,加入Annexin V-FITC/PI溶液5μL,4℃下孵育20min,染色后1 h内用流式细胞仪检测细胞凋亡情况。
8.Western blot
将热疗处理后的各组细胞用预冷的PBS液洗2次,吸弃PBS液,加入预冷的含抑制剂的蛋白质抽提试剂,轻轻摇动5min后,用一预冷的橡胶和塑料细胞刮刮下培养瓶壁上细胞,转移细胞悬液到离心管中,冰浴15min进行裂解。裂解液于预冷的离心机中14000r/min离心15min,吸弃上清液。BCA法测定蛋白质浓度。50μg总蛋白质在SDS聚丙烯酰胺凝胶电泳分离后,电转移至PVDF膜,膜在5%BSA溶液中室温培养1h,以封闭膜上的非特异结合。封闭过的膜加入一抗4℃过夜。TBST洗膜3次,每次5min。再加入HRP标记的二抗,室温孵育1h,TBST洗膜3次,每次5min。同样方法标记鼠单克隆抗β-actin作对照。洗膜稍干后,按1∶1加入AB显影液(与二抗HRP结合),在Bio-Rad的化学发光成像仪上显影,然后分析灰度值,再计算灰度系数比。
9.统计学方法
应用SPSS13.0统计软件行统计分析。数据均采用均数土标准差表示().以单因素方差分析(oneway ANOVE)计算多组间差异,两两比较采用t检验。P<0.05为差异有统计学意义。
结 果
1.热疗对胃癌细胞增殖的影响(图1)
MTT结果显示:热疗后,MKN45细胞增殖抑制率逐渐升高,至3h最高,热疗处理0.5h、1h、2h、3h后MKN45细胞增殖抑制率分别为(23.0±1.7)%、(18.7±1.8)%、(33.8±1.6)%、(39.9±2.1)%。提示热疗可有效杀伤胃癌细胞。但是,MKN45细胞热疗1h,其细胞增殖抑制率相对0.5h略有恢复,这提示MKN45细胞自身对热疗会产生一定的应激能力。
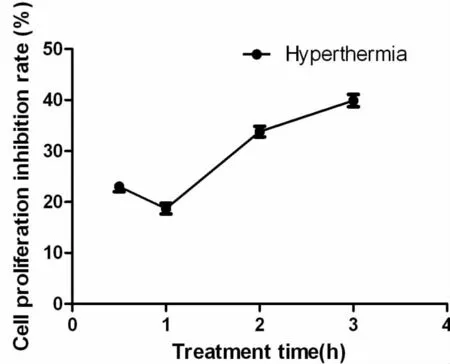
图1 热疗对MKN45细胞增殖的影响Fig.1Effects of hyperthermia on proliferation of MKN45cells
2.热疗后胃癌细胞的形态结构改变(图2)
倒置显微镜观察:与对照组相比,热疗0.5h部分贴壁MKN45细胞出现皱缩,细胞逐渐变圆,核膜皱缩,细胞内颗粒成分逐渐增多,1h相对较少,2h细胞皱缩、变圆、漂浮细胞明显增多,3h细胞数目减少,部分细胞出现漂浮现象。提示热疗0.5h、2h和3h可明显杀伤胃癌MKN45细胞。

图2 热疗不同时间后MKN45细胞形态的变化Fig.2Morphological change of MKN45cells in the various time hyperthermia group
3.AO/EB荧光双染色观察细胞凋亡情况(图3)
对照组(热疗0h)MKN45细胞绝大数呈均匀绿色荧光,个别细胞质淡黄色,而实验组(热疗0.5 h、1h、2h和3h)MKN45细胞出现块状荧光、桔黄色荧光或浓染的红色碎片。热疗0.5h,较多MKN45细胞质淡黄色、细胞核见橘红色凋亡小体。热疗2h,细胞膜不完整比率增加,细胞核呈现致密斑状现象,细胞核见橘红或红色 “逗点”状凋亡小体。热疗3h,较多MKN45细胞体积增大,呈不均匀的橙红色。热疗0.5h、1h、2h和3h后MKN45细胞凋亡率都高于对照组,差异均有统计学意义(P<0.05)。热疗1h后MKN45细胞凋亡率都低于热疗0.5h、2h、3h后 MKN45细胞凋亡率,差异均有统计学意义(P<0.05)。

图3 采用AO/EB双荧光标记的MKN45细胞凋亡Fig.3Apoptosis of MKN45cells by AO/EB double fluorescent labeling
4.Annexin-V和PI双染色法流式检测热疗对细胞凋亡率的影响(图4)
通过AO/EB荧光双染色结果,我们发现热疗可诱导胃癌细胞凋亡,且热疗1h杀伤胃癌细胞低于0.5h。为了进一步证实这一现象,我们通过Annexin-V和PI双染色法流式细胞仪观察细胞凋亡情况。热疗0.5h、1h、2h和3h后MKN45细胞凋亡率都高于对照组,差异均有统计学意义(P<0.05)。热疗1h后MKN45细胞凋亡率都低于热疗0.5h、2h、3h后MKN45细胞凋亡率,差异均有统计学意义(P<0.05)。两种凋亡实验结果基本吻合。
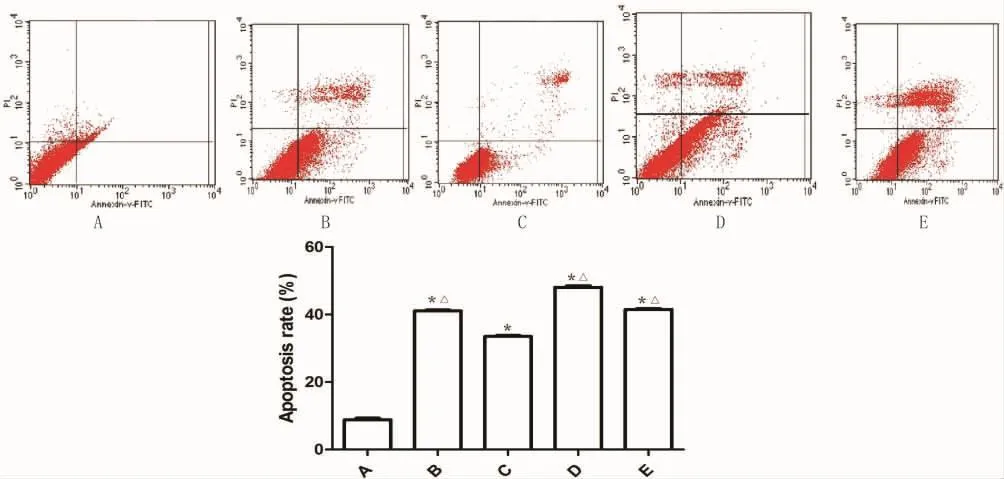
图4 在不同热疗时间的MKN45细胞凋亡Fig.4Apoptosis of MKN45cells in various time by hyperthermia
5.热疗后胃癌MKN45细胞PUMA蛋白表达变化(图5)
与对照组比较,MKN45细胞各热疗时间组PUMA蛋白表达明显升高,热疗0.5h组开始升高,热疗2h组达最高峰,1h组略低于0.5h组,3h组明显回落(P<0.05)。这与前面的凋亡实验结果相吻合。提示MKN45细胞很可能在1h进入一个适应期,此时细胞很可能积极调动自身能力抵抗热疗引起的细胞损伤。随着热疗时间的延长,热疗2h细胞凋亡达高峰热疗3h,细胞凋亡减少,而细胞死亡明显增多。

图5 不同热疗时间MKN45细胞中Puma蛋白的表达Fig.5Expression of Puma protein of MKN45cells in various time hyperthermia group
讨 论
肿瘤热疗主要分为:局部热疗、区域热疗和整体热疗[4],是一种利用物理能量使人体全身或局部加热,使肿瘤组织温度上升到有效治疗温度,并维持一定时间,利用正常组织和肿瘤组织对温度耐受力的差异,达到既能杀灭肿瘤组织,又不损伤正常组织的治疗方法[5]。目前,已经用于食管癌[6]、胃癌[7]、结直肠癌[8]等消化系统肿瘤的治疗。
文献还表明[9],43℃左右的热疗治疗胃癌这类空腔脏器肿瘤效果较为确切,但其机制要比高热直接杀伤肿瘤细胞复杂得多。目前认为热疗杀伤肿瘤细胞主要是通过诱导肿瘤细胞凋亡实现的[10]。本实验倒置显微镜观察到热疗后MKN45细胞体积变小变圆,核膜皱缩,核染色质均质化,细胞数目减少。透射电镜观察热疗后MKN45细胞核仁增多,胞核及胞浆出现大小不等的空泡,并可见凋亡小体。从形态学角度证实了热疗可诱导胃癌细胞凋亡。接着采用了AO/EB荧光染色法和Annexin-V和PI双染色流式法检测热疗诱导胃癌MKN45细胞凋亡情况。两种实验方法结果均证实热疗可以诱导细胞凋亡。
研究显示,细胞热疗0.5h出现一个凋亡小高峰,而热疗1h细胞损伤程度略有缓解,提示MKN45细胞很可能在1h进入一个适应期,此时细胞很可能积极调动自身能力抵抗热疗引起的细胞损伤。随着热疗时间的延长,热疗2h细胞凋亡明显增加,热疗3h,细胞凋亡减少,而细胞死亡明显增多。本研究AO/EB荧光双染色实验结果各热疗时间组细胞凋亡率略低于AnnexinⅤ/PI流式细胞分析法的细胞凋亡率。这可能是由于部分早期凋亡细胞虽已出现DNA断裂,但尚未出现明显的形态学改变,因此,AO/EB荧光双染色未能检测。MTT结果表明热疗可明显抑制胃癌MKN45细胞增殖,其抑制率随着热疗时间延长而升高。
胃癌是一种基因相关性疾病[11]。P53基因是胃癌重要的抑癌基因[7],该基因突变而导致其失去正常功能是肿瘤发生发展的重要因素[12-14]。PUMA是2001年由Nakano K和 Vousden KH等发现的新基因[15],其既可介导P53依赖性凋亡,又可介导P53非依赖性凋亡,具有较强的促凋亡活性。研究表明,PUMA在化疗药物、放射线等多种因素诱导肿瘤细胞发生凋亡的过程中起着重要作用,且在不同应激条件下具有不同的机制[16-19]。热疗也是一种应激。为此,我们推测PUMA参与热疗诱导胃癌细胞凋亡的过程。在本研究中,我们采用免疫印迹检测MKN45细胞43℃热疗0.5、1、2和3h后的PUMA蛋白表达情况。本实验结果显示,与对照组比较,MKN45细胞各热疗时间组PUMA蛋白表达明显升高,热疗2h组达最高峰,1h组略低于0.5h组,3h组明显回落。这与前面的凋亡实验及MMT结果相吻合。提示热疗可明显抑制胃癌细胞增殖,诱导细胞凋亡,并可能是通过上调PUMA蛋白表达而促进胃癌细胞凋亡。
[1]Lin TC,Lin FH,Lin JC.In vitro feasibility study of the use of a magnetic electrospun chitosan nanofiber composite for hyperthermia treatment of tumor cells.Acta Biomater,2012,8(7):2704-2711
[2]Zhao C,Dai C,Chen X.Whole-body hyperthermia combined with hyperthermic intraperitoneal chemotherapy for the treatment of stage IV advanced gastric cancer.Int J Hyperthermia,2012,28(8):735-741
[3]金少琴,毛华 .近红外线激光拉曼光谱具有在分子水平诊断胃癌的价值.南方医科大学学报,2014,34(03):391-395
[4]吕雅蕾,刘会芝,刘巍.热疗在消化系统肿瘤中的应用进展.肿瘤,2010,30(01):81-84
[5]刘文超.开展热疗,推动肿瘤治疗的进步.临床肿瘤学杂志,2011,16(06):481-486
[6]Liu JF.Non-steroidal anti-inflammatory drugs and cancer,with an especial focus on esophageal cancer.Asian Pac J Cancer Prev,2011,12(12):3159-68
[7]Yarema RR,Ohorchak MA,Zubarev GP,et al.Hyperthermic intraperitoneal chemoperfusion in combined treatment of locally advanced and disseminated gastric cancer:results of a single-centre retrospective study.Int J Hyperthermia,2014,30(3):159-165
[8]Devun F,Biau J,Huerre M,et al.Colorectal cancer metastasis:the DNA repair inhibitor Dbait increases sensitivity to hyperthermia and improves efficacy of radiofrequency ablation.Radiology,2014,270(3):736-746
[9]陈卫星,顾竹影,厉有名.加热诱导人胃癌细胞株MKN28凋亡的动力学研究.实用癌症杂志,2001,16(1):126-128
[10]FuseT,Yoon KW,Kato T,et al.Heat induced apoptosis in human glioblastoma cell line A172.Neurosurgery,1998,42(4):843-849
[11]Yasui W,Yokozaki H,Fujimoto J,et al.Genetic and epigenetic alterations in multistep carcinogenesis of the stomach.J Gastroenterol,2000,35Suppl 12:111-115
[12]Zhou Y,Li N,Zhuang W,et al.P53codon 72polymorphism and gastric cancer:a meta-analysis of the literature.Int J Cancer,2007,121(7):1481-1486
[13]Bellini MF,Cadamuro AC,Succi M,et al.Alterations of the TP53gene in gastric and esophageal carcinogenesis.J Biomed Biotechnol,2012,2012:891961
[14]Zhang YF,Zhang BC,Zhang AR,et al.Co-transduction of ribosomal protein L23enhances the therapeutic efficacy of adenoviral-mediated p53gene transfer in human gastric cancer.Oncol Rep,2013,30(4):1989-1995
[15]Nakano K,Vousden KH.PUMA,a novel proapoptotic gene,is induced by p53.Mol Cell,2001,7(3):683-694
[16]Wang X,Li M,Wang J,et al.The BH3-only protein PUMA,is involved in oxaliplatin-induced apoptosis in colon cells.Biochem Pharmacol,2006,71:1540-1550
[17]Lee DH,Rhee JG,Lee YJ.Reactive oxygen species upregulate p53and PUMA;apossible mechanism for apoptosis during combined treatment with TRAIL and wogonin.Br J Pharmacol,2009,157:1189-1202
[18]Shao L,Sun Y,Zhang Z,et al.Deletion of proapoptotic PUMA selectively protects hematopoietic stem and progenintor cells against high-dose radiation.Blood,2010,115:4707-4714
[19]Avila JL,Grundmann O,Burd R,et al.Radiation-induced salivary gland dysfunction results from p53-dependent apoptosis.Int J Radiat Oncol Biol Phys,2009,73:523-529
