胸腔镜解剖性肺段切除术治疗临床Ⅰ期肺癌
2015-12-16乔玉磊林宗武奚俊杰徐松涛
乔玉磊,林宗武,奚俊杰,徐松涛,蒋 伟,王 群
复旦大学附属中山医院胸外科,上海 200032
胸腔镜解剖性肺段切除术治疗临床Ⅰ期肺癌
乔玉磊,林宗武,奚俊杰,徐松涛,蒋 伟,王 群
复旦大学附属中山医院胸外科,上海 200032
背景与目的:随着胸腔镜手术技术的提高,胸腔镜下解剖性肺段切除术日渐成熟。本文旨在研究胸腔镜肺段切除术用于治疗Ⅰ期肺癌患者的安全性、可行性及临床特点。方法:回顾性分析2008年3月—2014年1月复旦大学附属中山医院胸外科收治的临床诊断为Ⅰ期原发性支气管肺癌后接受胸腔镜解剖性肺段切除术的64例患者的临床资料,其中男性28例,女性36例,中位年龄59岁(39~86岁)。分析围术期各项参数。结果:64例患者顺利接受了胸腔镜解剖性肺段切除术。中位手术时间为120 min(90~240 min),中位出血量为50 mL(10~200 mL)。术后中位胸管引流时间为3 d(2~7 d),术后中位住院时间为5 d(3~23 d)。无围术期手术死亡病例,术后无严重并发症发生,无1例中转开胸,1例转为肺叶切除。51例毛玻璃样(ground glass opacity,GGO)病变患者的术后病理显示,浸润性腺癌30例,原位腺癌10例,微浸润腺癌6例,良性病变5例。结论:胸腔镜解剖性肺段切除对有经验的医师而言,是安全可行的,对临床Ⅰ期肺癌患者同时兼具了诊断和治疗的价值,尤其适用于GGO病变的患者。
肺癌;胸腔镜;肺段切除术
近年来,随着胸部CT作为体检的普及,外周型小肺癌检出率越来越高。随着胸腔镜手术水平的提高,胸腔镜下解剖性肺段切除术日益成熟[1-3],机器人手术也开始出现[4]。使用胸腔镜肺段切除术来治疗临床诊断为Ⅰ期的非小细胞
肺癌患者,在做到切口美观微创的同时保留了患者更多的肺功能。本文主要总结胸腔镜肺段切除术治疗临床Ⅰ期肺癌患者的安全性、可行性及临床特点。
1 资料和方法
1.1 临床资料
回顾性分析2008年3月—2014年1月复旦大学附属中山医院胸外科收治的临床诊断为Ⅰ期原发性支气管肺癌后接受胸腔镜解剖性肺段切除术的64例患者的临床资料。其中男性28例,女性36例;中位年龄59岁(39~86岁)。病例选择详见表1。术前均经胸部CT检查、常规评估肺功能等,术前根据胸部CT病灶情况有选择地进行纤维支气管镜检查,全部患者行头颅MRI、骨扫描、腹部颈部彩超等全面检查排除远处转移可能(或行PET/CT检查),骨扫描在毛玻璃样(ground glass opacity,GGO)病变患者中为选择性检查。本组所有患者要求术前第一诊断考虑为肺癌,临床分期为T1-2aN0M0。GGO病变的患者在发现病灶后至少随访2周,直径≥8 mm且在抗感染治疗无效后方考虑手术。

表 1 胸腔镜解剖性肺段切除术的病例选择Tab. 1 Cases selected for video-assisted thoracic surgery anatomic segmentectomy
1.2 手术方法
患者取侧卧折刀位,全身麻醉,如无禁忌,则联合使用硬膜外麻醉。双腔气管插管,在困难气道或者特殊情况下,选择单腔气管插管辅予阻塞导管,单肺通气。胸腔镜手术,一般选择三孔法,术者站于患者背侧。观察孔选择于腋中线第8肋间,长约1.5 cm,放置鞘卡后置入30°胸腔镜。辅助操作孔选择于听诊三角,长约1.5 cm。主操作孔则根据患者胸腔深浅及肿块位置而适当调整位置,通常选择于腋前线偏前第4或者第5肋间,长3~4 cm。使用切口保护套或者缝线牵开主操作孔。
先检查肺部病变情况及肺裂发育情况。叶间裂发育良好的病例从叶间裂开始处理。从叶间裂找到肺动脉,打开其鞘膜,如果拟切除肺段与其他肺叶的叶间裂发育不全,则于叶间动脉干表面分离肺动脉作“隧道”分离叶间裂,使用直线切割缝合器切断叶间裂。随后根据不同的肺段切除,按不同顺序处理肺段的动脉、支气管、静脉。左上肺的固有段、尖后段、左下肺背段、右上肺后段及右上肺背段均可按此顺序操作。而对于右上肺前段则按静脉、动脉、支气管的顺序进行。右下肺基底段各段的静脉很难从肺门部解剖,一般处理好动脉、支气管后找到进入拟切除肺段的静脉予以切断,实在无法辨认则不单独处理肺段静脉。对叶间裂发育差的病例,则可按由表及里的顺序处理肺段静脉、动脉、支气管,这3个主要结构应尽量往远心端分离,在确定所属肺段后方可处理。处理静脉、动脉、支气管后,先处理发育不全的叶间裂,再处理段间裂。
对肺段的动脉、静脉,通常使用5 mm Hem-o-lok夹闭后使用超声刀离断,在血管直径较粗时,则使用直线型切割缝合器处理。对肺段支气管通常使用腔镜直线型切割缝合器处理,在血管直径较细时,也可使用丝线结扎联合5 mm Hem-o-lok处理。
肺段间水平的识别,在肺门部根据肺段间静脉来判断,在外周则通过低压力低潮气量膨肺后根据肺的充气与萎陷界限来判断(拟切除肺段萎陷),或者将肺完全膨起后再单肺通气根据肺的充气与萎陷界限来判断(拟切除肺段充气)。
肺段的水平面在肺门部使用电钩或者超声刀分离,在分离至没有明显解剖标志时,使用腔镜直线型切割缝合器处理。对于确认或者怀疑肺癌的患者,为保证切缘距离肿瘤足够的距离(≥2 cm),必要时切除部分邻近肺段的肺组织。
对于原发性支气管肺癌,为保证分期的准确性,行淋巴结清扫或者采样。段间、叶间淋巴结术中送检冰冻病理检查。
2 结 果
2.1 手术结果
64例患者顺利接受了胸腔镜解剖性肺段切除术。中位手术时间为120 min(90~240 min),中位出血量为50 mL(10~200 mL),术后中位胸管引流时间为3 d(2~7d),术后中位住院时间为5 d(3~23 d)。围手术期无手术死亡病例,术后无严重并发症发生,无一中转开胸,1例因术中无法找到病灶而转为肺叶切除。切除的肺段见表2。术后痰中带血2例,予注射用蛇毒血凝酶处理后均缓解,其中1例术后2个月因用力屏气后再发痰血而再次入院,经保守治疗后治愈。
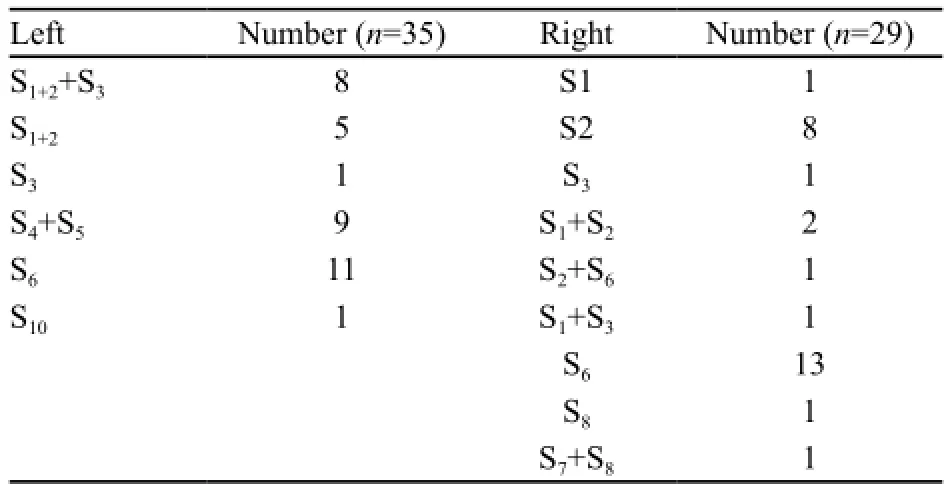
表 2 胸腔镜下所切除的肺段Tab. 2 Segments resected by video-assisted thoracic surgery
2.2 术后病理结果
术后病理详见表3。51例GGO病变患者的术后病理显示,浸润性腺癌30例,原位腺癌10例,微浸润腺癌6例,良性病变5例(包括3例不典型腺瘤样增生)。
在59例原发性支气管肺癌患者中,54例行纵隔淋巴结清扫或者系统性淋巴结采样,术后病理显示,52例N0,1例N1,1例N2。N1患者为间质纤维化,N2患者为右中肺癌术后,均为左上肺舌段切除,因肺功能差均未改行肺叶切除。5例未行纵隔淋巴结清扫或采样,其中2例因年龄较大(分别为78岁和84岁)且78岁患者胸腔黏连严重;2例为原位腺癌,直径<1 cm的GGO病变;1例术中快速冰冻病理检查结果为不典型腺瘤样增生。59例肺癌患者中位随访时间为15个月(4~75个月),尚未发现肿瘤复发、转移病例。

表 3 术后病理类型Tab. 3 Postoperative pathology
3 讨 论
Ginsberg等[5]在1995年报道的随机对照研究显示,肺癌亚肺叶切除组局部复发率明显高于肺叶切除组,因此,肺叶切除成为肺癌治疗的金标准,肺段切除仅用于肺功能无法耐受肺叶切除时的替代治疗,然而在该研究中,亚肺叶切除组里的楔形切除所占比例过高(32.8%),且未对肿瘤直径进行进一步的分层分析。伴随胸部CT作为体检的普及,越来越多的外周型小肺癌尤其是GGO病变被发现。近年来大量的回顾性研究发现,解剖性肺段切除用于治疗Ⅰ期肺癌,尤其当肿瘤直径≤2 cm时,具有与肺叶切除相似的远期疗效,5年生存率为83.0%~96.7%[6-10]。因此,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南提出了解剖性肺段切除术可以选择性用于治疗早期外周型肺癌,其指征包括下列两项。
⑴肺功能差或者伴有其他合并症而不适
合行肺叶切除者;⑵肿瘤直径≤2 cm,并且符合以下条件之一:①原位腺癌,②CT上所示GGO病变≥50%,③CT随访显示肿瘤倍增时间≥400 d。
对诊断为临床Ⅰ期的肺癌患者,我们选择行胸腔镜解剖性肺段切除的病例包括妥协性和预期性两种。妥协性主要指肺功能差或者伴有其他合并症而不适合行肺叶切除者,而预期性包括:①GGO病变患者,局部切除困难时;②GGO病变患者,可以行局部切除,但担心术中快速冰冻病理出错的;③恶性肿瘤术后,转移和原发难于鉴别时;④多发GGO病变,极有可能再次行肺切除术者。在我们早期的肺段切除中,妥协性肺段切除占了主要部分,而在近两年内,预期性肺段切除所占的比例越来越大。解剖性肺段切除对于GGO病变同时具有诊断和治疗的意义。对于术中无法扪及病灶的病例,直接行肺段切除有利于病灶的切除。
肺段切除术的一大难点在于段与段之间平面的确定。目前大多数学者主要根据段间静脉或者肺的充气与萎陷界限来判断段间水平[11-14]。对肺萎陷好的病例,我们在切断段支气管后将肺完全膨起,然后单肺通气萎陷术侧肺,非靶段萎陷,而靶段仍然充气,根据充气萎陷的界限来判断段间水平。对肺萎陷差的病例,经过较长时间的手术,术侧肺才有部分萎陷,则不能使用上述方法,而一般采用我们早期使用的低压力低潮气量膨肺来判断[1]。肿瘤切除要求肿瘤距切缘≥2 cm或者大于肿瘤直径[11-14],因此有时为保证肿瘤距切缘≥2 cm,需跨越段间水平切除部分邻近肺段。当病灶跨越肺段时,则考虑行联合肺段切除。
肿瘤直径<2 cm的小细胞肺癌仍有20%以上患者的肺门及纵隔淋巴结转移[15],因此,在接受解剖性肺段切除的早期肺癌患者中,为保证分期的准确性,我们推荐行段、叶间、肺门及纵隔淋巴结清扫或系统性纵隔淋巴结采样,术中快速冰冻病理检查段间及叶间淋巴结,如果段间或者叶间淋巴结证实有转移,身体条件允许的患者仍应行肺叶切除术[16-17]。本组数据中有1例N1和1例N2,因患者情况不允许未再进一步行肺叶切除。对于GGO病变的肺癌患者,我们的数据并未见有淋巴结转移者,因此,在纯GGO病变的患者中,是否需行淋巴结切除需要进一步数据支持。
本组中无1例中转开胸,与我们病例的选择及循序渐进的学习方式有关。初学者从下肺背段和左上肺舌段切除术做起,在有足够的经验后才考虑行复杂肺段切除。近两年来,单孔胸腔镜肺手术盛行,单孔胸腔镜肺段切除报道[18]也越来越多,当有足够单孔胸腔镜肺叶切除经验及胸腔镜肺段切除经验时,可以考虑行单孔胸腔镜肺段切除术,会使切口更加美观并且可能使疼痛更轻。对于病灶小的纯GGO病变,切除前先使用电凝于肺表面做好标记,以方便标本取出后迅速找到病灶。
术后痰中带血是肺段切除常见的并发症,通过保守处理往往可以治愈。本组2例发生了术后痰中带血,一开始并未给予重视而常规使用低分子肝素抗凝,后来不得不使用止血药。故肺段切除术后建议观察无明显出血症状后方考虑使用抗凝。
本组术后随访时间还比较短,对于远期效果尚无法说明问题。是否能够将肺段切除应用到更多的肺癌患者中,我们期待比较肺段切除与肺叶切除用于治疗直径≤2 cm外周型肺癌效果的前瞻性研究的结果[19]。
综上所述,胸腔镜解剖性肺段切除对有经验的医师而言,是安全可行的,对临床Ⅰ期肺癌患者同时兼具了诊断和治疗的价值,尤其适用于GGO病变的患者。
[1] 林宗武, 蒋 伟, 王 群, 等. 胸腔镜解剖性肺段切除术20例临床分析[J]. 中国胸心血管外科临床杂志, 2012, 19(3): 270-273.
[2] 蒲 强, 梅建东, 廖 虎, 等. 全胸腔镜解剖性肺段切除治疗肺部疾病的早期结果[J]. 2012, 50(9): 823-826.
[3] 吴卫兵, 陈 亮, 朱 全, 等. ⅠA期周围型非小细胞肺癌的全胸腔镜肺段切除术[J]. 2013, 29(7): 399-401.
[4] TOKER A, AYALP K, UYUMAZ E, et al. Robotic lung segmentectomy for malignant and benign lesions [J]. J
Thorac Dis, 2014, 6(7): 937-942.
[5] GINSBERG R J, RUBINSTEIN L V. Randomized trial of lobectomy versus limited resection for T1 N0 non-small cell lung cancer. Lung cancer study group [J]. Ann Thorac Surg, 1995, 60(3): 615-622.
[6] FERNANDO H C, SANTOS R S, BENFIELD J R, et al. Lobar and sublobar resection with and without brachytherapy for small stage IA non-small cell lung cancer [J]. J Thorac Cardiovasc Surg, 2005, 129(2): 261-267.
[7] OKUMURA M, GOTO M, IDEGUCHI K, et al. Factors associated with outcome of segmentectomy for non-small cell lung cancer: long-term follow-up study at a single institution in Japan [J]. Lung Cancer, 2007, 58(2): 231-237.
[8] SUGI K, KOBAYASHI S, SUDOU M, et al. Long-term prognosis of video-assisted limited surgery for early lung cancer [J]. Eur J Cardiothorac Surg, 2010, 37(2): 456-460.
[9] YAMASHITA S, CHUJO M, KAWANO Y, et al. Clinical impact of segmentectomy compared with lobectomy under complete video-assisted thoracic surgery in the treatment of stage I non-small cell lung cancer [J]. J Surg Res, 2011, 166(1): 46-51.
[10] OKADA M, NISHIO W, SAKAMOTO T, et al. Effect of tumor size on prognosis in patients with non-small cell lung cancer: The role of segmentectomy as a type of lesser resection [J]. J Thorac Cardiovasc Surg, 2005, 129(1): 87-93.
[11] EL-SHERIF A, GOODING WE, SANTOS R, et al. Outcomes of sublobar resection versus lobectomy for stage I non-small cell lung cancer: A 13-year analysis [J]. Ann Thorac Surg, 2006, 82(2): 408-415.
[12] SIENEL W, STREMMEL C, KIRSCHBAUM A, et al. Frequency of local recurrence following segmentectomy of stage IA non-small cell lung cancer is influenced by segment localization and width of resection margins-implications for patient selection for segmentectomy [J]. Eur J Cardiothorac Surg, 2007, 31(3): 522-527.
[13] EL-SHERIF A, FERNANDO H C, SANTOS R, et al. Margin and local recurrence after sublobar resection of non-small cell lung cancer [J]. Ann Surg Oncol, 2007, 14(8): 2400-2405.
[14] SAWABATA N, OHTA M, MATSUMURA A, et al. Optimal distance of malignant negative margin in excision of non-small cell lung cancer: a multicenter prospective study [J]. Ann Thorac Surg, 2004, 77(2): 415-420.
[15] WATANABE S, ODA M, GO T, et al. Should mediastinal nodal dissection be routinely undertaken in patients with peripheral small-sized (2 cm or less) lung cancer? Retrospective analysis of 225 patients [J]. Eur J Cardiothorac Surg, 2001, 20(5): 1007-1011.
[16] OKADA M, KOIKE T, HIGASHIYAMA M, et al. Radical sublobar resection for small-sized non-small cell lung cancer: a multicenter study [J]. J Thorac Cardiovasc Surg, 2006, 132(4): 769-775.
[17] WOLF A S, RICHARDS W G, JAKLITSCH M T, et al. Lobectomy versus sublobar resection for small (2 cm or less) non-small cell lung cancers [J]. Ann Thorac Surg, 2011, 92(5): 1819-1823.
[18] GONZALEZ-RIVAS D, MENDEZ L, DELGADO M, et al. Uniportal video-assisted thoracoscopic anatomic segmentectomy [J]. J Thorac Dis, 2013, 5(Suppl 3): S226-S233.
[19] NAKAMURA K, SAJI H, NAKAJIMA R, et al. A phaseⅢ randomized trial of lobectomy versus limited resection for small-sized peripheral non-small cell lung cancer (JCOG0802/WJOG4607L) [J]. Jpn J Clin Oncol, 2010, 40(3): 271-274.
Thoracoscopic anatomic segmentectomy for clinical stageⅠ lung cancer
QIAO Yulei, LIN Zongwu,
XI Junjie, XU Songtao, JIANG Wei, WANG Qun (Department of Thoracic Surgery, Zhongshan Hospital, Fudan University, Shanghai 200032, China)
WANG Qun E-mail: wang.qun@zs-hospital.sh.cn
Background and purpose: With the improvement of skill of video-assisted thoracic surgery, thoracoscopic anatomic segmentectomy becomes more and more mature. This paper aimed to study the safety, feasibility and clinical features of thoracoscopic anatomic segmentectomy for stage Ⅰ lung cancer. Methods: Data from 64 patients who was diagnosed as having clinical Ⅰ stage lung cancer and received thoracoscopic anatomic pulmonary segmentectomy were retrospectively analyzed from Mar. 2008 to Jan. 2014. There were 28 men and 36 women with a median age of 59 years (39-86 years). Results: Sixty-four patients underwent thoracoscopic anatomic segmentectomy successfully. The median operative time was 120 min (90-240 min). The median blood loss in operation was 50 mL (10-200 mL). The median thoracic drainage time was 3 d(2-7 d). The median postoperative length of stay was 5 d(3-23 d). There was no postoperative mortality or severe complications. There was one conversion to lobectomy but no conversion to thoracotomy. There were 51 patients with ground glass opacity (GGO). Of the 51 patients, postoperative pathology showed invasive adenocarcinoma in 30, adenocarcinoma in situ in 10, minimally invasive adenocarcinoma in 6 and benign lesions in 5. Conclusion: Thoracoscopic anatomic pulmonary segmentectomy is a feasible and safe technique for a skilled doctor. Not only can it be a method of diagnosis, but also it can be a method of treatment for clinical stage Ⅰ lung cancer, especially for GGO in lung.
Lung cancer; Thoracoscopy; Pulmonary segmentectomy
10.3969/j.issn.1007-3969.2015.08.010
R734.2
A
1007-3639(2015)08-0619-05
2014-12-04
2015-02-09)
王群 E-mail:wang.qun@zs-hospital.sh.cn
