PTP1B基因对人胃癌细胞株的增殖和迁移能力的影响
2015-12-16汪进国茆家定
汪进国,吴 佩,武 健,茆家定
皖南医学院弋矶山医院胃肠外科,安徽 芜湖 241000
PTP1B基因对人胃癌细胞株的增殖和迁移能力的影响
汪进国,吴 佩,武 健,茆家定
皖南医学院弋矶山医院胃肠外科,安徽 芜湖 241000
背景与目的:胃癌是我国常见的消化道恶性肿瘤,术后易复发和转移。前期研究发现,蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase 1B,PTP1B)基因与胃癌肿瘤大小、淋巴结转移及TNM分期有关。本研究通过RNA干扰技术和基因克隆技术分别沉默和上调胃癌细胞中PTP1B基因的表达,观察PTP1B基因对胃癌细胞增殖和迁移能力的影响。方法:将靶向沉默PTP1B基因的短发夹RNA(short hairpin RNA,shRNA)序列和克隆人的PTP1B cDNA基因序列分别转染MKN28和MKN45细胞,采用实时定量PCR(quantitative realtime PCR,qRT-PCR)、蛋白[质]印迹法(Western blot)分别检测转染后细胞中PTP1B基因和蛋白的表达水平,使用细胞计数试剂盒(cell counting kit-8,CCK-8)、Transwell迁移试验和划痕试验分别观察PTP1B基因对细胞增殖和迁移能力的影响。结果:转染shRNA后,MKN28细胞中PTP1B mRNA和蛋白表达量与空白对照组、阴性对照组相比抑制显著(P<0.05)。CCK-8增殖活性实验显示,shRNA沉默PTP1B基因表达后能显著抑制胃癌MKN28细胞在48、72和96 h的增殖活性(P<0.05)。Transwell迁移试验和划痕实验显示,PTP1B表达下调后胃癌MKN28细胞的迁移能力受到显著抑制(P<0.05)。而提高PTP1B在MKN45细胞中表达后,细胞的增殖和迁移能力则显著提高(P<0.05)。结论:PTP1B基因是胃癌细胞增殖和迁移的重要调控因子。
胃癌;蛋白酪氨酸磷酸酶1B;短发夹RNA;细胞增殖;细胞迁移
胃癌是我国常见的消化道恶性肿瘤,其发生、发展是一个多阶段、多因素参与的复杂过程。蛋白质酪氨酸残基的可逆性磷酸化是细胞信号转导通路的重要环节,它调节细胞的生长、增殖、分化、代谢和迁移等。蛋白质酪氨酸残基的磷酸化受到蛋白酪氨酸激酶(protein tyrosine kinases,PTKs)和蛋白酪氨酸磷酸酶(protein tyrosine phosphatases,PTPs)的调控。PTKs负责蛋白质酪氨酸残基的磷酸化,而PTPs负责蛋白质酪氨酸残基的去磷酸化。因此,两者的平衡对维持蛋白质酪氨酸残基的磷酸化状态起到非常重要的作用。蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase 1B,PTP1B)属于PTPs家族一员,是体内广泛表达的细胞内PTPs。近年来研究发现,PTP1B可能起着类似癌基因的作用[1]。PTP1B mRNA和蛋白在胃癌细胞和组织中均过度表达,并且在胃癌组织中,PTP1B的表达与肿瘤大小、淋巴结转移及TNM分期有明显的相关性[2]。本实验通过RNA干扰和基因转染技术分别特异性下调和上调胃癌细胞中的PTP1B表达水平,观察PTP1B表达对胃癌细胞增殖和迁移能力的影响。
1 材料和方法
1.1 材料与试剂
人胃癌MKN28和MKN45细胞株购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库;胎牛血清购自杭州四季青生物工程材料有限公司;RPMI-1640培养液购自美国Gibco公司;真核表达载体pGPU6/ GFP/Neo购自上海吉玛制药技术有限公司;LipofectamineTM2000和G418购自美国Invitrogen公司;PCR引物由生工生物工程(上海)股份有限公司合成;PTP1B抗体购自美国Calbiochem公司;GAPDH单克隆抗体和HRP标记的羊抗鼠的IgG单克隆二抗购自美国Santa Cruz公司。
1.2 方法
1.2.1 细胞培养及细胞转染
将人胃癌MKN28和MKN45细胞加入含10%胎牛血清的RPMI-1640培养液中,以每孔1×105个细胞的密度分别接种于6孔培养板中,放入37 ℃、CO2体积分数为5%的培养箱中进行培养,选用处于对数生长期的细胞进行下一步的实验。取5×105个处于对数生长期的细胞铺于6孔板的每个孔中,分别加入Opti-MEM溶液稀释的pGPU6/GFP/Neo-shRNA、pGPU6/GFP/NeoshRNA NC、pcDNA3.1和pcDNA3.1-PTP1B,以LipofectamineTM2000为转染介质。转染24 h后,用800 µmol/L的G418进行筛选2周。挑选稳定转染的克隆,将G418浓度改为400 µmol/L进行维持。用实时定量PCR(quantitative real-time PCR,qRT-PCR)和蛋白[质]印迹法(Western blot)进行稳定转染克隆的鉴定,并将转染成功的稳转克隆进一步培养和用于下一步试验。未做任何处理的细胞作为空白对照组。
1.2.2 qRT-PCR检测
取1 µg总RNA,按反转录试剂盒说明的方法行反转录。用Opticon qRT-PCR仪(MJ Research,美国)和SYBR Green染料混合物进行PCR,反应条件为:94 ℃变性1 min,60 ℃退火45 s,72 ℃延长10 min,共28个循环,然后从65~95 ℃建立熔解曲线。用Opticon monitor software(Version 3.1,MJ Research,美国)读取PCR结果。PTP1B为目的基因,顺义链为:GAGTTCG AGCAGATCGACAAGTC;反义链为:TAGGAAGCTTGGCCACTCT ACAT。以GAPDH为内参,顺义链为:ACCACAGTCCATGCCATCAC;反义链为:TCCACCACCCTGTTGCTGTA。qRT-PCR结果以Ct值表示,△Ct为同一样本中内参与目的基因Ct值之差,样本中目的基因的表达水平用2△Ct表示。
1.2.3 Western blot检测
收集细胞,利用RIPA裂解液(购自美国Pierce公司)提取总蛋白,BCA法测定总蛋白浓度。每孔加入50 μg的蛋白样品,电泳、转膜、封闭。加入一抗(PTP1B一抗的稀释浓度为1 µg/mL),4 ℃摇床上温育过夜。TBST漂洗3次,每次10 min。加入TBS液稀释的二抗(稀释浓度为1∶2 000),室温下水平摇床上温育2 h。TBST漂洗3次,每次10 min。配置ECL工作液,根据膜的大小,按每10 cm2的膜上加1 mL ECL工作液的比例,滴加ECL工作液到膜上,确保工作液均匀覆盖在膜上,放置1~2 min。取膜,弃ECL工作液,用滤纸吸掉过多的液体。将膜放在两片保鲜膜中间,随后将膜放置到荧光成像仪内,参照仪器说明书进行检测。
1.2.4 细胞增殖活性实验
取对数生长期的细胞,0.25%胰酶消化后计数,96孔板中每孔铺2×103个细胞及200 µL的含10%小牛血清的培养液,每组5个复孔,平推摇匀后置细胞培养箱中培养。分别于细胞加入96孔板后的0、24、48、72和96 h进行细胞计数。细胞的数目是通过吸光度(D)值来表示。具体操作步骤为:在相应的实验时间点,每孔中加入20 µL的细胞计数试剂盒(cell counting kit-8,CCK-8,购自日本Dojindo公司)并且平推摇匀,置细胞培养箱中培养4 h后,用酶标仪检测。在450 nm的波长下读取相应组的D值,取平均值绘制细胞增殖曲线。
1.2.5 针对PTP1B基因序列的RNA干扰载体的构建
根据PTP1B基因的mRNA序列,设计shRNA#1和shRNA#2两对RNA干扰序列,具体序列分别为5’-CACCGCCTCATTCTTGAACTTTCT TTCAAGAGAAGAAGTTCAAGAATGA GTTTTTTG-3’和5’-CACCGAGGACCATG CACTGAGTTTCAAGAGAACTCAGT GCATGGTCCTCTTTTTTG-3’;此外,设计一段与人类基因组无同源性的RNA干扰序列短发夹RNA(short hairpin RNA,shRNA)作为对照:5’-CACCGTTCTCCGAACGTGTC ACGTCAAGAGATTACGTGACACCGT TCGGAGAATTTTTTG-3’。将合成的序列插入表达载体pGPU6/GFP/Neo中的BamHⅠ和BbsⅠ限制性内切酶位点之间。测序确认序列正确后,将纯化的产物转至DH5α感受态细菌,挑选阳性克隆,摇菌后抽提质粒DNA,再行测序,保存测序正确克隆的菌液。每组取菌液100 µL加入到5 mL的LB液体培养基中,37 ℃摇床上摇菌18 h(225×g),然后用质粒DNA的大抽提试剂盒抽提质粒DNA。抽提后的DNA测定其浓度后保存在-20 ℃冰箱中待用。
1.2.6 PTP1B基因克隆和pcDNA3.1-hPTP1B载体构建
引物设计:根据GenBank中人PTP1B cDNA序列(NM-002827)设计引物并且加入带有限制性酶切位点的序列,上游为CTAAGGATCC AAGAAGCAGCAGCGGCTAGG;下游为CAG TGAATTCTGGAGGAGGGTCAGGCTATG。产物的长度为1 318 bp。取胃癌组织标本(经病理证实),按TRIzol试剂说明书提取总RNA,参照RT试剂盒说明书合成cDNA第一条链,然后以其为模板,加入PTP1B全长引物和高保真Taq DNA聚合酶进行PCR。反应条件为94 ℃变性1 min,68 ℃退火1.5 min,72 ℃延长10 min,共40个循环。
pcDNA3.1-hPTP1B载体构建:将PTP1B目的片段及pcDNA3.1载体用BamHⅠ、EcoRⅠ双酶切,琼脂糖电泳切胶回收,定量后按载体和克隆片段1∶6的比例用T4DNA连接酶16 ℃连接过夜。将连接产物转化感受态DH5α,涂板保存,挑菌培养,用质粒提取试剂盒抽提质粒进行DNA测序。双酶切重组质粒,0.2%琼脂糖电泳鉴定。
1.2.7 Transwell迁移实验
取对数生长期的细胞,于实验开始前1 d换成无血清的培养液饥饿细胞。实验组和对照组的每孔下室中加入含10%小牛血清的培养液500 µL。在上室中加入用无血清的培养液稀释至4×105个/mL的细胞500 µL,平推摇匀后放置
于细胞培养箱中培养24 h。取出小室,弃除培养液,用PBS洗3次,每次3 min。用干棉签擦去小室内残留细胞。在4%多聚甲醛中固定15 min,PBS洗3次。将小室放置于预先加有0.1%结晶紫的溶液中,室温下作用30 min。PBS漂洗后,于倒置显微镜下计数(随机选5个视野)和拍照。
1.2.8 细胞划痕实验
取对数生长期细胞,按每孔1×105个细胞的密度接种于6孔板中,培养48 h后细胞铺满6孔板时,利用枪头尖在细胞培养液表面划一条痕迹(长约2 cm),继续培养12和24 h后,在显微镜下观察各组胃癌细胞迁移变化情况。
1.3 统计学处理
应用SPSS 19.0统计软件对数据进行分析。本实验数据以表示,实验组和对照组之间的比较采用独立样本的t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 采用qRT-PCR和Western blot检测PTP1B基因及蛋白的表达
采用qRT-PCR和Western blot检测pGPU6/ GFP/Neo-shRNA NC和pGPU6/GFP/Neo-shRNA转染MKN28细胞后PTP1B基因及蛋白的表达情况。结果显示,与空白组和shRNA NC组相比,shRNA#1和shRNA#2组PTP1B的表达明显受抑制(mRNA:F=180.62,P=0.00;蛋白:F=55.46,P<0.05)。shRNA#1和shRNA#2组PTP1B mRNA表达分别下降了85%和69% (图1)。shRNA#1和shRNA#2组PTP1B蛋白的表达分别减少了82.5%和61.2%(图2)。为了减少干扰的脱靶效应,我们选择了这两个不同PTP1B表达水平的稳定转染细胞进行后续的实验。此外,我们还选择了PTP1B表达水平相对较低的MKN45胃癌细胞株,转染pcDNA3.1-PTP1B以提高MKN45细胞内PTP1B表达水平用于后续实验,采用qRT-PCR和Western blot检测细胞内PTP1B基因和蛋白表达水平(图3)。
2.2 PTP1B表达促进胃癌细胞的增殖活性
为了明确PTP1B在细胞增殖活性中的作用,将得到的不同PTP1B表达水平的稳定转染细胞用于体外增殖活性实验。细胞分别接种在96孔板中,在0、24、48、72和96 h等不同时间段测定细胞增殖活性(以D值来表示,D值越高细胞的增殖速度就越快),绘制细胞增殖曲线(图4)。结果显示,与空白组和shRNA NC组相比,shRNA#1和shRNA#2组在48、72和96 h时细胞的增殖活性明显下降,D值差异有统计学意义(48 h:F=20.005,P=0.002;72 h:F=277.01,P=0.000;96 h:F=173.436,P=0.000)。而提高PTP1B的表达,MKN45细胞增殖活性在72和96 h后明显增高(72 h:F=22.028,P=0.009;96 h:F=38.227,P=0.003,图5)。
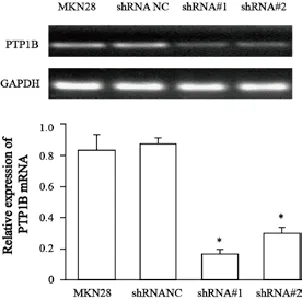
图 1 qRT-PCR检测PTP1B shRNA转染MKN28细胞后PTP1B mRNA的表达水平Fig. 1 qRT-PCR analysis of PTP1B mRNA expression in MKN28 cells transfected with shRNA
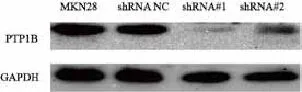
图 2 Western blot检测PTP1B shRNA转染MKN28细胞后PTP1B蛋白表达水平Fig. 2 Western blot analysis of PTP1B protein expression in MKN28 cells transfected with shRNA
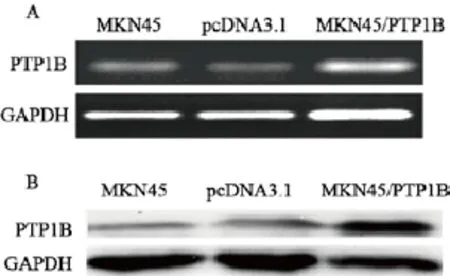
图 3 pcDNA3.1-hPTP1B重组载体转染MKN45细胞后PTP1B的表达Fig. 3 The expression of PTP1B in MKN45 cells transfected with pcDNA3.1-hPTP1B vector
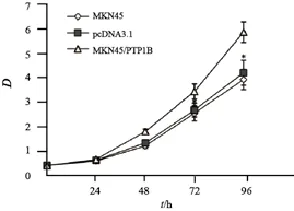
图 4 下调PTP1B在MKN28细胞中的表达明显抑制了细胞的增殖活性Fig. 4 Significant inhibition of cell proliferation after downregulation of PTP1B expression in MKN28 cells
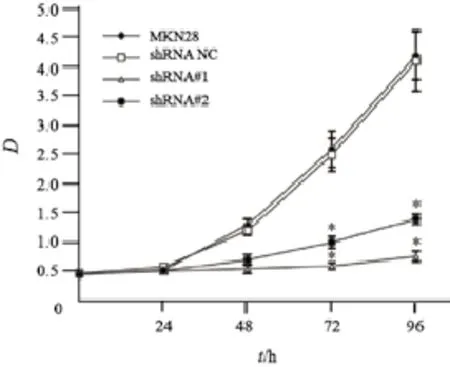
图 5 上调PTP1B在MKN45细胞中的表达明显增强了细胞的增殖活性Fig. 5 Significant enhancement of cell proliferation after up-regulation of PTP1B expression in MKN45 cells
2.3 PTP1B表达增强胃癌细胞的克隆形成能力
将不同PTP1B表达水平的胃癌细胞分别接种在预先铺有1.2%琼脂糖的6孔板中培养2周,观察PTP1B的表达对胃癌细胞克隆形成的影响,并在倒置显微镜下进行克隆计数,比较不同PTP1B表达水平的同样类型胃癌细胞的克隆形成率。结果显示,在MKN28胃癌细胞中,PTP1B表达下调shRNA#1和shRNA#2组的胃癌细胞克隆形成率较MKN28细胞和对照组细胞要明显降低,并且所形成的克隆体积也明显减小(图6),MKN28、shRNA NC、shRNA#1和shRNA#2四组胃癌细胞的克隆形成率分别为(48.6±5.6)%、(42.7±5.0)%、(12.1±4.4)%和(22.8±3.1)%(F=85.427,P=0.000)。而提高PTP1B表达后,胃癌细胞克隆形成率明显增加、形成的克隆体积也较大(图7),MKN45/ PTP1B、MKN45/pcDNA3.1和MKN45组胃癌细胞的克隆形成率分别为(80.5±9.2)%、(38.6±6.5)%和(28.9±5.4)%(F=76.24,P=0.000)。
2.4 PTP1B表达促进胃癌细胞的迁移能力
将实验组和对照组胃癌细胞分别接种在Transwell小室中,用含10%小牛血清培养液作为细胞趋向运动的诱导剂,24 h后对穿过基底膜的胃癌细胞用0.1%的结晶紫进行染色,显微镜下计数并进行统计学处理。结果显示,空白组、shRNA NC、shRNA#1和shRNA#2组在24 h穿过基底膜的细胞数分别是(135.8±20.7)、(142.5±23.0)、(35.3±6.7)和(43.1±8.4)个/视野(空白组和shRNA NC组 vs shRNA#1和shRNA#2组:F=88.138,P=0.000,图8)。与之相反,上调PTP1B在胃癌细胞中的表达后,24 h穿过基底膜的细胞明显增加(空白组和pcDNA3.1组 vs MKN45/pcDNA3.1组:F=36.932,P=0.000,图9)。为了进一步明确PTP1B的表达对MKN28胃癌细胞迁移的影响,本研究同时进行了细胞划痕实验,结果显示,随着时间推移,空白组和shRNA NC组细胞愈合速度较shRNA#1、shRNA#2组的愈合速度快(F=10.833,P=0.003)。因此,RNA沉默PTP1B表达后可以有效抑制MKN28细胞迁移能力(图10)。
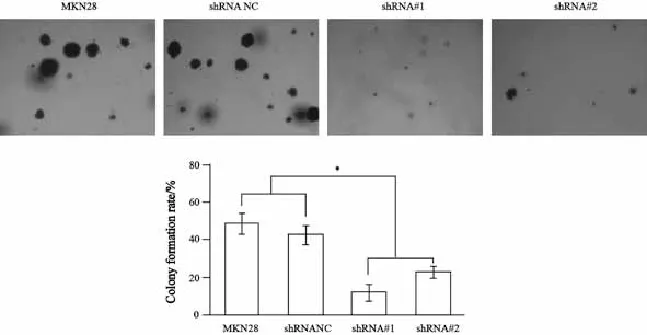
图 6 下调PTP1B的表达抑制MKN28细胞的克隆形成Fig. 6 Inhibition of colony formation after down-regulation of PTP1B expression in MKN28 cells
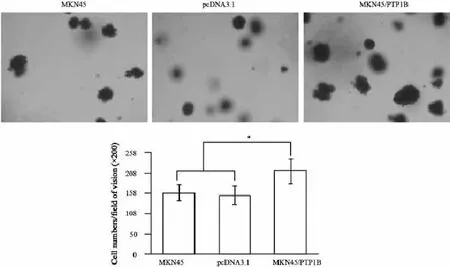
图 7 上调PTP1B的表达促进MKN45细胞的克隆形成Fig. 7 Promotion of colony formation after up-regulation of PTP1B expression in MKN45 cells
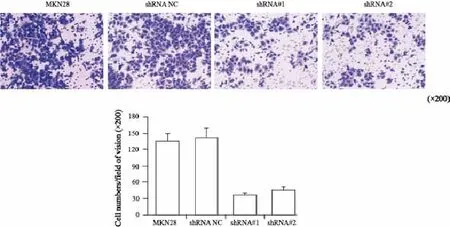
图 8 Transwell迁移实验检测转染shRNA后MKN28细胞迁移能力Fig. 8 Cell migration of MKN28 cells transfected with shRNA detected by Transwell assay
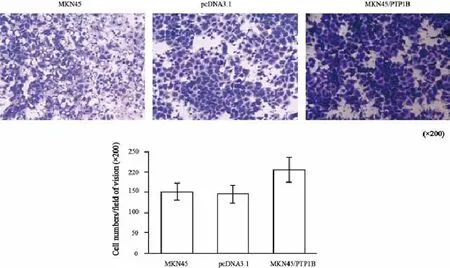
图 9 上调PTP1B的表达增强MKN45细胞的迁移能力Fig. 9 Enhancement of cell migration after up-regulation of PTP1B expression in MKN45 cells
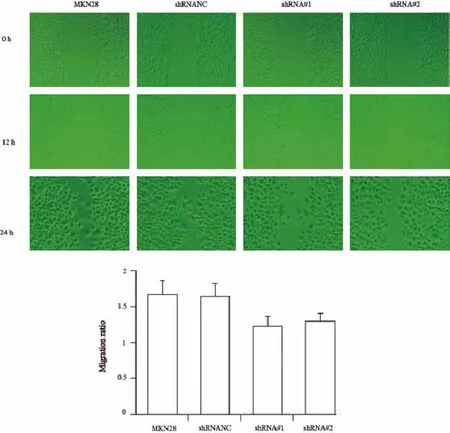
图 10 划痕实验检测转染shRNA后MKN28细胞迁移能力Fig. 10 Cell migration of MKN28 cells transfected with shRNA detected by wound healing assay
3 讨 论
进展期胃癌手术后5年生存率只有20%~50%,被寄予厚望的辅助化疗、放疗等迄今也未能明显改善胃癌患者的预后[3]。研究发现,影响胃癌预后的因素较多,主要包括胃癌早期诊断率低、手术后易于复发和转移等。因此,充分认识胃癌生物学行为的分子机制研究具有重要作用。PTP1B是PTPs家族中的一员,最初是从人的胎盘组织中所提取作为一个相对分子质量为37×103的催化结构域[1]。研究结果显示,PTP1B在乳腺癌[4]、卵巢癌[5]、结肠癌[6]和一些上皮来源的肿瘤[7]等多种肿瘤组织或细胞中高表达,并有促进细胞增殖生长、分化和肿瘤细胞转移的作用。前期研究发现,PTP1B在胃癌细胞株和胃癌组织中均高表达,并且PTP1B在胃癌组织中的表达与胃癌的TNM分期、淋巴结浸润及肿瘤原发部位的浸润有明显的相关性[2]。PTP1B在TNM分期较晚(Ⅲ和Ⅳ期)和有淋巴结转移(N1、N2和N3)的患者胃癌组织中的表达要明显高于其在TNM分期较早(Ⅰ和Ⅱ期)和无淋巴结转移(N0)的患者胃癌组织中的表达。
本实验将shRNA转染MKN28胃癌细胞下调PTP1B表达。qRT-PCR及Western blot分析结果显示,PTP1B mRNA和蛋白表达均被明显抑制。PTP1B表达下调后,MKN28细胞的增殖活性及迁移能力被显著抑制。相反,pcDNAPTP1B转染MKN45细胞上调PTP1B表达后,MKN45细胞的增殖活性和迁移能力明显增强。因此,PTP1B与胃癌的增殖、迁移、侵袭和转移相关。在结肠癌中,PTP1B通过激活Src激酶而促进结肠癌细胞在裸鼠体内的生长[6]。在永生化成纤维细胞中,下调PTP1B在细胞内的表达可以降低Ras原癌基因的活性从而达到抑制该细胞的恶性转化和增殖的作用[8]。Julien等[9]的研究显示,PTP1B的表达是HER-2/Neu诱导的乳腺癌所必需的,并且下调PTP1B表达可以抑制HER-2/Neu诱导的乳腺癌的发生和肺部转移。
肿瘤细胞的增殖和转移是一系列多因素、多信号通路相互作用的结果。目前的研究结果显示,PTP1B与ErbB2、Akt/PIK、Ras等多种信号转导通路相互作用,调控肿瘤增殖、转化和侵袭[10]。本实验也证实PTP1B表达下调抑制胃癌细胞的增殖和迁移。因此,进一步研究PTP1B可能有助于揭示胃癌细胞生物学行为的分子机制,并可能为胃癌的分子靶向治疗提供新的研究方向。
[1] ANDERIE I, SCHULZ I, SCHMID A. Characterization of the C-terminal ER membrane anchor of PTP1B [J]. Exp Cell Res, 2007, 313(15): 3189-3197.
[2] WANG J, LIU B, CHEN X, et al. PTP1B expression contributes to gastric cancer progression [J]. Med Oncol, 2012, 29(2): 948-956.
[3] SUN J, SONG Y, WANG Z, et al. Benefits of hyperthermic intraperitoneal chemotherapy for patients with serosal invasion in gastric cancer: a meta-analysis of the randomized controlled trials [J]. BMC Cancer, 2012, 12: 526.
[4] SOYSAL S, OBERMANN E C, GAO F, at al. PTP1B expression is an independent positive prognostic factor in human breast cancer [J]. Breast Cancer Res Treat, 2013, 137(2): 637-644.
[5] FAN G, LIN G, LUCITO R, et al. Protein-tyrosine phosphatase 1B antagonized signaling by insulin-like growth factor-1 receptor and kinase BRK/PTK6 in ovarian cancer cells [J]. J Biol Chem, 2013, 288(34): 24923-24934.
[6] ZHU S, BJORGE J D, FUJITA D J. PTP1B contributes to the oncogenic properties of colon cancer cells through Src activation [J]. Cancer Res, 2007, 67(21): 10129-10137.
[7] BALAVENKATRAMAN K K, ACETO N, BRITSCHGI A, et al. Epithelial protein-tyrosine phosphatase 1B contributes to the induction of mammary tumors by HER2/Neu but is not essential for tumor maintenance [J]. Mol Cancer Res, 2011, 9(10): 1377-1384.
[8] DUBÉ N, CHENG A, TREMBLAY M L. The role of protein tyrosine phosphatase 1B in Ras signaling [J]. Proc Natl Acad Sci USA, 2004, 101(7): 1834-1839.
[9] JULIEN S G, DUBÉ N, READ M, et al. Protein tyrosine phosphatase 1B deficiency or inhibition delays ErbB2-induced mammary tumorigenesis and protects from lung metastasis [J]. Nat Genet, 2007, 39(3): 338-346.
[10] FELDHAMMER M, UETANI N, MIRANDA-SAAVEDRA D, et al. PTP1B: a simple enzyme for a complex world [J]. Crit Rev Biochem Mol Biol, 2013, 48(5): 430-445.
Effect of PTP1B gene on the proliferation and migration of human gastric cancer cell lines
WANG
Jinguo, WU Pei, WU Jian, MAO Jiading (Department of Gastrointestinal Surgery, Yijishan Hospital, Wannan Medical College, Wuhu Anhui 241000, China)
WANG Jinguo E-mail: shwangjg@sina.com
Background and purpose: Gastric cancer is the most common malignant tumor of digestive tract, and the possibility of postoperative recurrence and metastasis is higher. Our previous studies showed that protein tyrosine phosphatase1B (PTP1B) gene is closely correlated with tumor size, lymph node metastasis and TNM stage of gastric cancer. The purpose of the present study was to explore the effect of PTP1B gene on cell proliferation and migration of gastric cancer cell lines. Methods: Short hairpin RNA (shRNA) sequence targeting PTP1B gene and PTP1B cDNA were transfected into MKN28 and MKN45 cells, respectively. The expression of PTP1B mRNA and its protein in MKN28 and MKN45 cells were detected by quantitative real-time PCR (qRT-PCR) and Western blot, respectively. The effect of PTP1B on cell proliferation and migration was respectively assessed by cell counting kit-8 (CCK-8) assay, Transwell migration assay and wound healing assay. Results: Compared with blank and negative controls, the expressions of PTP1B mRNA and protein in MKN28 cells were successfully suppressed after the cells were transfected with shRNA (P<0.05). As CCK-8 test showed, the proliferation of MKN28 cells was successfully restrained at 48, 72 and 96 h after transfected with shRNA compared with blank control and negative control (P<0.05). Transwell and wound healing test were performed after PTP1B expression was interfered by shRNA. The result demonstrated that migration of MKN28 cells was significantly inhibited (P<0.05). On the contrary, the expressions of PTP1B mRNA and protein in MKN45 cells were obviously enhanced after the cells were transfected with PTP1B cDNA. And the proliferation and migration of cells were significantly increased. Conclusion: PTP1B gene is an
Gastric cancer; Protein tyrosine phosphatase 1B; Short hairpin RNA; Cell proliferation; Cell migration
10.3969/j.issn.1007-3969.2015.08.004
R735.2
A
1007-3639(2015)08-0579-09
2014-09-15
2014-11-20)
安徽省教育厅自然科学基金资助(2011KJ193);芜湖市科技计划项目资助(2012hm29-1);安徽省自然科学基金(1508085MH147)。
汪进国 E-mail:shwangjg@sina.com
important enchancer for the proliferation and migration of gastric cancer.
