PTEN蛋白缺失与中国前列腺癌患者根治术后生化复发风险关系的研究
2015-12-16杨晓群孙娟娟甘华磊王朝夫
王 涛,杨晓群,孙娟娟,甘华磊,王朝夫
复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032
PTEN蛋白缺失与中国前列腺癌患者根治术后生化复发风险关系的研究
王 涛,杨晓群,孙娟娟,甘华磊,王朝夫
复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:张力蛋白同源第10号染色体缺失的磷酸酶基因(phosphatase and tensin homolog deleted on chromosome 10,PTEN)缺失是西方国家前列腺癌中最常见的基因异常之一,与肿瘤的进展、预后均有一定相关性。鉴于前列腺癌的异质性,不同地区、人群间其基因表达谱存在广泛差异,本研究主要探讨PTEN蛋白缺失在中国前列腺癌患者中的发生率以及与生化复发的相关性。方法:选取2006—2011年225例局限性前列腺癌并采取根治切除术的患者为研究对象,回顾性收集所有患者的临床病理资料,包括确诊时年龄、血清前列腺特异性抗原(prostate-specific antigen,PSA)值、Gleason分级评分、TNM分期、手术切缘和术后生化复发与否及时间。将225例局限性前列腺癌根治切除标本的肿瘤组织及癌旁组织制成组织芯片(tissue microarray,TMA),采用免疫组织化学技术检测PTEN蛋白在肿瘤及癌旁组织中的表达。采用χ2检验分析前列腺癌组织中PTEN蛋白缺失与患者临床病理特征的相关性。运用Kaplan-Meier生存分析模型、Cox比例风险模型分析PTEN蛋白缺失及患者临床病理特征与生化复发的关系。结果:前列腺癌患者中PTEN蛋白缺失率为15%(33/217),且存在PTEN蛋白缺失的前列腺癌患者其确诊时血清PSA值(P=0.030)及年龄(P=0.009)要显著高于PTEN表达的前列腺癌患者。单因素生存分析显示,PTEN表达情况(P=0.013 1)、确诊时血清PSA值(P=0.000 4)和Gleason分级评分(P=0.019 8)与前列腺癌患者的生化复发相关。Cox多因素分析结果表明,PTEN蛋白表达情况(HR=0.536,P=0.044)、确诊时血清PSA值(HR=1.879,P=0.001)和Gleason分级评分(HR=1.361,P=0.030)为前列腺癌患者生化复发的独立预后因素。结论:PTEN蛋白表达情况是局限性前列腺癌患者根治术后生化复发的独立预后因素,检测PTEN蛋白有望改善根治术后前列腺癌患者的管理及指导进一步治疗。
前列腺肿瘤;张力蛋白同源第10号染色体缺失的磷酸酶基因;预后;生化复发;免疫组织化学
前列腺癌是发达国家中男性最常见的恶性肿瘤,其发生率和死亡率在不同的国家和地区存在显著的差异[1-2]。虽然中国前列腺癌发病率较西方国家低,但其已成为中国男性泌尿生殖系统第二常见的恶性肿瘤,仅次于膀胱癌[1-3]。近年来的研究已证实张力蛋白同源第10号染色体缺失的磷酸酶基因(phosphatase and tensin homolog deleted on chromosome 10,PTEN)缺失是西方国家前列腺癌最常见的体细胞基因畸变之一,且在多项研究中证实与肿瘤进展及治疗抵抗有关[4-7]。作为脂质磷酸酶和PI3K/AKT/mTOR通路的负性调节因子,PTEN调控的蛋白与细胞生长、生存和基因稳定性有关[8]。大多数情况下PTEN蛋白失活是通过10号染色体长臂2区3带(10q23)上的基因缺失所致,该缺失能导致3,4,5三磷酸肌醇的累积,进而过度激活AKT,作用于包括BAD、GSK3、IkB激酶、mTOR以及FOXO家族等下游蛋白,致使其细胞代谢、分化、生存和细胞周期等调控作用的异常而出现细胞恶变,细胞的黏附、移动和侵袭能力增强[4,9]。
最近,一项针对中国前列腺癌患者的研究通过全基因组测序,发现仅在7%的患者中存在PTEN缺失,而在西方国家前列腺癌中PTEN缺失率达到约40%[10]。因此,为进一步调查PTEN缺失在中国前列腺癌患者中的发生率及其预后意义,我们将225例中国局限性前列腺癌患者的根治标本制成组织芯片(tissue microarray, TMA),并用免疫组织化学方法(immunohistochemistry,IHC)检测PTEN蛋白表达。由于前列腺癌存在高度异质性,有多样的生物学行为,目前临床常用的指标如Gleason评分不足以区分及准确地指出每一个患者的临床预后,该项研究有助于更好地理解中国与西方前列腺癌患者内在的基因表达差异,并且为预测中国前列腺癌患者的生化复发提供可靠的预后因子。
1 资料和方法
1.1 一般资料
选取复旦大学附属肿瘤医院2006—2011年间经病理诊断确诊为局限性前列腺癌的225例患者为研究对象。根治术前接受新辅助化疗或放疗的患者不纳入本研究,组织学特点支持神经内分泌癌或小细胞癌的患者不纳入本研究。通过医院电子病历系统收集患者相关资料,且确诊时的石蜡病理组织可以获得。
患者确诊时的平均年龄为71.9岁,中位年龄为73岁(52~87岁);98.2%(221/225)的病例可获得其术前血清前列腺特异性抗原(prostatespecific antigen,PSA)水平,其中PSA>20 ng/mL 69例(31.2%),PSA 10~20 ng/mL 83例(37.6%),PSA<10 ng/mL 69例(31.2%)[11]。Gleason评分≤6分40例(17.8%),7分143例(63.6%),≥8分42例(18.7%)。72.4%(163/225)的肿瘤局限于前列腺,13.8%(31/225)突破前列腺被膜,12.0%(27/225)侵犯精囊腺,4.0%(9/225)有区域淋巴结转移,22.7%(51/225)的患者手术切缘阳性。中位随访时间达到46.2个月(0.9~98.0个月)。生化复发定义为术后PSA水平超过0.2 ng/mL[12]。本研究人群的
主要临床病理参数见表1。
1.2 构建组织芯片
对225例患者的HE切片重新复核切片,找到典型的肿瘤区域,并在蜡块相应位置标记作为癌组织的穿刺点;如果是多灶肿瘤,仅选取主要瘤体(最高Gleason评分或者最大直径者)。用带芯薄壁不锈钢穿刺针(内径约0.6 mm)从供体组织蜡块选定部位逐个取出组织芯片。每个病例均取癌组织及相应癌旁正常腺体2次,共制成8张组织芯片,包含900个组织点,其中癌组织和相应周围正常腺体组织各有450个。
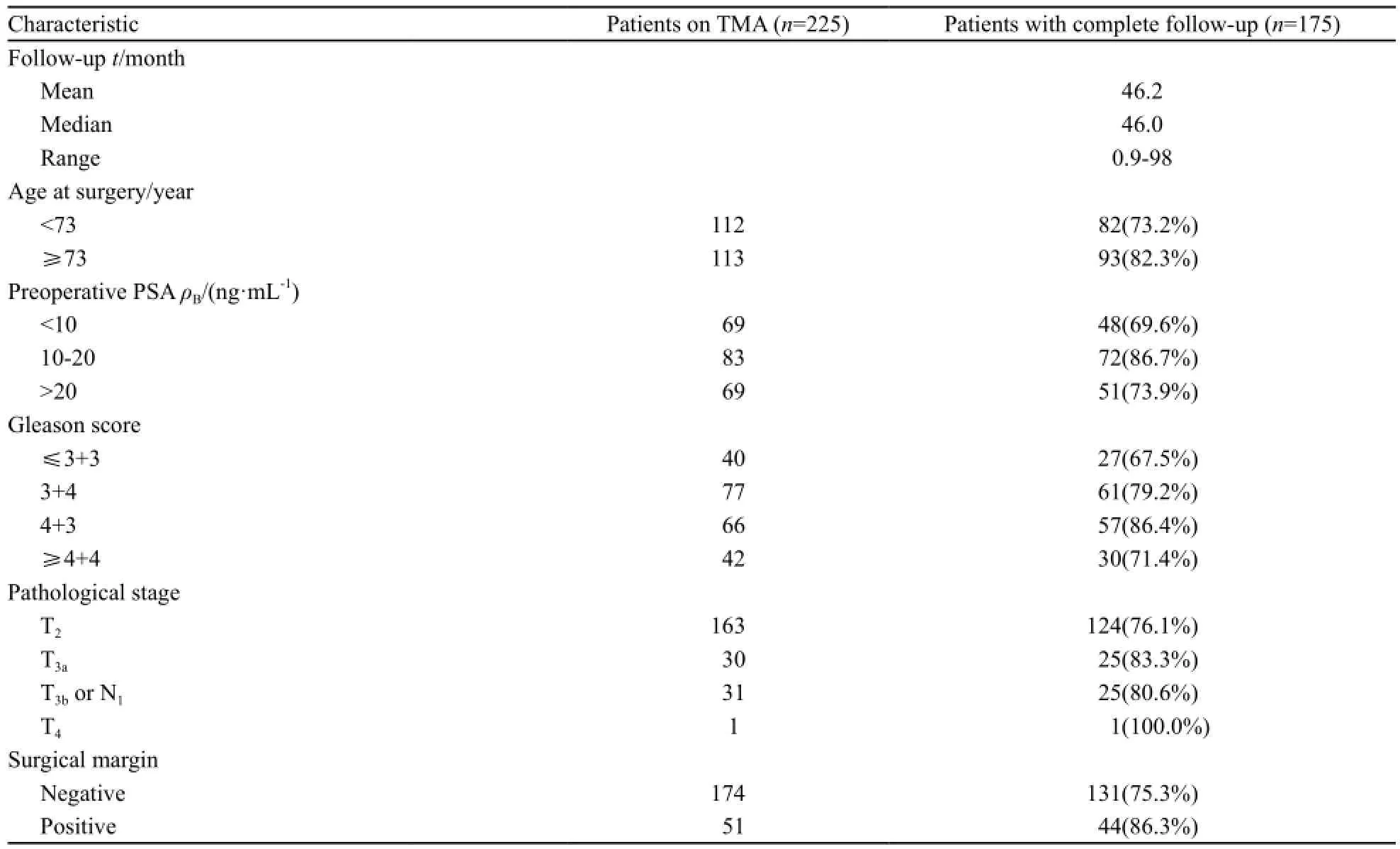
表 1 225例前列腺癌患者一般资料分析Tab. 1 Clinicopathologic features of the entire study cohort of 225 patients with prostate cancer
1.3 PTEN蛋白表达的检测及判读
采用免疫组织化学检测PTEN蛋白表达。兔抗人PTEN单克隆抗体购自美国CST公司;一抗稀释液购自丹麦Dako公司;二抗试剂盒购自中国基因科技(上海)有限公司。兔抗人PTEN单克隆抗体与一抗稀释液按照1∶100比例稀释。采用免疫组化染色EnVision法,具体操作步骤按照试剂盒说明书进行,用PBS代替一抗作为阴性对照。
采用H-score半定量法评价细胞核及细胞质的染色强度[12]。每一病例计算其含癌组织点的平均H-score,并将患者分成H-score=0和H-score>0两组。H-score为0判读为阴性,即PTEN蛋白缺失;H-score>0判断为阳性。血管内皮细胞和基质作为阳性内对照。由2名泌尿系统肿瘤领域的病理科医师按照上述评分标准行盲法判读;其中8个病例因其癌旁正常腺体缺乏PTEN蛋白染色而不纳入本研究分析。
1.4 统计学处理
采用SPSS 20.0统计学软件进行数据录入及分析。利用χ2检验分析PTEN蛋白表达与临床病理参数的相关性。采用Kaplan-Meier法分析PTEN蛋白表达及患者临床病理特征包括确诊时年龄、PSA值、Gleason评分、TNM分期、手术切缘与生化复发的相关性,并用Log-rank法对结果进行显著性检验。采用Cox比例风险模型分析能独立预测生化复发的指标。以双侧检验P<0.05为差异有统计学意义。
2 结 果
2.1 免疫组织化学技术检测结果
免疫组织化学技术检测结果显示,15%(33/217)的患者出现PTEN蛋白表达缺失(图1)。分析PTEN蛋白缺失与临床病理参数的关系发现,在PSA>20 ng/mL的病例中有26%(17/66)出现PTEN蛋白缺失,在PSA为10~20 ng/mL和 PSA<10 ng/mL的病例中分别有13%(10/78)和10%(7/69)出现PTEN蛋白缺失(P=0.03)。另外,年龄≥73岁的前列腺癌患者,其PTEN蛋白缺失率要显著高于年龄<73岁的患者,分别为22%(23/106)和9%(10/111)(P=0.009)。本研究中PTEN蛋白缺失与病理分期(P=0.18)、Gleason评分(P=0.276)和手术切缘(P=0.148)均无显著相关性。PTEN蛋白表达情况与临床病理特征的关系见表2。
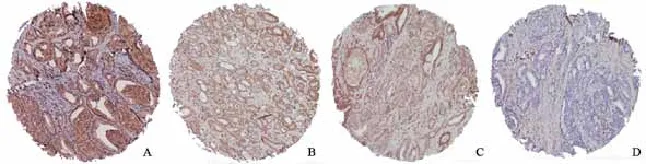
图 1 PTEN蛋白在前列腺癌中的表达情况Fig. 1 Patterns of PTEN expression in prostate cancer

表 2 PTEN蛋白表达与前列腺癌临床病理参数的关系Tab. 2 Correlation of immunohistochemical PTEN expression with clinicopathological parameters at radical prostatectomy
2.2 单因素和多因素分析结果
采用Kaplan-Meier生存分析模型、Cox比例风险模型分析PTEN蛋白表达情况及各临床病理参数与前列腺癌生化复发的关系。在225例患者中共收集到175例患者的随访信息,中位随访时间46.2个月,33.7%(59/175)的患者在
随访时间内出现生化复发。单因素分析结果显示,PTEN蛋白表达情况(P=0.013 1)、术前PSA水平(P=0.000 4)及Gleason分级评分(P=0.019 8)分别与生化复发显著相关,PTEN蛋白缺失、术前PSA水平高及Gleason分级评分高的患者有更短的生化复发时间;而年龄(P=0.442 1)、病理分期(P=0.180 6)、手术切缘(P=0.081 4)均与前列腺癌的生化复发无关。以血清PSA值、Gleason分级评分和PTEN表达为基础的Kaplan-Meier生存曲线见图2。多因素分析结果显示,PTEN蛋白表达情况(HR=0.536,P=0.044)、血清PSA值(HR=1.879,P=0.001)和Gleason分级评分(HR=1.361,P=0.03)为前列腺癌患者生化复发的独立预后因素(表3)。

图 2 以术前PSA水平、Gleason评分和PTEN蛋白表达为基础绘制的Kaplan-Meier曲线图Fig. 2 Kaplan-Meier survival curves of patients based on preoperative PSA levels, Gleason scores and expression of PTEN in prostate cancer

表 3 PTEN蛋白表达及各临床病理参数对于前列腺癌根治术后生化复发的预测价值Tab. 3 Predictive value of PTEN expression and clinico-pathological parameters for postoperative biochemical recurrence
3 讨 论
本研究评价了PTEN蛋白在225例局限性前列腺癌根治术标本中的表达情况及与临床病理参数的关系,并收集完善175例患者的随访资料,分析PTEN蛋白表达与生化复发的关系。本
研究发现,PTEN蛋白缺失发生在15%的前列腺癌患者中,且存在PTEN蛋白缺失的患者其生化复发风险增大,PTEN蛋白缺失是预测前列腺癌生化复发的独立预后因子。
先前已有研究报道PTEN蛋白与前列腺癌的关系。在西方国家,约40%的前列腺癌患者出现纯合或杂合的PTEN蛋白缺失,显著高于本研究前列腺癌患者的PTEN蛋白缺失率(15%)[13-14]。通过免疫组织化学技术或荧光原位杂交技术(fluorescence in situ hybridization,FISH),多项研究已证实PTEN蛋白表达减少或缺失与不良的生存预后有关[6,12]。对451例局限性前列腺癌根治术后复发患者及451例未复发患者进行病例对照研究,采用免疫组织化学技术检测分析这些患者PTEN表达情况,发现存在PTEN蛋白缺失的患者,根治术后复发风险提高,且独立于已知的临床病理参数[12]。另有研究发现,存在PTEN蛋白缺失且发生转移的去势抵抗前列腺癌患者有更低的总体生存率,阿比特龙在这些患者中的有效作用时间更短[7]。目前,Gleason分级评分系统是评价前列腺癌患者生存预后的主要工具,Gleason评分越高,预后越差[15]。本研究同样证实Gleason评分为前列腺癌患者生化复发的独立预后指标,Gleason高评分(Gleason≥4+4)患者生化复发风险显著升高;但是,鉴于前列腺癌本身为高度异质性的疾病,Gleason分级评分系统存在一定的局限性,不同患者即使所得Gleason评分相同,临床预后也会出现较大差异[16-17];如本实验Gleason评分3+4的患者组中有26%(16/61)出现生化复发,在这部分患者中有25%(4/16)检测出PTEN蛋白缺失,表明即使PTEN蛋白与Gleason评分不直接相关,仍可作为Gleason评分的辅助指标协助判断前列腺癌患者的预后。此外,本研究发现,PTEN蛋白缺失与前列腺癌患者的年龄有关,年龄≥73岁的患者,其PTEN蛋白缺失率要显著高于年龄<73岁的患者,分别为22%(23/106)和9%(10/111) (P=0.009)。鉴于研究人群PTEN蛋白缺失率较低(15%),不同年龄组中PTEN蛋白缺失相关的生化复发病例所占比例不大,因此,出现本研究中PTEN为生化复发的独立预测指标,而年龄与生化复发无关的情况(P=0.442 1);以往研究同样证实年龄不是前列腺癌生化复发的有效预测指标[12]。本研究纳入患者其术后治疗存在差异,针对高分级、高分期的患者会针对性的采取内分泌治疗;但是,本研究中传统的预后指标如PSA和Gleason评分均被证实能较好地预测生化复发,可以推断整体上内分泌治疗对生化复发的影响有限,PTEN蛋白缺失预测生化复发具有一定参考价值。另有研究表明,PTEN蛋白缺失不是一个独立的生化复发预测因子,除非联合其他生物标志物。如Heselmeyer-Haddad等[18]发现,在根治术后复发的前列腺癌患者中PTEN蛋白缺失率达到57%,PTEN、TBL1XR1和MYC探针联合预测前列腺癌复发的灵敏度达到86%。此外,TMPRSS2:ERG基因融合已被证实在前列腺癌的发生、发展中起到重要作用,有不少研究探索了PTEN蛋白缺失与ERG重排间的关系以及他们的预后作用。Yoshimoto等[11]发现,单独的PTEN蛋白缺失或TMPRSS2:ERG基因融合都不能很好地预测预后,但当二者联合后能够预测早期生化复发。本研究结果显示,PTEN蛋白缺失能独立预测中国前列腺癌患者的生化复发,支持前者的观点。
本研究使用免疫组织化学技术来检测PTEN蛋白的表达情况。Mao等[10]利用单核苷酸多态性序列分析发现,PTEN蛋白失活发生在7%(3/39)的中国前列腺癌患者中,略低于本研究结果,推测原因一是不同研究所选样本存在异质性;二是PTEN蛋白表达失活可能通过多重机制,如microRNA表达及启动子甲基化等,而不仅仅限于基因突变。此外,先前的研究已证实在前列腺癌组织中FISH检测PTEN蛋白缺失同免疫组织化学技术检测PTEN蛋白表达之间存在较高的一致性。FISH检测出的PTEN蛋白缺失中80%能被免疫组织化学技术检测出来;同样通过高分辨率单核苷酸序列分析检测出的PTEN蛋白缺失中超过80%能被免疫组织化学技术检测出来[5]。其他两项研究也发现FISH检测出的PTEN蛋白缺失中有52%或66%能通过免疫组织化学技术检测出PTEN蛋白缺失[14,19]。值得注意的是,免疫组织化学技术检测出PTEN蛋白缺失的病例中有45%或37%不能通过FISH检测出
相应基因缺失,同样表明除了基因缺失,存在其他机制导致PTEN蛋白缺失,可能包括突变、microRNA表达和启动子甲基化等[5,14,19-20]。因此,FISH可能客观上会低估前列腺癌中PTEN蛋白的缺失率。免疫组织化学技术检测评估PTEN蛋白表达的优势在于可以检测出除基因异常改变以外的机制导致的PTEN蛋白缺失[5,21]。临床应用上,在常规福尔马林固定石蜡包埋的病理标本上应用免疫组织化学技术检测PTEN蛋白表达情况是一种比较有效的指导前列腺癌预后的检测手段。
综上所述,本研究证实PTEN蛋白缺失在中国前列腺癌患者的发生、发展中发挥重要的作用,是一种有效的预后指标,有助于指导前列腺癌患者的临床处理。该研究的结论仍需要大样本的实验进一步证实。随着以PI3K信号通路多个成分为靶点的治疗手段逐步开展,稳定检测PTEN蛋白的表达情况有望在临床前列腺癌管理中发挥重要作用。
[1] JEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[2] GRONBERG H. Prostate cancer epidemiology [J]. Lancet, 2003, 361(9360): 859-864.
[3] SIM H G, CHENG C W. Changing demography of prostate cancer in Asia [J]. Eur J Cancer, 2005, 41(6): 834-845.
[4] CAIRNS P, OKAMI K, HALACHMI S, et al. Frequent inactivation of PTEN/MMAC1 in primary prostate cancer[J]. Cancer Res, 1997, 57(22): 4997-5000.
[5] LOTAN T L, GUREL B, SUTCLIFFE S, et al. PTEN protein loss by immunostaining: analytic validation and prognostic indicator for a high risk surgical cohort of prostate cancer patients [J]. Clin Cancer Res, 2011, 17(20): 6563-6573.
[6] YOSHIMOTO M, CUNHA I W, COUDRY R A, et al. FISH analysis of 107 prostate cancers shows that PTEN genomic deletion is associated with poor clinical outcome [J]. Br J Cancer, 2007, 97(5): 678-685.
[7] FERRALDESCHI R, NAVA RODRIGUES D, RIISNAES R, et al. PTEN Protein Loss and Clinical Outcome from Castration-resistant Prostate Cancer Treated with Abiraterone Acetate [J]. Eur Urol, 2015, 67(4): 795-802.
[8] CHOW L M, BAKER S J. PTEN function in normal and neoplastic growth [J]. Cancer Lett, 2006, 241(2): 184-196.[9] CARVER B S, CHAPINSKI C, WONGVIPAT J, et al. Reciprocal feedback regulation of PI3K and androgen receptor signaling in PTEN-deficient prostate cancer [J]. Cancer Cell, 2011, 19(5): 575-586.
[10] MAO X, YU Y, BOYD L K, et al. Distinct genomic alterations in prostate cancers in Chinese and Western populations suggest alternative pathways of prostate carcinogenesis [J]. Cancer Res, 2010, 70(13): 5207-5212.
[11] YOSHIMOTO M, JOSHUA A M, CUNHA I W, et al. Absence of TMPRSS2:ERG fusions and PTEN losses in prostate cancer is associated with a favorable outcome [J]. Mod Pathol, 2008, 21(12): 1451-1460.
[12] CHAUX A, PESKOE S B, GONZALEZ-ROIBON N, et al. Loss of PTEN expression is associated with increased risk of recurrence after prostatectomy for clinically localized prostate cancer [J]. Mod Pathol, 2012, 25(11): 1543-1549.
[13] LIU W, CHANG B, SAUVAGEOT J, et al. Comprehensive assessment of DNA copy number alterations in human prostate cancers using Affymetrix 100K SNP mapping array [J]. Genes Chromosomes Cancer, 2006, 45(11): 1018-1032.
[14] HAN B, MEHRA R, LONIGRO R J, et al. Fluorescence in situ hybridization study shows association of PTEN deletion with ERG rearrangement during prostate cancer progression [J]. Mod Pathol, 2009, 22(8): 1083-1093.
[15] EGGENER S E, SCARDINO P T, WALSH P C, et al. Predicting 15-year prostate cancer specific mortality after radical prostatectomy [J]. J Urol, 2011, 185(3): 869-875.
[16] EPSTEIN J I, FENG Z, TROCK B J, et al. Upgrading and downgrading of prostate cancer from biopsy to radical prostatectomy: incidence and predictive factors using the modified Gleason grading system and factoring in tertiary grades [J]. Eur Urol, 2012, 61(5): 1019-1024.
[17] SHEN M M, ABATE-SHEN C. Molecular genetics of prostate cancer: new prospects for old challenges [J]. Genes Dev, 2010, 24(18): 1967-2000.
[18] HESELMEYER-HADDAD K M, BERROA GARCIA L Y, BRADLEY A, et al. Single-cell genetic analysis reveals insights into clonal development of prostate cancers and indicates loss of PTEN as a marker of poor prognosis [J]. Am J Pathol, 2014, 184(10): 2671-2686.
[19] VERHAGEN P C, VAN DUIJN P W, HERMANS K G, et al. The PTEN gene in locally progressive prostate cancer is preferentially inactivated by bi-allelic gene deletion [J]. J Pathol, 2006, 208(5): 699-707.
[20] CORREIA N C, GIRIO A, ANTUNES I, et al. The multiple layers of non-genetic regulation of PTEN tumour suppressor activity [J]. Eur J Cancer, 2014, 50(1): 216-225.
[21] REID A H, ATTARD G, BREWER D, et al. Novel, gross chromosomal alterations involving PTEN cooperate with allelic loss in prostate cancer [J]. Mod Pathol, 2012, 25(6): 902-910.
PTEN protein loss is associated with an increased risk of recurrence in Chinese patients after prostatectomy for clinically localized prostate canc er
WANG Tao, YANG Xiaoqun, SUN Juanjuan,
GAN Hualei, WANG Chaofu (Department of Pathology, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
WANG Chaofu E-mail: wangchaofu@126.com
Background and purpose: Loss of the tumor suppressor phosphatase and tensin homolog deleted on chromosome 10 (PTEN) is one of the most common somatic genetic aberrations in prostate cancer in Western countries and is frequently associated with tumor progression and poor prognosis. This study aimed to investigate the frequency of PTEN protein loss in Chinese prostate cancer patients and to determine its association with the biochemical recurrence of prostate cancer. Methods: The data from 225 diagnosed localized prostate cancer patients with radical prostatectomy from 2006 to 2011 were collected retrospectively, including patient’s age at diagnosis, prostate-specific antigen (PSA) level at diagnosis, Gleason score, clinical stage, surgical margin, and time to biochemical recurrence or not. This study performed PTEN protein immunohistochemistry on tissue microarrays, which were made from 225 Chinese prostate cancer patients mentioned above, treated by radical prostatectomy with one
Prostate cancer; Phosphatase and tensin homolog deleted on chromosome 10; Prognosis; Biochemical recurrence; Immunohistochemistry
10.3969/j.issn.1007-3969.2015.08.006
R737.25
A
1007-3639(2015)08-0595-07
2015-03-01
2015-05-28)
王朝夫 E-mail:wangchaofu@126.com
case including 2 cancer spots and 2 adjacent normal gland spots. Correlations of PTEN loss with clinicopathological features were analyzed using χ2test. Kaplan-Meier survival model and Cox proportional hazards regression model were used to evaluate the predictive role of PTEN protein expression and patient characteristics for biochemical recurrence. Results: PTEN protein loss was observed in 15% of the patients and was associated with increased preoperative PSA levels (P=0.03) and old age (P=0.009). In univariate Kaplan–Meier analysis, the factors associated with the biochemical recurrence of prostate cancer included PSA levels (P=0.000 4), Gleason sum (P=0.019 8), and PTEN status (P=0.013 1). In multivariable Cox regression analysis, PTEN expression (HR=0.536, P=0.044), PSA levels (HR=1.879, P=0.001), and Gleason score (HR=1.361, P=0.03) were significant in predicting biochemical recurrence of prostate cancer. Conclusion: PTEN protein loss is associated with an increased risk of recurrence, independent of known clinicopathological factors.
