P38MAPK信号通路与uPA在卵巢癌细胞及组织中表达的相关性
2015-12-16邹存华宋冬冬
邹存华,王 宏,宋冬冬,南 平,盛 梅
1.胜利油田中心医院妇产科,山东 东营257000;
2.胜利油田中心医院保健科,山东 东营257000;
3.胜利油田中心医院胃肠外科,山东 东营257000
P38MAPK信号通路与uPA在卵巢癌细胞及组织中表达的相关性
邹存华1,王 宏2,宋冬冬3,南 平1,盛 梅1
1.胜利油田中心医院妇产科,山东 东营257000;
2.胜利油田中心医院保健科,山东 东营257000;
3.胜利油田中心医院胃肠外科,山东 东营257000
背景与目的:P38丝裂原活化蛋白激酶(P38 mitogen-activated protein kinase,P38MAPK)信号通路参与多种肿瘤的发生、发展和转移过程,尿激酶型纤溶酶原激活剂(urokinase-type plasminogen activator,uPA)在肿瘤浸润和转移中发挥着重要作用。本实验研究卵巢癌组织中P38MAPK、细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、丝氨酸苏氨酸蛋白激酶(serine threonine kinase,AKT)及uPA的表达与临床病理特征的关系,并分析上述蛋白与uPA表达的相关性,探讨P38MAPK信号通路与uPA在卵巢癌细胞及组织中的表达及临床意义。方法:应用免疫组织化学法检测49例卵巢癌组织中uPA、P38MAPK、ERK和AKT蛋白的表达,采用蛋白[质]印迹法(Western blot)检测不同卵巢癌细胞系HO8910、HO-8910PM、SKOV3和CAOV3中uPA和P38MAPK蛋白的表达,使用特异性抑制剂SB203580阻断P38MAPK信号通路后检测uPA蛋白表达水平的变化。结果:uPA、P38MAPK、ERK和AKT蛋白在卵巢癌组织中的表达阳性率分别为61.22%、57.14%、53.06%和55.10%。uPA蛋白的表达与P38MAPK呈正相关(r=0.865,P=0.001),且与卵巢癌组织的临床病理分期(P=0.029)、分化(P=0.03)和转移程度(P淋巴=0.022,P大网膜=0.012)有关,而与患者的年龄(P=0.754)及组织学类型(P=0.652)无关。ERK、AKT蛋白的表达与卵巢癌淋巴结转移(PERK=0.011,PAKT=0.022)和大网膜转移(PERK=0.006,PAKT=0.000)有关,而与患者的年龄(PERK=0.000,PAKT=0.022)、组织类型(PERK=0.771,PAKT=0.245)及病理分期(PERK=1.000,PAKT=0.254)无关。卵巢癌细胞系HO-8910PM中uPA蛋白的表达水平明显高于HO8910、SKOV3和CAOV3细胞系,使用SB203580阻断P38MAPK信号通路后可降低uPA蛋白的表达,且随着SB203580浓度升高uPA蛋白表达水平逐渐降低。卵巢癌中P38MAPK及uPA蛋白的表达与卵巢癌的预后显著相关(Log-rank=3.897和11.044,P=0.048和0.001)。结论:卵巢癌组织中P38MAPK信号通路处于激活状态;P38MAPK信号通路的激活可上调uPA的表达,促进卵巢癌的恶性进展;P38MAPK信号通路和uPA可能在卵巢癌侵袭和转移的过程中发挥重要作用。P38MAPK和uPA蛋白有望成为卵巢癌预后评估的重要指标。
卵巢癌;尿激酶型纤溶酶原激活剂;细胞外信号调节激酶;丝氨酸/苏氨酸蛋白激酶;P38丝裂原活化蛋白激酶信号通路
卵巢癌是妇女最常见的恶性肿瘤之一,易发生腹腔内种植转移,早期不易发现且预后差,其死亡率居妇科肿瘤之首[1]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)和磷脂酰肌醇-3-激酶/丝氨酸苏氨酸蛋白激酶(phosphatidylinositol-3-kinase/serine threonine kinase,PI3K/AKT)信号通路均是哺乳动物细胞内广泛存在的一类蛋白激酶,研究表明该类通路参与调节肿瘤细胞的增殖,其活性异常不仅能导致细胞恶性转化,而且与肿瘤细胞的迁移、黏附、肿瘤血管生成以及细胞外基质(extracellular matrix,ECM)的降解等相关,而ECM降解及基底膜的破坏是肿瘤浸润和转移的必要条件[2]。研究表明,尿激酶型纤溶酶原激活剂(urokinase-type plasminogen activator,uPA)及其受体介导的纤维蛋白溶解系统参与ECM降解,在结肠癌、乳腺癌等多种恶性肿瘤的侵袭和转移过程中发挥重要作用[3-4]。近年来研究发现多种肿瘤细胞及组织中MAPK和PI3K/AKT信号转导通路被激活[5],但具体机制尚不清楚。有关此类信号通路与uPA之间相关性方面的研究较少。本研究检测49例卵巢癌组织中P38丝裂原活化蛋白激酶(P38 mitogen-activated protein kinase,P38MAPK)、细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、AKT及uPA蛋白的表达,并进一步验证了体外培养不同卵巢癌细胞系HO8910、HO-8910PM、SKOV3和CAOV3中MAPK信号通路关键信号分子P38MAPK和uPA蛋白的表达,探讨卵巢癌细胞及组织中MAPK、PI3K/AKT信号通路与uPA蛋白的相关性。
1 材料和方法
1.1 材料
1.1.1 标本来源
收集胜利油田中心医院病理科2007年3月—2014年3月手术切除卵巢组织患者共59例,其中卵巢癌组织49例,卵巢良性肿瘤组织10例,年龄28~67岁,平均年龄42岁。所有卵巢癌患者均接受肿瘤细胞减灭术,术前均未经任何治疗,其中浆液性囊腺癌26例,黏液性囊腺癌15例,其他类型8例。手术切除标本均经10%甲醛固定,常规石蜡包埋,4 µm厚连续切片,进行链霉抗生物素蛋白-过氧化物酶
(streptavidin-peroxidase,SP)法染色。按照国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)2000年分期标准进行分期:Ⅰ~Ⅱ期19例,Ⅲ~Ⅳ期30例(表1)。
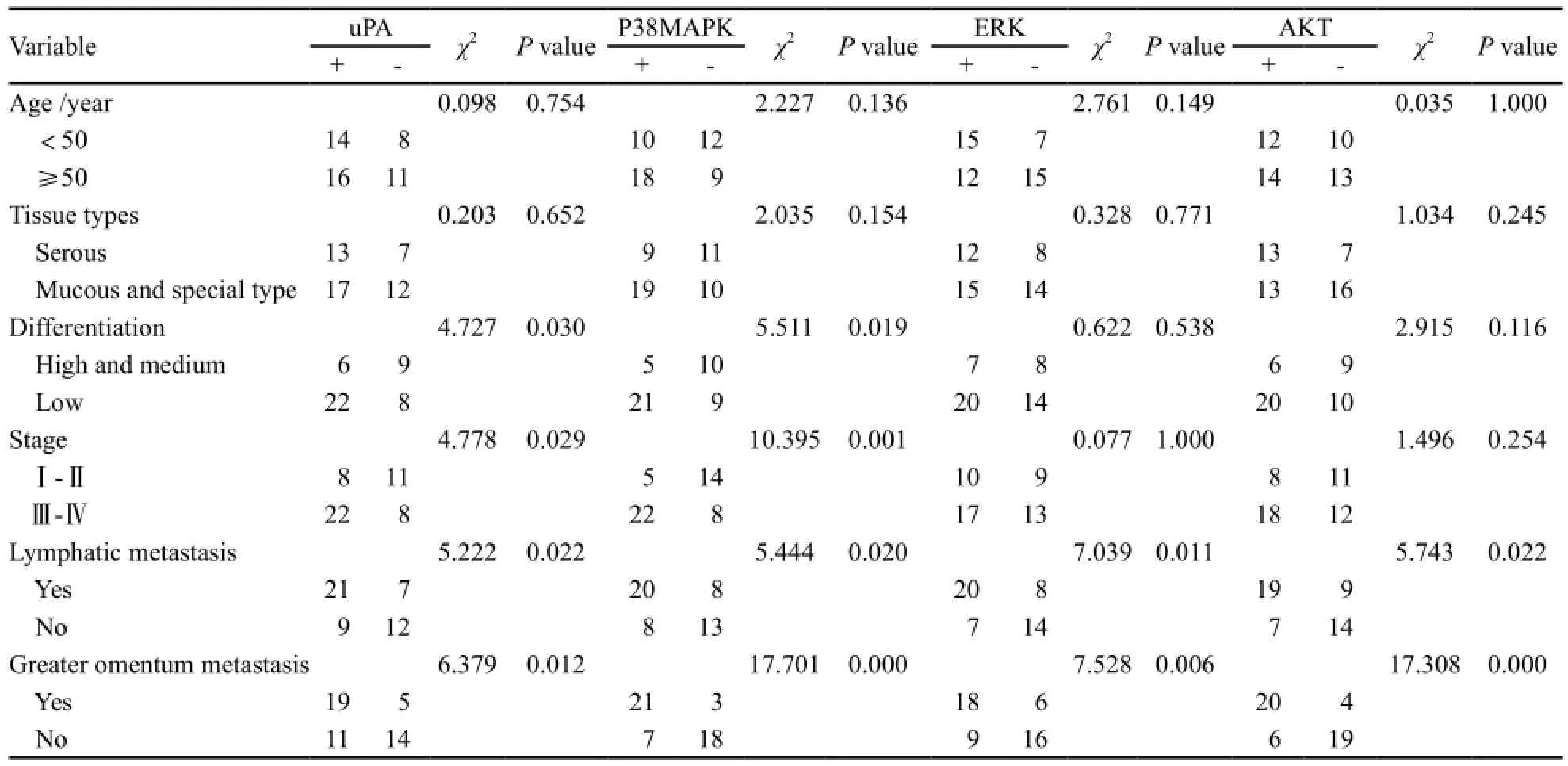
表 1 uPA和P38MAPK在卵巢癌组织中的表达与临床病理特征的关系Tab. 1 The relationship between the expressions of uPA and P38MAPK and the clinical pathological features in ovarian cancer
1.1.2 细胞系
人卵巢癌细胞系HO8910、HO-8910PM、SKOV3和CAOV3均由胜利油田中心医院实验室保存复苏,细胞分别在37 ℃、CO2体积分数为5%、含10%胎牛血清的RPMI-1640和DMEM中培养,用0.25%胰蛋白酶消化传代。
1.1.3 试剂
DMEM及RPMI-1640培养基、胎牛血清购自美国Gibco公司;鼠抗人P38MAPK、uPA、ERK和AKT单克隆抗体均购自美国Cell Signaling Technology公司;兔抗人uPA多克隆抗体购自武汉博士德公司;辣根过氧化物酶标记的羊抗兔、羊抗鼠二抗和兔抗人β-actin多克隆抗体均购自北京中杉金桥生物技术有限公司。
1.2 实验方法
1.2.1 免疫组织化学法检测卵巢癌组织中uPA、P38MAPK、ERK和AKT的表达
按照SP法试剂盒说明书步骤进行免疫组织化学染色,设立卵巢良性肿瘤组织作为对照组。切片常规脱蜡水化、抗原修复、敷一抗、显色、复染。该实验重复3遍。
1.2.2 蛋白[质]印迹法(Western blot)检测HO8910、HO-8910PM、SKOV3和CAOV3细胞系中uPA和P38MAPK蛋白的表达
培养HO8910、HO-8910PM、SKOV3和CAOV3细胞,18 911×g离心10 min提取总蛋白。用不同浓度的SB203580(0、2、5和10 µmol/L)处理上述不同细胞系24 h后,提取蛋白。标准化蛋白浓度,每孔40 µg蛋白加入10%SDS-PAGE后,半干转法将蛋白转入PDVF膜,脱脂牛奶封闭,4 ℃温育一抗过夜,室温温育二抗2 h显色。该实验重复3遍。
1.3 结果判定
根据阳性细胞的比率和染色深度分别进行评估,最后综合评定。以肿瘤细胞中出现黄色及棕黄色颗粒为阳性表达,阳性细胞数<10%为0分;阳性细胞数介于10%~25%之间为1分;阳性细胞数介于26%~50%之间为2分;阳性细胞数>50%为3分。染色深度评分:0分为无染色;1分为淡黄色;2分为黄色;3分为棕黄色。总分为阳性细胞的比率和染色深度评分之和。1~2分为弱阳性(+),3~4分为中强阳性(++),5~6分为强阳性(+++)。
1.4 统计学处理
使用SPSS 17.0应用软件处理数据。采用χ2检验、等级相关分析法和Log-rank检验比较分析。P<0.05为差异有统计学意义。
2 结 果
2.1 uPA、P38MAPK、AKT和ERK在卵巢癌组织中的表达及相关性分析
免疫组织化学法检测结果显示:uPA蛋白主要位于卵巢癌细胞质中,呈棕黄色颗粒,阳性率为61.22%;P38MAPK蛋白主要位于卵巢癌细胞核内,呈棕黄色颗粒,阳性率为57.14%;AKT和ERK蛋白表达主要位于卵巢癌组织的细胞质中,部分位于细胞核,其阳性率表达分别为53.06%和55.10%。等级相关分析结果显示,卵巢癌组织中uPA与P38MAPK蛋白表达呈正相关(r=0.865,P=0.001),而与AKT和ERK蛋白表达无明显相关性(r=0.083和0.174,P=0.560和0.257,图1,表1、2)。
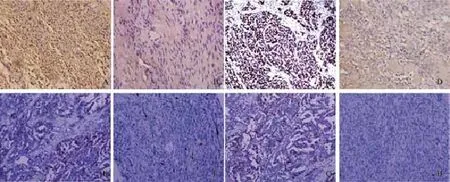
图 1 uPA、P38MAPK、AKT和ERK在卵巢癌及卵巢良性肿瘤中的表达Fig. 1 The expressions of uPA, P38MAPK, AKT and ERK in ovarian cancer and ovarian benign tumor
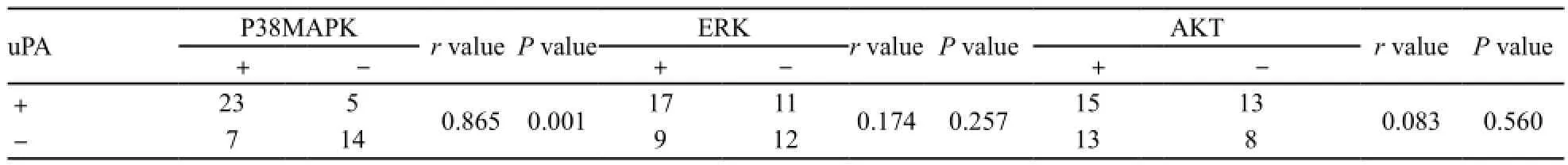
表 2 卵巢癌组织中uPA与P38MAPK、ERK、AKT之间的相关性Tab. 2 The correlation of uPA with P38MAPK, ERK and AKT in ovarian cancer
2.2 uPA、P38MAPK、ERK和AKT蛋白表达与患者临床病理特征的关系
uPA和P38MAPK蛋白的表达与卵巢癌组织的临床分期(χ2=4.778,P=0.029)、分化程度(χ2=4.727,P=0.030)和转移程度(χ2=5.222和6.379,P=0.022和0.030)有关,而与患者的年龄(χ2=0.098,P=0.754)及组织学类型(χ2=0.203,P=0.652)无关。ERK和AKT蛋白表达与卵巢癌淋巴结转移(χ2=7.039和5.743,P=0.010和0.022)和大网膜转移(χ2=7.528和17.308,P=0.006和0.000)有关,而与患者的年龄(χ2=2.761和0.035,P=0.149和1.000)、组织类型(χ2=0.328和1.034,P=0.771和0.245)、分化程度(χ2=0.622和2.915,P=0.538和0.116)及临床分期(χ2=0.077和1.000,P=1.496和0.254)无关(表1)。
2.3 转移性不同的卵巢癌细胞系中uPA和P38MAPK蛋白表达
Western blot检测结果显示,高转移性HO-8910PM细胞中P38MAPK和uPA蛋白表达明显高于HO8910、SKOV3和CAOV3细胞系(图2)。
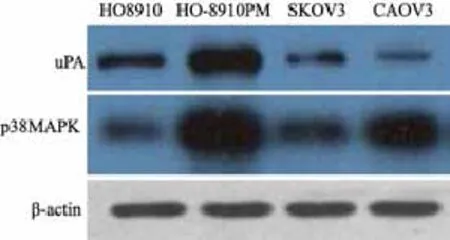
图 2 不同卵巢癌细胞系中uPA和P38MAPK蛋白表达Fig. 2 The expressions of uPA and P38MAPK in different ovarian cancer cell lines
2.4 SB203580阻断P38MAPK信号通路后卵巢癌细胞系HO8910、HO-8910PM、SKOV3和CAOV3中uPA蛋白表达水平的变化
用不同浓度的SB203580(0、2、5和10 µmol/L)处理细胞24 h,Western blot检测结果显示,不同卵巢癌细胞系中uPA蛋白表达水平均明显下降,且表达水平随着SB203580浓度升高而下降(图3)。
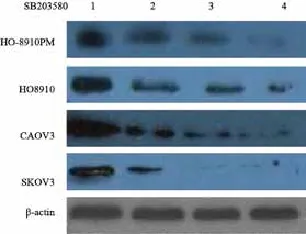
图 3 SB203580处理不同卵巢癌细胞系24 h后uPA蛋白的表达变化Fig. 3 Changes of the expression of uPA following SB203580 treatment for 24 h in different ovarian cancer cell lines
2.5 P38MAPK和uPA蛋白表达与卵巢癌预后的关系
对49例卵巢癌患者进行36~60个月的跟踪随访,30例uPA阳性者死亡率为63.33%,19例uPA阴性者死亡率为36.84%;28例P38MAPK蛋白表达阳性者死亡率为60.71%,21例P38MAPK蛋白表达阴性者死亡率为42.86%。绘制Kaplan-Meier生存曲线并进行Log-rank检验,结果表明uPA和P38MAPK蛋白表达与术后生存率呈负相关(Log-rank=3.897和11.044,P=0.048和0.001,图4、5)。
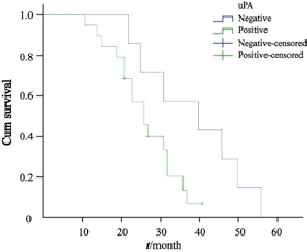
图 4 uPA表达与患者术后生存率的关系Fig. 4 The relationship between the expression of uPA and postoperative survival rate of ovarian cancer patients
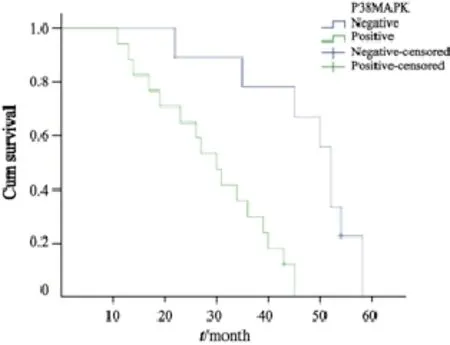
图 5 P38MAPK表达与患者术后生存率的关系Fig. 5 The relationship between the expression of P38MAPK and postoperative survival rate of ovarian cancer patients
3 讨 论
由于卵巢癌组织学复杂、缺乏特异性症状和有效的早期诊断手段,所以,卵巢癌极易发生扩散和转移[1]。在卵巢癌细胞浸润转移过程中,ECM及基底膜成分被相关蛋白酶降解。uPA是一种丝氨酸蛋白水解酶,主要通过与uPAR结合发挥作用,参与生理、病理条件下细胞分化、迁移、组织重建、细胞周围基质降解及刺激血管形成等过程[6]。目前公认的观点是:纤溶酶具有降解不同肿瘤ECM及基底膜的功能,使胶原蛋白酶原激活成胶原蛋白酶,将基底膜中的主要成分胶原纤维水解,使细胞脱离原来位置向其他部位迁移;纤溶酶可激活前基质金属蛋白酶-3,从而激活前基质金属蛋白酶-9以及胶原的降解;另外,纤溶酶还可以通过增加血管内皮生长因子(vascular endothelial growth factor,VEGF)的活性刺激血管生成[7]。uPA在不同乳腺癌组织中均有表达。Andres等[8]研究表明,乳腺癌组织中uPA的水平明显高于正常乳腺组织,提示uPA有望成为提示乳腺癌早期浸润的新指标。Ding等[9]研究结果表明,胃肠道肿瘤组织中uPA的表达明显升高,且与组织的分化程度有关,分化程度越低其表达水平越高,提示uPA可预示潜在的肿瘤侵袭。本研究检测了49例卵巢癌组织中uPA表达水平,结果显示,uPA在卵巢癌组织中高表达,且在有淋巴结、大网膜转移的组织中其表达量明显高于其他卵巢组织。这与目前大多数研究结果相一致,提示uPA所激活的纤溶系统在卵巢癌发生、发展过程中起重要作用。
生长因子的细胞内信号转导通路与肿瘤发生、发展及转移密切相关。MAPK和PI3K/AKT信号通路与细胞增殖和凋亡密切相关[2],是近年来生物学研究的热点。目前,MAPK信号通路主要有3种途径:ERK通路、C-JunN2末端激酶(JUK)通路和P38通路。目前研究已经证实了JUK信号通路主要在应急反应中起到重要作用,并被多种细胞外应急信号激活,因此又被称为应急活化蛋白激酶。而PI3K/AKT通路、P38通路和ERK通路主要参与调节肿瘤细胞的增殖、转移、黏附、肿瘤血管生成和细胞外基质的降解等过程[5]。大量研究证实,PI3K/ AKT信号通路与子宫内膜癌和前列腺癌等肿瘤的发生、发展密切相关[10-11]。有研究证实,乳腺癌组织中P38MAPK信号通路被激活,其关键蛋白P38MAPK表达明显升高[12]。Chou等[13]的研究结果表明,P38MAPK信号通路参与uPA的表达调控,通过调控uPA的表达抑制宫颈癌细胞的增殖和迁移。但有关uPA蛋白与MAPK信号通路和PI3K/AKT信号通路相关性方面的研究报道较少,本研究采用免疫组化技术检测了49例卵巢癌细胞中uPA与两条信号通路中关键分子P38MAPK、ERK及AKT蛋白的表达水平。统计学分析结果显示,uPA与P38MAPK的表达呈正相关,且与卵巢癌组织的临床病理分期、分化程度和转移程度有关,推测uPA和P38MAPK的表达可能与卵巢癌的恶性进展、侵袭转移有关。卵巢癌组织中P38MAPK信号通路可能参与uPA的表达调控,通过降解ECM参与肿瘤细胞的侵袭和转移。本研究又同时检测了AKT和ERK两种信号分子的表达,结果显示三者之间无明显相关性,提示PI3K/AKT和MAPK/ ERK信号通路并不参与uPA蛋白表达的调控。
为进一步验证P38MAPK信号通路参与uPA的表达调控,本研究采用体外培养不同转移能力的卵巢癌细胞系,并用Western blot检测HO8910、HO-8910PM、SKOV3、CAOV3细胞系及P38MAPK信号通路特异性阻断剂SB203580作用后uPA蛋白的表达。结果显示,SB203580以浓度依赖的方式降低不同卵巢癌细胞系中uPA蛋白的表达,证明卵巢癌细胞中P38MAPK信号通路可能参与调控uPA蛋白表达。Wang等[14]的研究证实了uPA基因启动子区有AP-1、SP-1和ETS等转录因子结合位点,P38MAPK信号通路活化后可磷酸化增强多种转录因子(ATF-2、ETS及NF-kB等)活性,而ATF-2可激活AP-1。推测P38 MAPK信号通路可能通过活化转录因子AP-1和
ETS引起uPA基因转录增强,uPA蛋白表达量增加,从而促进卵巢癌的侵袭和转移。
众所周知,卵巢癌预后差,死亡率约30%,在妇科死亡原因中居首位。约70%卵巢癌患者发现时已属晚期,卵巢癌的早期诊断与早期治疗是改善预后的关键,所以寻找有实用价值的肿瘤标志物成了近年来的重要课题。本研究通过跟踪随访49例患者预后发现,uPA和P38MAPK蛋白与术后生存率呈负相关,提示uPA和P38MAPK蛋白表达与卵巢癌预后密切相关。
综上所述,P38MAPK信号通路可能通过上调uPA的表达,促进卵巢癌细胞的恶性进展、侵袭和转移,但其具体作用位点尚不清楚。目前研究如何抑制MAPK信号通路的转导成为肿瘤治疗的新靶点。uPA和P38MAPK有望为卵巢癌早期诊断和预后评估提供依据,而且可能为肿瘤治疗开辟一条新途径。
[1] 刘 杨, 杨 恭, 臧荣余, 等. Notch3信号通路与卵巢癌发生发展关系的研究[J]. 中国癌症杂志, 2013, 23(12): 1001-1006.
[2] 刘 斌, 匡安仁. MAPK/ERK和PI3K/Akt信号通道的基因变异与甲状腺癌的发生发展及诊治[J]. 生物医学工程学杂志, 2012, 29(6): 1221-1225.
[3] 冯 波, 熊观瀛, 王 芸, 等. 结肠癌组织中maspin及uPA基因的表达与临床意义[J]. 中国临床研究, 2011, 24(10): 874-876.
[4] 董 欢, 林燕苹, 应学翔, 等. 乳腺癌组织中uPA和PA-1的表达及其临床意义[J]. 肿瘤, 2013, 33(4): 361-367.
[5] 崔婷婷, 席淑华. MAPK信号转导通路与肿瘤的发生[J].实用肿瘤杂志, 2013, 28(5): 550-552.
[6] 覃 捷, 李 力, 张洁清, 等. 尿激酶型纤溶酶原激活因子介导的卵巢上皮癌细胞浸润转移体外的实验研究[J].现代妇产科进展, 2009, 18(8): 588-593.
[7] UHRIN P, BREUSS J M. uPAR: a modulator of VEGF-induced angiogenesis[J]. Cell Adh Migr, 2013, 7(1): 23-26.
[8] ANDRES S A, EDWARDS A B, WITTLIFF J L. Expression of urokinase-type plasminogen activator (uPA), its receptor (uPAR), and inhibitor (PAI-1) in human breast carcinomas and their clinical relevance[J]. J Clin Lab Anal, 2012, 26(2): 93-103.
[9] DING Y, ZHANG H, ZHANG M, et al. Clinical significance of the uPA system in gastric cancer with peritoneal metastasis[J]. Eur J Med Res, 2013, 18(1): 28.
[10] 陆媛媛, 张洁清, 梁少凤, 等. 雌激素通过激活AKT通路产生的细胞因子增强子宫内膜癌细胞增殖能力[J]. 中国癌症杂志, 2013, 23(11): 868-873.
[11] 于殿君, 孙晓文, 施云峰, 等. 前列腺癌雄激素受体和PI3K/ Akt信号通路相互作用研究进展[J]. 现代生物医学进展, 2011, 11(1): 180-183.
[12] YONG H Y, KIMI Y, KIM J S, et al. ErbB2-enhanced invasiveness of H-Ras MCF10A breast cells requires MMP-13 and uPA upregulation via p38 MAPK signaling[J]. Int J Oncol, 2010, 36(2): 501-507.
[13] CHOU R H, HSIEH S C, YU Y L, et al. Fisetin inhibits migration and invasion of human cervical cancer cells by down-regulating urokinase plasminogen activator expression through suppressing the p38 MAPK-dependent NF-κB signaling pathway[J]. PLoS One, 2013, 8(8): e71983.
[14] WANG R, LI Z Q, HAN X, et al. Integrin β3 and its ligand regulate the expression of uPA through p38 MAPK in breast cancer[J]. APMIS, 2010, 118(12): 909-917.
Correlation between P38 mitogen-activated protein kinase signal transduction pathway and uPA expression in ovarian cancer
ZOU Cunhua1, WANG Hong2, SONG Dongdong3, NAN Ping1, SHENG
Mei1(1.Department of Gynecology and Obstetrics, Shengli Oilfield Central Hospital, Dongying Shandong 257000, China; 2.Department of Health Division, Shengli Oilfield Central Hospital, Dongying Shandong 257000, China; 3.Department of Gastrointestinal Surgery, Shengli Oilfield Central Hospital, Dongying Shandong 257000, China)
SHENG Mei E-mail: shengmei1967@163.com
Background and purpose: P38 mitogen-activated protein kinase (P38MAPK) signal transduction pathway is involved in occurrence, development and transfer process in a wide variety of tumors. Urokinase-type plasminogen activator (uPA) plays an important role in tumor invasion and metastasis. This study aimed to explore
Ovarian cancer; Urokinase-type plasminogen activator; Extracellular signal-regulated kinase; Serine threonine kinase; P38 mitogen-activated protein kinase signal transduction pathway
10.3969/j.issn.1007-3969.2015.08.003
R737.31
A
1007-3639(2015)08-0572-07
2014-04-29
2014-07-05)
国家自然科学基金资助项目(30970651);国家重点实验室基金资助项目(SKLZZ200907)。
盛梅 E-mail:shengmei1967@163.com
the clinical significance of the P38MAPK signaling pathway and the expression of uPA in ovarian cancer. Methods: The expressions of uPA, P38MAPK, ERK and AKT were detected in 49 cases of cervical adenocarcinoma by immunohistochemistry. The expressions of uPA and P38MAPK were detected by Western blot in ovarian cancer cell lines HO8910, HO-8910PM, SKOV3 and CAOV3. The changes of uPA and P38MAPK were detected by SB203580, a specific inhibitor of P38MAPK signal transduction pathway. Results: The result of immunohistochemical method showed that positive expression rates for uPA, P38MAPK, ERK and AKT were 61.22%, 57.14%, 53.06% and 55.10%, respectively. The expression of the uPA was positively correlated with the P38MAPK (r=0.865, P=0.001), and related with clinicopathologic stage, differentiated degree, lymph node metastasis, but not related with age and histologic type (P>0.05). The expressions of AKT and ERK were related with the lymph node metastasis and greater omentum metastasis (P<0.05), but not related with age and histologic type (P>0.05). The expression of uPA in HO-8910PM was higher than that in ovarian cancer cell lines HO8910, SKOV3 and CAOV3, and the expression of uPA reduced when the P38MAPK signal transduction pathway was cut off by the SB203580. The expressions of P38MAPK and uPA were negatively correlated with the prognosis of ovarian cancer (Log-rank=3.897 and 11.044, P=0.048 and 0.001). Conclusion: The P38MAPK signal transduction pathway was activated in ovarian cancer. The activated P38MAPK signal transduction pathway can raise the expression of uPA, which may contribute to the development of ovarian cancer. The result indicates that the P38MAPK signal transduction pathway and uPA might play an important role in the invasion and metastasis of ovarian cancer. P38MAPK and uPA might be useful markers for evaluating prognosis of ovarian cancer.
