维甲酸诱导基因G慢病毒表达载体的构建及对肺癌细胞A549的影响
2015-12-16吴军录权文强姚懿雯万海英
吴军录,权文强,姚懿雯,万海英,李 冬
同济大学附属同济医院检验科,上海 200065
维甲酸诱导基因G慢病毒表达载体的构建及对肺癌细胞A549的影响
吴军录,权文强,姚懿雯,万海英,李 冬
同济大学附属同济医院检验科,上海 200065
背景与目的:维甲酸诱导基因G(retinoic acid-induced gene G,RIG-G)是从急性早幼粒细胞性白血病细胞系NB4细胞中克隆出的肿瘤抑制基因。我们通过调控基因(Tet-on)系统构建受强力霉素(doxycycline,DOX)诱导RIG-G基因表达的A549细胞系,并观察其对A549细胞增殖的作用。方法:采用实时定量PCR(quantitative real-time PCR,qRT-PCR)技术扩增RIG-G基因片段,利用LR重组系统构建pLenti6/TO/V5-GIM-RIG-G慢病毒载体,对该慢病毒载体和Tet-on慢病毒载体包装和病毒滴度测定后,感染A549细胞;采用有限稀释法筛选稳定株;使用细胞免疫荧光和蛋白[质]印迹法(Western blot)鉴定RIG-G基因受DOX调控表达的效果;CCK-8试验检测细胞增殖能力。结果:成功构建pLenti6/TO/V5-GIM-RIG-G慢病毒载体,包装后测得其活性滴度为1.0×108TU/mL;慢病毒经Tet-on包装后物理滴度为4×109VP/mL;RIG-G蛋白成功地在慢病毒感染后的A549稳定株中合成和表达,并且受DOX的诱导调控。RIG-G蛋白表达成功后,A549细胞的增殖与对照组相比显著降低(1.168±0.107 vs 2.099±0.162,P<0.05)。结论:本研究成功建立了RIG-G基因可调控表达的A549稳定株;RIG-G蛋白对A549的增殖有抑制作用。
维甲酸诱导基因G;慢病毒;表达调控;细胞增殖
维甲酸诱导基因G(retinoic acid-induced gene G,RIG-G)是从急性早幼粒细胞性白血病细胞系NB4细胞中克隆到的一个可以被维甲酸诱导表达的基因,位于10号染色体q24上,编码一个含490个氨基酸残基的蛋白质[1-3]。RIG-G是一个重要的肿瘤抑制基因,能通过上调细胞周期抑制因子p21和p27抑制白血病细胞增殖和促进细胞分化[4],然而,RIG-G抑制肿瘤细胞增殖的具体机制及其在实体肿瘤细胞中是否同样具有肿瘤抑制功能仍不清楚。近年来,利用慢病毒构建稳定转染细胞的研究有很多,但同时利用调控基因(Tet-on)、报告基因(GFP)[5]和目的基因构建细胞系的研究还不多见。本研究采用Tet-on表达系统,利用慢病毒载体介导RIG-G基因转染肺癌细胞系A549细胞,建立可调控表达RIG-G蛋白的稳定株,观察RIG-G蛋白在肺癌细胞A549中的表达及生物学作用。
1 材料和方法
1.1 质粒
pTRE-Tight-RIG-G由上海血液学研究所馈赠;pLenti6/TO/V5-DEST、荧光质粒pENTRGFP-IRES-MCS(pENTR-GIM)、四环素基因调控系统Tet-on(pLenti3.3/TR)、包装质粒Packaging Mix和标准质粒pLenti6.3-MCS-IRES2-EGFP均购自美国Invitrogen公司。
1.2 细胞
人肺癌细胞系A549和人胚肾细胞系293T购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库,用DMEM(含10%的胎牛血清)置于37 ℃、CO2体积分数为5%、饱和湿度的培养箱中培养。
1.3 主要试剂和酶
兔源性RIG-G抗体由上海血液学研究所馈赠;鼠源性β-actin购自美国Santa Cruz公司;G418、胎牛血清(FBS)、DMEM和胰酶购自美国Gibco公司;LR重组系统(LR clonase Ⅱ)、Blasticidin S HCL和转染试剂LipofectamineTM2000购自美国Invitrogen公司;强力霉素(doxycycline,DOX)购自美国Sigma公司;BamHⅠ和SgsⅠ购自加拿大Fermentas公司;细胞增殖和毒性检测试剂盒(CCK-8)购自南京凯基生物科技发展有限公司。
1.4 构建质粒pENTR-GIM-RIG-G[6]
设计5’端和3’端带BamHⅠ、SgsⅠ内切酶的引物,根据质粒pTRE-Tight-RIG-G中RIG-G基因的cDNA序列,以5’-ATAAGGATCC GCCGCCACCATGGACTACAAAGACGAT GAC-3’为正向引物,5’-TTATGGCGCGCC TCAGTTCAGTTGCTCTGAGTTAG-3’为反向引物扩增RIG-G基因,实时定量PCR(quantitative real-time PCR,qRT-PCR)产物及pENTR-GIM质粒均用BamHⅠ和SgsⅠ双酶切,用T4连接酶构建成质粒pENTR-GIM-RIG-G。
1.5 构建慢病毒载体质粒pLenti6/TO/V5-GIM-RIG-G[7]
使用Invitrogen公司的LR重组系统,将构建成功的pENTR-GIM-RIG-G载体质粒重组至慢病毒载体pLenti6/TO/V5-DEST载体上,筛选阳性克隆并测序,保留测序正确的重组质粒。
1.6 慢病毒包装及病毒滴度测定
转染前1 d,将处于对数生长期的293T细胞在每个10 cm的培养皿中接种6×106个细胞,在37 ℃、CO2体积分数为5%的培养箱中培养过夜,转染前细胞密度为70%~80%,用LipofectamineTM2000转染试剂将慢病毒载体与包装质粒Packaging Mix共转到293T细胞中,48 h后收集病毒上清液,600×g离心10 min,用0.45 μm的滤器过滤后,在4 ℃下,50 000×g离心2 h沉淀病毒颗粒,弃上清液,重悬于500 μL的DMEM中,分装置于-80 ℃环境中保存备用。pLenti6/TO/V5-GIM-RIG-G慢病毒活性滴度测定采用逐孔稀释滴度法[8];Tet-on慢病毒物理滴度测定采用qRT-PCR[9]。
1.7 构建稳定株A549-Tet-on-GIM-RIG-G
用Tet-on慢病毒液感染A549细胞,G418(800 μg/mL)筛选至阴性对照孔细胞全部死亡,扩增感染成功的细胞(A549-Tet-on);再用pLenti6/TO/V5-GIM-RIG-G慢病毒液感染A549-Tet-on细胞,加Blasticidin S HCL(4 μg/mL)筛
选,稳定株(A549-Tet-on-GIM-RIG-G)长出后,采用有限稀释法挑选单克隆细胞。
1.8 通过蛋白[质]印迹法(Western blot)检测RIG-G蛋白的表达[10]
通过在培养液中加入DOX(2 μg/mL)调控RIG-G基因表达,在显微镜下观察RIG-G基因荧光表达,采用Western blot检测RIG-G蛋白表达。用空载体pLenti6/TO/V5-GIM质粒感染A549-Tet-on细胞,得到稳定转染细胞系A549-Tet-on-GIM作阴性对照。
1.9 CCK-8检测RIG-G对A549细胞的作用
取对数生长期细胞,以5×103个/孔接种于96孔板中。实验分为空白对照组、阴性对照组及实验组,其中实验组分为A549-Teton-GIM(±DOX)组和A549-Tet-on-GIM-RIGG(±DOX)组。每组设3个复孔。共接种6块板,将其置于37 ℃、CO2体积分数为5%的细胞培养箱中培养1~6 d,每隔24 h取出1块板,每孔加10 μL的CCK-8溶液,相同条件下温育2 h,于450 nm处检测各孔的吸光度(D)值。D值大小反应细胞增殖程度。
1.10 统计学处理
实验数据采用GraphPad Prism 5统计学软件进行分析,以表示。组间比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 慢病毒载体pLenti6/TO/V5-GIM-RIG-G的鉴定
根据质粒pTRE-Tight-RIG-G中RIG-G基因的cDNA序列设计带BamHⅠ、SgsⅠ内切酶的引物,经qRT-PCR扩增,产物用BamHⅠ和SgsⅠ酶切,连接到pENTR-GIM载体中,将连接好的质粒pENTR-GIM-RIG-G重组到pLenti6/TO/ V5-DEST载体上,得到重组慢病毒载体pLenti6/ TO/V5-GIM-RIG-G,再经BamHⅠ和SgsⅠ双酶切,1.5%琼脂糖电泳鉴定正确,可见一条特异性条带,与理论值1 620 bp相符(图1),测序结果证明RIG-G基因序列正确,无明显缺失或突变(图2)。
2.2 慢病毒载体的滴度测定
将纯化过的pLenti6/TO/V5-GIM-RIG-G病毒液稀释感染已接种的293T细胞,转染24 h后,在荧光显微镜下观察可见大量绿色荧光(图3),提示转染成功;第5天,根据各孔中荧光细胞数量计算出pLenti6/TO/V5-GIM-RIG-G慢病毒活性滴度为1.0×108TU/mL(图4)。将标准质粒pLenti6.3-MCS-IRES2-EGFP梯度稀释,计算标准品的拷贝数,建标准曲线,经qRT-PCR扩增慢病毒样品计算出Tet-on慢病毒物理滴度为4×109VP/mL (表1、2)。
2.3 DOX对稳定株中RIG-G基因的表达调控功能
用细胞免疫荧光和Western blot对稳定株的RIG-G基因表达情况进行检测。结果显示,当培养液中不加DOX时,稳定株中的RIG-G基因的表达呈阴性;当培养液中加入DOX后,RIG-G基因的表达显著上升,而含空载体的A549-Tet-on-GIM细胞中RIG-G基因表达始终呈阴性(图5~7)。结果表明,已成功构建了过表达RIG-G基因的细胞模型,并且可以通过DOX调控RIG-G基因的表达。
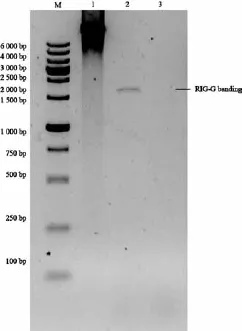
图 1 重组慢病毒载体经双酶切后经琼脂糖凝胶电泳分析结果Fig. 1 Results of agarose gel electrophoresis analysis of recombinant lentiviral vectors by double enzyme digestion M: Marker; 1: PLenti6/TO/V5-GIM-RIG-G vector; 2: RIG-G fragment; 3: Negative control.

图 2 重组慢病毒载体经双酶切后RIG-G基因测序结果(部分) Fig. 2 RIG-G gene sequencing result of recombinant lentiviral vectors by double enzyme digestion (section)
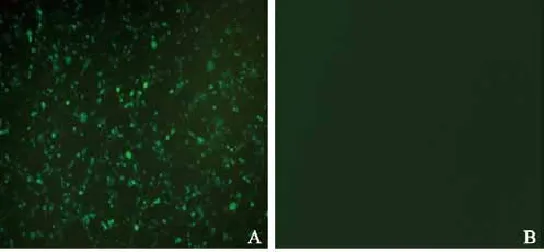
图 3 荧光显微镜下观察pLenti6/TO/V5-GIM-RIG-G病毒液感染293T细胞24 h后的情况Fig. 3 293T cells infected by pLenti6/TO/V5-GIM-RIG-G virus for 24 h was observed under a fluorescence microscope (×100)
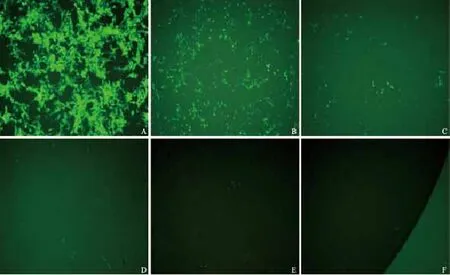
图 4 荧光显微镜观察pLenti6/TO/V5-GIM-RIG-G慢病毒不同滴度下对293T细胞的感染效率Fig. 4 Infection efficiency of different titer lentiviral vector pLenti6/TO/V5-GIM-RIG-G in 293T cells was examined under a fluorescence microscope
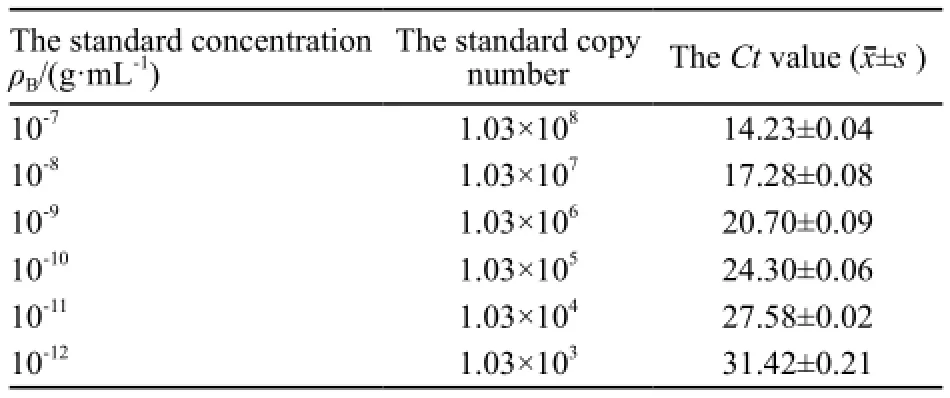
表 1 标准品参数值Tab. 1 Parameters of standard

表 2 Tet-on慢病毒样品扩增参数值Tab. 2 Amplification parameters of Tet-on lentiviral samples
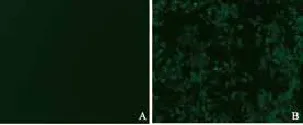
图 5 荧光显微镜下观察稳定株的RIG-G基因表达情况Fig. 5 The RIG-G gene expressions of stable cells were observed under a fluorescence microscope (×100)
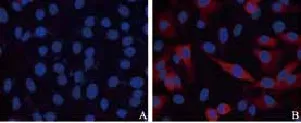
图 6 免疫荧光检测稳定株的RIG-G蛋白表达情况Fig. 6 Expressions of RIG-G protein in stable cells were assayed by immune fluorescence staining (×400)
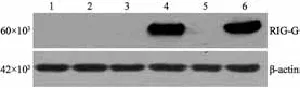
图 7 Western blot检测A549-Tet-on-GIM和A549-Tet-on-GIM-RIG-G细胞RIG-G蛋白表达情况Fig. 7 Expressions of RIG-G protein in A549-Tet-on-GIM and A549-Tet-on-GIM-RIG-G cells were examined by Western blot analysis
2.4 RIG-G蛋白对A549细胞增值活性的影响
CCK-8实验发现,RIG-G蛋白表达明显抑制稳定株的生长(图8)。第6天,A549-Tet-on-GIMRIG-G细胞的CCK-8的D值与对照组相比,差异有统计学意义(1.168±0.107 vs 2.099±0.162,P<0.05),而其他3组与对照组相比,差异无统计学意义(P>0.05)。结果表明,RIG-G蛋白表达具有抑制细胞增殖的能力。
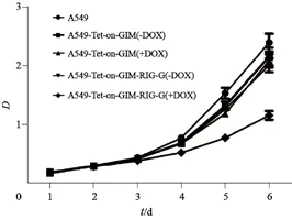
图 8 CCK-8检测A549-Tet-on-GIM和A549-Tet-on-GIMRIG-G细胞的增殖情况Fig. 8 Cell proliferations of A549-Tet-on-GIM and A549-Tet-on-GIM-RIG-G cells were detected by CCK-8 analysis
3 讨 论
目前,临床对肺癌的主要治疗手段是手术并辅以放疗和化疗,虽然有一定成效,但肺癌
的不良预后尚未得到根本改观,5年生存率只有18%[11]。本研究发现,转染RIG-G基因后,肺癌细胞A549的增殖显著减慢。设想如果将RIG-G基因转入肺癌患者的肿瘤细胞中,细胞的生长受到抑制将导致肿瘤的消亡。特别是在肺癌患者手术后转入RIG-G基因用以清除手术残留的肿瘤细胞,则将进一步降低肺癌的复发率,提高患者的生存率。本实验构建的肺癌细胞系同时含有调控基因(Tet-on)、报告基因(GFP)和目的基因(RIG-G),其特点为含有绿色荧光蛋白的基因,翻译出来的绿色荧光蛋白和RIG-G蛋白不是融合蛋白,其各具独立空间结构和生理活性,互不干扰,并方便RIG-G基因的表达、鉴定及定位追踪。同时又选用Tet-on表达调控系统通过DOX来人为控制开启或关闭RIG-G基因的表达,为临床进行肺癌的基因治疗提供了便利和安全的控制手段。
本实验构建pLenti6/TO/V5-GIM-RIG-G慢病毒载体,目的是为研究RIG-G基因在实体肿瘤中的作用提供基础。Western blot检测结果显示,构建的稳定细胞株A549-Tet-on-GIM-RIG-G能够在DOX的调控下开启和关闭RIG-G基因的表达;细胞免疫荧光检测结果显示,RIG-G蛋白在细胞质中高表达,且具有低本底、高诱导表达的特征;CCK-8实验证明,RIG-G蛋白表达后,A549细胞的增殖与对照组相比显著降低(1.168±0.107 vs 2.099±0.162,P<0.05)。上述结果与文献报道的RIG-G蛋白具有抑制白血病细胞增殖的作用相一致[4],说明RIG-G蛋白对实体肿瘤细胞也具有抑制功能。
本研究前期也构建了慢病毒Tet-off表达系统,建立了A549细胞模型,发现该模型RIG-G蛋白的表达量也较高,但是加入DOX后并不能完全关闭RIG-G蛋白的表达。RIG-G蛋白的表达量一直较高,可能Tet-off表达系统具有一定的细胞特异性所致。本研究选用的Tet-on表达系统显示出DOX调控RIG-G蛋白表达的能力更强、本底低和开关灵敏等特点,并且Tet-on表达系统仅在需要RIG-G蛋白表达时使用诱导药物DOX,这样既节省费用,又方便今后基础研究和临床治疗应用的操作。但是,由于DOX本身对细胞生长有一定的抑制作用,因此,建议在进一步深入研究RIG-G基因功能的基础上设立阴性对照。
[1] 李 冬, 楼叶江, 肖 澍, 等. 维甲酸诱导基因G抑制肿瘤细胞增殖的分子机制研究 [J]. 中华医学杂志, 2008, 88(2): 110-113.
[2] LOU Y J, PAN X R, JIA P M, et al. IRF-9/STAT2 functional interaction drives retinoic acid-induced gene G expression independently of STAT1 [J]. Cancer Res, 2009, 69(8): 3673-3680.
[3] 肖 澍, 贾培敏, 宋满根, 等. 利用稳定转染细胞模型研究RIG-G基因的生物学功能 [J]. 中华血液学杂志, 2007, 12, 28(12): 275-279.
[4] XIAO S,LI D, ZHU H Q, et al. RIG-G as a key mediator of the antiproliferative activity of interferon-related pathways through enhancing p21 and p27 protein [J]. Proc Natl Acad Sci USA, 2006, 103(44): 16448-16453.
[5] MARCH J C, RAO G, BENTLEY W E. Biotechnological applications of green fluorescent protein [J]. Appl Microbiol Biotechnol, 2003, 62(4): 303-315.
[6] 陈建勇, 罗 斌, 郭晓白, 等. 双自杀基因与靶向干扰信号转导和转录激活因子3基因联合抑制结肠癌细胞的增殖[J]. 中华肿瘤杂志, 2011, 33(2): 91-96.
[7] 侯 军, 陈 洁, 陈萍萍, 等. 慢病毒载体介导的自杀基因系统YCD/5-FC对人急性淋巴细胞白血病Jurkat细胞杀伤效应的研究 [J]. 中国癌症杂志, 2011, 21(1): 30-35.
[8] 刘晓军, 王 娜, 姚旭东, 等. 前列腺特异抗原3慢病毒表达载体的构建与包装[J]. 中国癌症杂志, 2013, 23(11): 854-862.
[9] 张 阳, 张志坚, 杨光华, 等. 新型Tet-On系统大鼠GDNF和TH双基因的慢病毒载体的构建与表达 [J]. 中国药理学通报, 2010, 26(8): 1079-1084.
[10] 王 刚, 张凯伦, 蒋雄刚, 等. 人血管内皮细胞生长因子165真核表达载体的构建及其对血管内皮细胞增殖的影响 [J]. 中华实验外科杂志, 2011, 28(4): 499-502.
[11] SIEGEL R, MA J, ZOU Z, et al. Cancer statistics [J]. CA Cancer J Clin, 2014, 64(1): 9-29.
Construction of recombinant lentivirus vector containing retinoic acid-induced gene G and its effect
on human lung cancer A549 cell line
WU Junlu, QUAN Wenqiang, YAO Yiwen, WAN Haiying, LI Dong
(Department of Clinical Laboratory, Tongji Hosptial, Tongji University, Shanghai 200065, China)
LI Dong E-mail: 186ld@163.com
Background and purpose: Retinoic acid-induced gene G (RIG-G) is a tumor suppressor gene which is cloned by NB4 cell line from a acute promyelocytic leukemia cell. This study aimed to investigate the effect of RIG-G in lung cancer cells A549 by constructing a lentiviral vector expressing RIG-G under doxycycline (DOX) regulation. Methods: RIG-G gene amplification was performed by quantitative real-time PCR (qRT-PCR). pLenti6/ TO/V5-GIM-RIG-G lentiviral vector with GFP was built by LR recombination system. The concentration of pLenti6/ TO/V5-GIM-RIG-G lentiviral vector and Tet-on lentiviral vector were measured by virus titer method. After infecting A549 cells, stably transfected lines were selected via limiting dilution analysis. RIG-G gene expression was examined by immunofluorescence staining and Western blot assay. Cellular proliferation was determined by CCK-8 assay. Results: The concentrations of pLenti6/TO/V5-GIM-RIG-G lentiviral vector and Tet-on lentiviral vector were 1.0×108TU/mL and 4×109VP/mL, respectively. RIG-G was expressed in lentivirus infected A549 cells after adding DOX, and the amount of cells with GFP could be observed by fluorescence microscopy. After the expression of RIG-G protein, the proliferation activity of A594 cell was significantly inhibited compared to the control group (1.168±0.107 vs 2.099±0.162, P<0.05). Conclusion: The regulated expression of RIG-G gene was established in A549 lung cancer cell line. The RIGG protein has potential abilities to inhibit the proliferation of lung cancer cell A549.
Retinoic acid-induced gene G; Lentiviral; Expression regulation; Cell proliferation
10.3969/j.issn.1007-3969.2015.08.002
R73-35+1
A
1007-3639(2015)08-0566-06
2014-06-09
2014-08-11)
国家自然科学基金(81272603,81472179);上海市浦江人才计划(13PJ1407300);2013年教育部留学回国人员科研启动基金;上海申康医院发展中心课题(SHDC22014008)。
李冬 E-mail:186ld@163.com
