miR-216a-5p通过下调MMP16表达抑制肺癌细胞的侵袭
2015-12-16李宏敏于瑞莲罗树春兰海涛
安 宁,李宏敏,于瑞莲,罗树春,张 明,兰海涛
四川省医学科学院,四川省人民医院肿瘤科,四川 成都 610072
miR-216a-5p通过下调MMP16表达抑制肺癌细胞的侵袭
安 宁,李宏敏,于瑞莲,罗树春,张 明,兰海涛
四川省医学科学院,四川省人民医院肿瘤科,四川 成都 610072
背景与目的:微小RNA(microRNA,miRNA)是一类存在于真核生物体内只有19~39 bp大小的内源性非编码RNA,它能在转录和翻译水平调控基因的表达,在细胞的增殖分化、新陈代谢、免疫调控和凋亡等方面起着重要的作用。本研究检测miR-216a-5p在肺癌组织和肺癌细胞系的表达并探讨其对肺癌细胞侵袭能力的影响及其调控机制。方法:使用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)检测55例肺癌患者的肺癌组织和7种肺癌细胞系中miR-216a-5p的表达情况;miR-216a-5p瞬时转染A549、95D和H460 3种肺癌细胞系,使用Transwell侵袭实验检测miR-216a-5p对肺癌细胞系侵袭能力的影响;预测并构建miR-216a-5p的候选靶基因基质金属蛋白酶16(matrix metalloproteinase 16,MMP16)基因的双荧光素酶报告基因表达质粒,使用qRT-PCR和蛋白[质]印迹法(Western blot)检测miR-216a-5p对靶基因MMP16的mRNA和蛋白表达的影响;小干扰RNA(siRNA)干扰MMP16与上调miR-216a-5p对比检测其对肺癌细胞侵袭能力的影响。结果:90.91%(50/55)的肺癌患者肿瘤组织中miR-216a-5p表达明显低于对应的癌旁组织(P<0.05)。7种肺癌细胞系中miR-216a-5p的表达量仅为对照组的7.00%~32.00%(P<0.05)。上调miR-216a-5p的表达能够抑制肺癌细胞的侵袭;siRNA干扰MMP16与转染上调miR-216a-5p都能够抑制肺癌细胞中MMP16的表达,并抑制肺癌细胞侵袭。结论:miR-216a-5p可以作为临床肺癌诊断的候选标志物之一,并且其能够通过下调MMP16的表达从而抑制肺癌细胞的侵袭。
肺癌;miR-216a-5p;基质金属蛋白酶16;侵袭
微小RNA(microRNA,miRNA)是一类内源性的非编码小分子RNA,长度为19~25个核苷酸,由高等真核生物基因组编码[1]。同一miRNA可以调控多个不同的mRNA分子,不同的miRNA分子也可以协同调控同一mRNA分子。根据预测,人类细胞中约1/3的蛋白编码基因受miRNA的调控,在细胞的增殖、凋亡、分化、代谢、个体发育和病毒感染等方面都发挥着重要的作用[2-3]。近年来,大量研究结果显示,失调的miRNA与各种肿瘤的发生、发展具有密切的关系,可能发挥着癌基因或抑癌基因的作用[4-6]。研究发现,miR-216a在多种恶性肿瘤中发挥着重要的作用。研究结果表明,miR-216a通过作用JAK2基因抑制胰腺癌细胞生长和促进凋亡[7],并通过靶向调控蛋白激酶Cα抑制胶质瘤细胞增殖和侵袭[8]。肺癌作为威胁人类生命的主要疾病之一,近年来多项研究显示,多种miRNA对其发生、发展起着重要的调控作用。Yanaihara等[9]对104对肺癌组织和癌旁组织的基因芯片分析显示miR-216a也有表达下调。基质金属蛋白酶16(matrix metalloproteinase 16,MMP16)作为能降解细胞外基质的酶类,与多种肿瘤发生、发展有着密切的关系,如膀胱癌[10]、神经胶质瘤[11]。本研究旨在探讨miR-216a-5p在肺癌组织和细胞系中的表达情况,靶向调节MMP16的功能,及其抑制肺癌细胞侵袭的能力。
1 材料和方法
1.1 组织细胞系及主要实验试剂
组织标本取自四川省人民医院2014年1月—2014年5月手术治疗的肺癌患者55例。其中男性35例,女性20例;年龄35~81岁。TNM分期:Ⅰ~Ⅱ期30例,Ⅲ期20例,Ⅳ期5例。有淋巴结转移23例,无淋巴结转移32例。每例取癌组织作为实验组,取距离相应癌组织2 cm以上的癌旁组织作为对照组,液氮保存。人肺癌细胞系A549、95D、95C、H460、H446、H1299、H358及正常人支气管上皮细胞系HBE由本实验室保存。RPMI-1640培养基、Optim-MEM、TRIzol、脂质体LipofectamineTM2000购自美国Invitrogen公司。pmiRGLO双荧光素酶报告基因表达质粒和pmiRGLO双荧光素酶报告基因检测试剂盒均购自美国Promega公司。SqRT-PCR检测试剂盒购自宝生物工程(大连)有限公司。内参U6的反转录引物为:5’-GTCGTATCCAGTGCAGGGT CCGAGGTATTCGCACTGGATACGACAAAA TATGGAAC-3’;miR-216a-5p的反转录引物为:5’-CTCAACTGGTGTCGTGGAGTCGGC AATTCAGTTGAGAGGGATTCTCACAG-3’;内参U6的扩增引物分别为:5’-TGCGGGTGCTCGCTTCGGCAGC-3’和5’-GGTGTCGTGGAGTCG-3’;miR-21 6a-5p的扩 增引 物 分别 为 :5’-TAATCTCAGCTGGCAACT-3’和5’-GGTGTCGTGGAGTCG-3’;miR-216a-5p mimics及对照scramble分别为:5’-UAAUCUCAGCUGGCAACUGUGA-3’及5’-GGACGGCGAUCAGAUAAGAGUU-3’,MMP16的干扰RNA序列(si-MMP16)为:5’-AUAAUCUCCAAUAUCCUCUU AAA-3’。以上引物和RNA序列均购自广州锐博生物科技有限公司。MMP16扩增引物为:5’-AGCACGTTGTTTCCCTTCC-3’及5’-CCCGAGCTGTTTATCCATCA-3’;β-actin扩增引物为:5’-CTTAGTT GCGTTACACCCTTTCTTG-3’及5’-CTTAGTTGCGTTACACCCTTTCTTG-3’,由美国Invitrogen公司合成。PVDF膜和Millicell小室
购自德国Merck Millipore公司。兔抗人MMP16 Ⅰ抗(1∶100)购自英国Abcam公司,Anti-β-actin多克隆抗体购自美国Santa Cruz公司。
1.2 组织及细胞系总RNA的提取
常规方法培养细胞,待细胞生长至培养瓶壁80%~90%(约3×106个)时,弃去培养基,加PBS洗涤细胞3次,加入1 mL TRIzol,左右晃动,裂解细胞,待充分匀浆后转入1.5 mL EP管中,室温静置5 min。从液氮中取出组织,放入预冷的研钵中进行研磨,期间不断地加入液氮保持低温直至研磨成粉末。取0.5 g组织粉到EP管中,加入1 mL TRIzol混匀,在室温(15~30 ℃)下温育15 min。
在上述细胞或组织裂解液的EP管中,按照1∶5的比例加入相应体积的氯仿(200 μL),盖上EP管盖子,在漩涡仪上振荡15 s,在室温(15~30 ℃)温育5 min后,1 000×g(4 ℃)离心15 min。取上层水置于新EP管中,加入等体积异丙醇,颠倒混匀后在室温(15~30 ℃)温育10 min,1 000×g(4 ℃)离心10 min。弃上清液,加入预冷75%(DEPC)乙醇1 mL,涡旋混合,1 000×g (4 ℃)离心5 min,弃上清液,保留沉淀。加入适量无RNA酶的DEPC水溶解总RNA。用RNase-free water溶解RNA沉淀。电泳检测RNA质量,琼脂糖凝胶电泳观察5 S、18 S及28 S条带,紫外分光光度计检测260 nm/280 nm吸光度(D)比值,计算RNA浓度。放置-80 ℃超低温冰箱冻存备用。
1.3 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)检测组织及细胞系中miR-216a-5p的表达
按照cDNA反转录试剂[购自宝生物工程(大连)有限公司]说明书对于组织和各细胞系所提取的总RNA进行反转录。qRT-PCR引物(RiboBio)按说明书进行稀释。反转录反应体系为20 μL:反转录颈环引物4 μL,反转录酶1 μL,反转录混合引物1.6 μL,提取的总RNA模板1 μg,无RNA酶水至20 μL。以上体系混匀后,瞬时离心试剂。在qRT-PCR仪上进行反转录反应,反应条件为42 ℃ 30 min,85 ℃ 15 s。qRT-PCR选用20 μL反应体系在Bio-Rad CFX96 qRT-PCR反应仪上进行。miR-216a-5p和U6的qRT-PCR引物(RiboBio)按说明书进行稀释,程序为:95 ℃预变性20 s;95 ℃变性10 s,55 ℃延伸20 s,70 ℃退火20 s,共40个循环。反应结束后确认qRT-PCR的扩增曲线和融解曲线,进行qRT-PCR定量时制作标准曲线等。相对miRNA表达采用Ct值精确计算,将U6 snRNA作为内参。
1.4 荧光素酶活性检测miR-216a-5p对MMP16调控的靶位点
运用TargetScan软件对miR-216a-5p潜在的靶基因进行预测,筛选出MMP16的一个非保守位点的3’UTR端5’-UUUAAGAGGAUAUUGGAGAUUAU-3’可能是miR-216a-5p的靶向位点。真核表达载体质粒pmiRGLO靶基因报告质粒及3’-UTR端突变报告载体均由广州市锐博生物科技有限公司构建。野生型MMP16 3’UTR-荧光素酶载体,命名为MMP16-Wt。突变型PRKCA 3’UTR-荧光素酶报告载体,命名为MMP16-Mut。将荧光素酶报告载体与miR-216a-5p mimics及对照scramble序列按LipofectamineTM2000说明书,根据实验分组情况对各组进行共转染A549细胞。转染4 h后换液,在37 ℃、CO2体积分数为5%的培养箱中培养48 h后,收获细胞。按Promega公司双荧光素酶报告基因检测试剂盒说明书,使用检测仪检测细胞荧光素酶活性。计算相对荧光素酶活性=萤火虫荧光素酶活性值/海肾荧光素酶活性值。
1.5 蛋白[质]印迹法(Western blot)检测miR-216a-5p对MMP16蛋白表达的影响
将miR-216a-5p mimics或scramble转染A549细胞,48 h后提取细胞总蛋白,BCA法测定蛋白浓度。按各样品100 μg等量样本,进行SDS-PAGE分离,然后将蛋白转移至PVDF膜上,5%脱脂牛奶封闭液,摇床上室温封闭1 h;用TBST适当稀释加入MMP16抗体或β-actin抗体,4 ℃过夜。次日用TBST室温洗膜2次,每次10 min,最后用TBS洗膜10 min;同样方法稀释二抗,室温温育1~2 h,并再次用TBST及TBS洗膜;配制显影液,并用锡箔纸包住使其避光,将显影液均匀滴加至膜上,曝光显影并采图。β-actin蛋白条带作为内参,用于比对MMP16蛋白表达情况。
1.6 qRT-PCR检测MMP16 mRNA表达
将miR-216a-5p mimics或scramble转染A549细胞,24 h后提取各组细胞总RNA。反转录cDNA按照试剂MMLV说明书操作。反应体系20 μL,反应条件为42 ℃ 30 min,85 ℃ 15 s。将MMP16和β-actin引物使用双蒸水稀释到100 μL,按照宝生物工程(大连)有限公司SYBR Premix(Perfect Real Time)试剂盒说明书配置PCR体系20 μL。使用两步法进行qRT-PCR扩增,预变性1个循环:95 ℃ 20 s;qRT-PCR反应40个循环:95 ℃ 5 s,60 ℃ 30 s。反应结束后,以β-actin作为内参,相对MMP16表达采用Ct值精确计算,得出各组细胞的MMP16 mRNA表达量。
1.7 Transwell细胞侵袭实验
将50 mg/L基质胶置于4 ℃融化,并用无血清培养基将其1∶5.5稀释混匀,50 μL/孔加至Transwell小室的上室聚碳酸酯膜上,注意整个操作在冰上及无菌条件下进行,所有器皿及试管均事先预冷。37 ℃下温育60 min,此时Matrigel已经形成胶。吸出培养板中残余液体,每孔加入100 μL含10 g/L BSA的无血清培养液,37 ℃30 min。让细胞撤血清饥饿12~24 h,消化细胞,终止消化后离心弃去培养液,用PBS洗1~2遍,用含10 g/L BSA的无血清培养液或含1%血清培养基重悬,调整密度至105个/mL。吸取细胞悬液400 μL接种于Transwell上室内,下室内加入含10%胎牛血清RPMI-1640培养液600 μL。在37 ℃、CO2体积分数为5%的温育箱中培养24 h。弃去上室中的培养液,并用沾有0.9%氯化钠溶液的棉签轻轻擦去滤膜上层细胞。滤膜下层细胞以甲醇固定,结晶紫染色。显微镜下选择膜10个不重叠的视野观察穿过膜的细胞数,计算细胞侵袭率。实验重复3次。
1.8 统计学处理
所有数据采用SPSS 13.0统计学软件进行统计分析。结果均以表示。两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 肺癌组织和各肺癌细胞系中miR-216a-5p的表达情况
采用qRT-PCR对55例肺癌患者肿瘤组织及对应癌旁组织中miR-216a-5p的表达情况进行检测。结果发现,在90.91%(50/55)的肺癌患者肿瘤组织中表达明显低于对应的癌旁组织,差异有统计学意义(P<0.05,图1A),其余9.09%(5/55)的肺癌患者肺癌组织miR-216a-5p的表达与对应癌旁组织相比,差异无统计学意义(P>0.05)。同样的方法检测A549、H460、H446、95C、95D、H1299及H358几种肺癌细胞系中miR-216a-5p表达,与正常人支气管上皮细胞系HBE相比也处于明显的低表达。其中A549中下调最为明显,仅为HBE表达量的7.00%,表达量最高的H1299也只达到HBE表达量的32.00%,差异有统计学意义(P<0.05,图1B)。
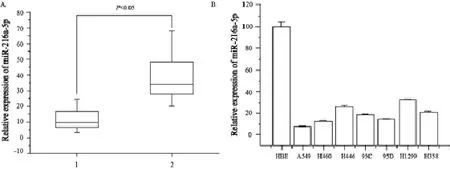
图 1 qRT-PCR检测55例肺癌和7种肺癌细胞系中miR-216a-5p的表达情况Fig. 1 The expressions of miR-216a-5p in 55 cases of lung cancer and 7 lung cancer cell lines detected by qRT-PCR
2.2 miR-216a-5p对MMP16 mRNA 3’UTR荧光酶活性的影响
为了验证软件预测的MMP16是否为miR-216a-5p的目标靶基因,能否和MMP16的3’UTR端结合,将miR-216a-5p mimics或scramble与构建并验证过的MMP16-Wt、MMP16-Mut共转染到A549细胞中,在48 h后检测双荧光酶活性。结果显示:miR-216a-5p mimics明显抑制野生型MMP16-Wt报告载体的荧光素酶活性,与scramble相比下调58%(P<0.05);而miR-216a-5p mimics对突变型MMP16-Mut载体的荧光素酶活性无明显抑制作用(图2)。实验结果表明,与软件预测结果一致,miR-216a-5p能和MMP16的3’UTR端结合。
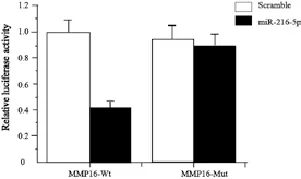
图 2 miR-216a-5p作用MMP16 3’UTR抑制荧光酶活性Fig. 2 miR-216a-5p inhibited the luciferase activity of MMP16 mRNA
2.3 miR-216a-5p对MMP16 mRNA和蛋白水平的影响
由于miRNA作用于靶基因既可能影响其mRNA又可能影响蛋白水平的表达,为了研究miR-216a-5p到底如何作用MMP16,首先,我们使用qRT-PCR检测了A549细胞转染miR-216a-5p mimics、si-MMP16或scramble后MMP16的mRNA表达水平,结果显示转染miR-216a-5p mimics组的A549细胞MMP16的mRNA表达水平明显下降,下调约84%,与转染干扰RNA组si-MMP16下调效果一致(P<0.05,图3A),说明MMP16转录过程受到抑制或者mRNA被剪切降解;然后,采用Western blot检测了转染miR-216a-5p mimics后MMP16蛋白水平的变化,转染miR-216a-5p mimics组和si-MMP16干扰RNA组,明显抑制MMP16蛋白的表达(P<0.05,图3B)。以上数据说明,miR-216a-5p能够靶向MMP16并抑制其蛋白的表达。
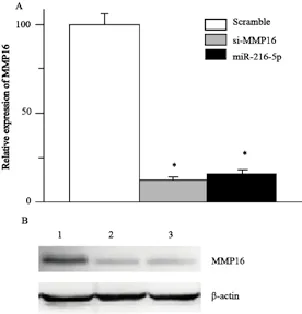
图 3 miR-216a-5p抑制MMP16的mRNA和蛋白表达Fig. 3 The miR-216a-5p inhibited the MMP16 expressions at mRNA and protein levels
2.4 miR-216a-5p能抑制肺癌细胞的侵袭能力
miR-216a-5p mimics、si-MMP16或scramble瞬时转染A549、95D和H460细胞,scramble为阴性对照。采用Transwell侵袭实验检测miR-216a-5p对于肺癌侵袭能力的影响。结果显示,在3种肺癌细胞系中,miR-216a-5p均能显著抑制其侵袭能力,其中A549细胞抑制率为62%,95D细胞抑制率为80%,H460细胞抑制率为76%。干扰RNA组si-MMP16能够起到与miR-216a-5p相同的抑制效果(P<0.05,图4)。结果说明,miR-216a-5p与si-MMP16能够产生相同的效果,均能抑制肺癌细胞的侵袭能力,表明miR-216a-5p通过下调MMP16的表达从而抑制肺癌细胞的侵袭。

图 4 miR-216a-5p通过作用MMP16抑制肺癌细胞的侵袭能力Fig. 4 miR-216a-5p inhibited the invasion ability of lung cancer cells through action on MMP16
3 讨 论
肺癌在世界范围内是死亡率最高的肿瘤,它严重威胁着人类的健康。在过去的十年里全世界有上百万人死于肺癌[12]。虽然肺癌发生的蛋白和基因组图谱已经部分阐明,但位居死亡率之首的肺癌5年存活率仍无明显改善(仅15%~20%),缺乏有效的早期诊断和治疗手段是两大主要原因[13]。因此,研究肺癌发生、发展的机制并寻求其基因治疗的靶位点具有非常重要的意义。miRNA是一类存在于真核生物体内只有19~39 bp大小的内源性非编码RNA,它能在转录和翻译水平抑制基因的表达[1]。大量研究表明,miRNA在肿瘤中可能起着癌基因和抑癌基因的作用[14]。Yanaihara等[7]在基因芯片分析时发现,miR-216a在肺癌组织中处于表达下调。在胰腺癌中,miR-216a能够调控JAK2基因抑制胰腺癌细胞生长和促进凋亡[7]。近年来的研究也发现,miR-216a能作为临床诊断的标志物,对结直肠癌进行早期诊断预测[15]。
侵袭和转移是恶性肿瘤导致患者死亡的主要原因。恶性肿瘤的侵袭和转移分为黏附、降解和迁移三个步骤。肿瘤进行转移,必须先进入血管,在血液中存活,迁移出血管,侵袭外周组织并生长[16]。而MMP16在肿瘤发生的早期介导了细胞外基质及基底膜的降解,为促进肿瘤的增殖创造微环境。Chen等[10]研究发现,MMP16在膀胱癌细胞的迁移过程中发挥着重要作用,并且能够被miR-200b所调控。还有研究结果表明,MMP16受miR-146b-5p调控影响着神经胶质瘤细胞的侵袭、迁移能力[11]。
在本研究中,我们首次对于miR-216a-5p在肺癌组织和肺癌细胞系中的表达情况进行了定量检测。在55例肺癌患者中,90.91%的肺癌患者肿瘤组织中miR-216a-5p表达明显低于对应的癌旁组织,腺癌和鳞癌中这种下调表达趋势没有明显差别且与肿瘤分期无关。在7种肺癌细胞系中,miR-216a-5p同样表达下调。检测表明,miR-216a-5p无论在肺癌组织中还是在肺癌细胞系中都是处于异常下调表达的水平,这种异常下调表达在肺癌的发生、发展过程中可能会起到某些特殊作用。本研究通过软件预测、双荧光素酶报告基因表达检测、qRT-PCR和Western blot检测显示,miR-216a-5p能够靶向MMP16并抑制其蛋白的表达,证实了miR-216a-5p对于MMP16的作用机制。MMP16对于细胞的跨膜侵袭具有重
要作用[17]。此外,本研究探讨了miR-216a-5p对于肺癌细胞侵袭的影响,在A549、95F和H460 3种细胞中,miR-216a-5p起到的作用与si-MMP16一致,能够显著地抑制细胞的侵袭。
综上所述,miR-216a-5p在调控肺癌细胞的侵袭方面发挥重要作用,其作用机制为下调抑制MMP16蛋白的表达,从而抑制肺癌细胞的侵袭能力,为肺癌临床基因治疗提供新的靶点。由于其在肺癌中的异常表达,将为肺癌的临床早期预测和诊断提供新的标志物。
[1] BARTEL D P. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2): 281-297.
[2] LEWIS B P, BURGE C B, BARTEL D P. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets [J]. Cell, 2005, 120(1): 15-20.
[3] CALIN G A, CROCE C M. MicroRNA signatures in human cancers[J]. Nat Rev Cancer, 2006, 6(11): 857-866.
[4] CALIN G A, SEVIGNANI C, DUMITRU C D, et al. Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J]. Proc Natl Acad Sci U S A, 2004, 101(9): 2999-23004.
[5] VOORHOEVE P M, LE SAGE C, SCHRIER M, et al. A genetic screen implicates miRNA-372 and miRNA-373 as oncogenes in testicular germ cell tumors[J]. Cell, 2006, 124(6): 1169-1181.
[6] JOHNSON S M, GROSSHANS H, SHINGARA J, et al. RAS is regulated by the let-7 microRNA family[J]. Cell, 2005, 120(5): 635-647.
[7] WANG S, CHEN X, TANG M. MicroRNA-216a inhibits pancreatic cancer by directly targeting Janus kinase 2[J]. Oncol Rep, 2014, 32(6): 2824-2830.
[8] 赵文健, 杨 亮, 唐伟军. miR-216a通过靶向调控蛋白激酶Cα抑制胶质瘤细胞增殖和侵袭[J]. 中国癌症杂志, 2013, 23(6): 420-424.
[9] YANAIHARA N, CAPLEN N, BOWMAN E, et al. Unique microRNA molecular profiles in lung cancer diagnosis and prognosis [J]. Cancer Cell, 2006, 9(1): 189-198.
[10] CHEN M F, ZENG F, QI L, et al. Transforming growth factor beta 1 induces epithelial mesenchymal transition and increased expression of matrix metalloproteinase16 via miR-200b downregulation in bladder cancer cells[J]. Mol Med Rep, 2014, 10(3): 1549-1554.
[11] LI Y, WANG Y, YU L, et al. miR-146b-5p inhibits glioma migration and invasion by targeting MMP16[J]. Cancer Lett, 2013, 339(2): 260-269.
[12] GREENLEE R T, MURRAY T, BOLDEN S, et al. Cancer statistics, 2000[J]. CA Cancer J Clin, 2000, 50(5): 7-33.
[13] MEYERSON M, CARBONE D. Genomic and proteomic profiling of lung cancers: lung cancer classification in the age of targeted therapy[J]. J Clin Oncol, 2005, 23(32): 19-26.
[14] CHEN C Z. MicroRNAs as oncogenes and tumor suppressors[J]. N Engl J Med, 2005, 35(17): 68-71.
[15] ZHANG J, ZHANG K, BI M, et al. Circulating microRNA expressions in colorectal cancer as predictors of response to chemotherapy[J]. Anticancer Drugs, 2014, 25(3): 346-352.[16] LIOTTA L A, STRACKE M L, KOHN E, et a.Tumor invasion and metastases: biochemical mechanisms[J]. Prog Clin Biol Res, 1989, 256(9): 381-398.
[17] SATO H, TANAKA M, TAKINO T, et al. Assignment of the human genes for membrane-type-1, -2, and -3 matrix metalloproteinases (MMP14, MMP15, and MMP16) to 14q12.2, 16q12.2-q21, and 8q21, respectively, by in situ hybridization [J]. Genomics, 1997, 39(3): 412-413.
miR-216a-5p inhibits invasion ability in human lung cancer cells by down-regulation of MMP16
expression
AN Ning, LI Hongmin, YU Ruilian, LUO Shuchun, ZHANG Ming, LAN Haitao (Department of Oncology, Sichuan Academy of Medical Sciences, Sichuan Provincial People’s Hospital, Chengdu Sichuan 610072, China)
AN Ning E-mail: anning_scph@163.com
Background and purpose: MicroRNA (miRNA) belongs to a class of 19 to 30 nucleotidelong, endogenous noncoding RNA expressed in eukaryotes and predominantly inhibits gene expression at the posttranscriptional level. The miRNAs play critical roles in cell proliferation and differentiation, apoptosis, metabolism, and immune regulation. This study aimed to detect the expression of miR-216a-5p in lung cancer tissues and lung cancer cell lines, and to discuss the effects of miR-216a-5p on the invasion ability of lung cancer cells and the mechanism. Methods: Quantitative real-time PCR (qRT-PCR) was used to detect the expression of miR-216a-5p in lung cancer tissues of 55 cases and 7 lung cancer cell lines. Three lung cancer cell lines of A549, 95D and H460 were transiently transfected by miR-216a-5p, and Transwell was used to detect the effects of miR-216a-5p on the invasion of lung cancer cell lines. The dual luciferase reporter plasmids containing the miR-216a-5p candidate target gene and the gene of matrix metalloproteinase 16 (MMP16) were predicted and constructed. qRT-PCR and Western blot were used to detect the changes in mRNA and protein levels of target gene MMP16 by miR-216a-5p. The interference of MMP16 by siRNA and up-regulation miR-216a-5p by transfection were compared on the invasion of lung cancer cells. Results: The miR-216a-5p expression levels were all significantly reduced in 90.91% (50 of 55 patients) tumor tissues compared
Lung cancer; miR-216a-5p; Matrix metalloproteinase 16; Invasion
10.3969/j.issn.1007-3969.2015.08.005
R734.2
A
1007-3639(2015)08-0588-07
2014-12-14
2015-04-10)
安宁 E-mail:anning_scph@163.com
with corresponding adjacent normal lung tissues (P<0.05). The miR-216a-5p expression levels were only 7.00%-32.00% in 7 lung cancer cells compared with the control group (P<0.05). Up-regulation of the expression of miR-216a-5p inhibited the invasion of lung cancer cells; interference of MMP16 by siRNA, as well as up-regulating miR-216a-5p by transfection, inhibited the expression of MMP16 in lung cancer leading to inhibition of the invasion of lung cancer cells. Conclusion: miR-216a-5p can be a candidate marker in clinical diagnosis and it can inhibit the invasion of lung cancer cells by down-regulating the expression of MMP16.
