治疗前NLR和PLR对宫颈鳞癌患者预后的影响
2015-12-14郭煦谢洪哲柯尊富
郭煦谢洪哲柯尊富
·论著·
治疗前NLR和PLR对宫颈鳞癌患者预后的影响
郭煦1谢洪哲2★柯尊富3
目的探讨经手术治疗的宫颈鳞癌患者治疗前中性粒细胞与淋巴细胞比(neutrophil-tolymphocyte ratio,NLR)及血小板与淋巴细胞比(platelet-to-lymphocyteratio,PLR)与总生存期(overall survival,OS)、无病生存期(disease-free survival,DFS)和各临床病理因素的相关性。方法回顾性分析中山大学附属第一医院于2005年1月1日至2009年12月31日期间初治的并且经过手术治疗的143例宫颈鳞癌患者的临床病理资料,根据统计学方法选取NLR和PLR截断值,将患者根据截断值分组,分析NLR和PLR与患者生存、复发情况的相关性以及与临床病理因素的相关性。结果选取NLR=2.8和PLR=125分别作为截断值,高NLR组5年生存率为30.3%,低NLR组5年生存率为80%,差异有统计学意义(P=0.000)。高NLR组复发率为69.7%,低NLR组复发率为24.5%,差异有统计学意义(P=0.000)。高PLR组5年生存率为53.7%,低PLR组5年生存率为81.6%,差异有统计学意义(P=0.000)。高PLR组复发率为50%,低PLR组复发率为22.4%,差异有统计学意义(P=0.000)。经过单因素和多因素分析,国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期、术前化疗、病灶大小、外周血血小板计数(platelet,PLT),NLR值和PLR值是影响宫颈鳞癌患者总生存率和无病生存率的独立危险因素。结论治疗前NLR及PLR均是影响宫颈鳞癌患者总生存时间和无病生存时间的独立危险因素。
中性粒细胞与淋巴细胞比(NLR);血小板与淋巴细胞比(PLR);宫颈鳞癌;总生存率;无病生存率
流行病学调查结果显示,慢性炎症患者更容易罹患癌症。肿瘤也可引起非特异性的炎症反应,导致白细胞水平的特定改变,主要表现为中性粒细胞增多和淋巴细胞减少,同时也会出现血小板增多,这些改变均可以通过常规的外周血检测中来发现。作为非特异性的炎症反应指标,中性粒细胞与淋巴细胞比(neutrophil-to-lymphocyte ratio,NLR)及血小板与淋巴细胞比(platelet-to-lymphocyteratio,PLR)已经被一些研究证实与多种肿瘤患者的预后具有相关性[1]。Sm ith等人在2009年的研究中发现在可切除的胰腺导管癌患者中,手术前的高PLR可以作为独立的预后危险因素[2]。2012年Kwon等人研究发现在结肠癌患者中,术前的高PLR和NLR也可作为独立的预后危险因素[3]。另外在食管癌、小细胞肺癌、胃癌、直肠癌、乳腺癌、卵巢癌、肝癌和肾癌等多项研究中也发现NLR和PLR均与肿瘤的预后具有相关性[4-12]。
目前,关于NLR和PLR对宫颈癌患者预后影响的研究很少,而宫颈鳞癌又占了宫颈癌总数的75%~80%。本研究旨在通过对143例宫颈鳞癌患者临床资料的回顾性分析,评价治疗前NLR和PLR与宫颈鳞癌患者预后的相关性。
1 资料与方法
1.1 资料
选取2005年1月1日至2009年12月31日,于中山大学附属第一医院妇科初治的并且经过手术治疗的宫颈鳞癌患者,所有病例均经病理证实为宫颈鳞状细胞癌,临床资料完整,并且随访至少满五年或至死亡。排除标准:(1)合并有免疫性疾病以及其他恶性肿瘤的患者。(2)治疗前合并有急性或慢性感染。(3)合并有血液系统疾病、血栓或出血性疾病;(4)合并有严重的肝、肾疾病;(5)治疗前曾接受过放疗或化疗。收集患者治疗前7日内的血常规检查结果,记录白细胞计数、中性粒细胞计数、淋巴细胞计数及血小板计数(platelet,PLT),通过中性粒细胞绝对值比淋巴细胞绝对值计算出NLR值,血小板绝对值比淋巴细胞绝对值计算出PLR值。本研究最终入组患者为143名,平均年龄为45.85岁(范围:29岁~68岁),其中50岁以下患者98名(68.5%),大于等于50岁以上患者45名(31.5%)。根据国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)2009(FIGO,2009)的临床分期标准,分为Ⅰ期患者70名(49%),Ⅱ期患者69名(48.3%),Ⅲ期患者4名(3.7%)。术前曾接受化疗治疗患者65名(45.5%),术前接受放疗治疗患者23名(16.1%)。根据术前体格检查、影像学检查结果、术中所见及术后病理检查确定病灶大小,病灶小于4 cm患者76名(53.1%),病灶大于等于4 cm患者67名(46.9%)。根据手术方式分组,行全子宫切除术
患者4名(2.8%),行腹式次广泛全子宫切除术及盆腔淋巴结切除术患者20名(14%),行腹式广泛全子宫切除术及盆腔淋巴结切除术患者89名(62.2%),行腹腔镜下广泛全子宫切除术及盆腔淋巴结切除术患者30名(21%)。根据术后病理检查结果,按癌细胞分化程度分为Ⅰ、Ⅱ、Ⅲ级,Ⅰ级高分化鳞癌患者21名(14.7%),Ⅱ级中分化鳞癌患者36名(25.2%),Ⅲ级低分化鳞癌患者86名(60.1%);无淋巴结转移患者116名(81.1%),有淋巴结转移患者27名(19.9%)。平均随访时间为72.1个月(3个月~122个月)。
1.2 随访
通过查阅病历资料及电话随访的方式进行随访以获得预后资料,随访截止时间为2015年2月28日。本研究中将患者从第一次入院确诊时间至死亡时间或者随访截止时间定义为总生存期(overall survival,OS);患者从手术时间至确诊局部复发或远处转移的时间定义为无病生存期(disease-free survival,DFS)。
1.3 统计学方法
采用SPSS17.0软件进行统计学分析。绘制ROC曲线确定NLR和PLR与OS及DFS的相关性,根据统计学方法选取(敏感度+特异性-1)最大值时所对应的数值为截断值。单因素分析釆用Kaplan-Meier检验绘制生存曲线,组间生存率比较采用Log-rank分析。多因素分析采用Cox风险回归模型。以P<0.05视为差异有统计学意义。
2 结果
2.1 NLR与宫颈鳞癌预后及各临床病理因素的相关性
2.1.1 NLR截断值的选取
全组患者治疗前NLR中位值为1.74(范围:0.41~7.26)。根据NLR与OS、DFS的关系分别绘制ROC曲线(图1、图2),NLR与OS关系的ROC曲线下面积AUC=0.784,P=0.000,说明NLR与宫颈鳞癌患者的总生存期具有相关性;NLR与DFS关系的ROC曲线下面积AUC=0.689,P=0.000,说明NLR与宫颈鳞癌患者的无病生存期具有相关性。依照ROC曲线,根据统计学方法,选取NLR=2.8作为截断值。
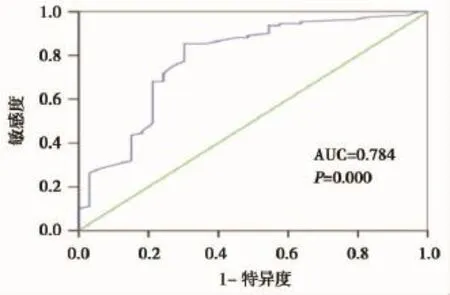
图1 治疗前NLR与OS关系的ROC曲线图Figure 1 ROC curve for the relationship between OS and NLR before treatment
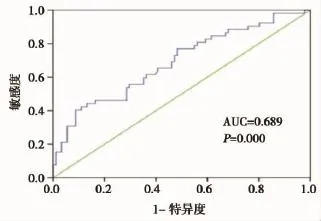
图2 治疗前NLR与DFS关系的ROC曲线图Figure 2 ROC curve for the relationship between NLR and DFS before treatment
2.1.2 NLR与宫颈鳞癌患者预后的相关性
根据截断值2.8将全部患者分为2组:NLR≥2.8的高NLR组(n=33),NLR<2.8的低NLR组(n=110)。至随访截止,全组患者5年生存率为66.43%,高NLR组患者5年生存率为30.30%,低NLR组患者的5年生存率为77.27%,差异有统计学意义(P=0.000)(图3)。全组患者的复发率为35%,高NLR组患者复发率为69.7%,低NLR组患者复发率为24.5%,高NLR组患者的复发率明显高于低NLR组,两者之间差异有统计学意义(P=0.000)(图4)。
2.1.3 NLR与临床病理因素的关系
经过单因素分析,高NLR组和低NLR组在FIGO分期(P=0.005)、术前有无化疗(P=0.005)、
病灶大小(P=0.009)和血小板计数(P=0.005)方面差异有统计学意义。其他各方面无统计学差异(表1)。
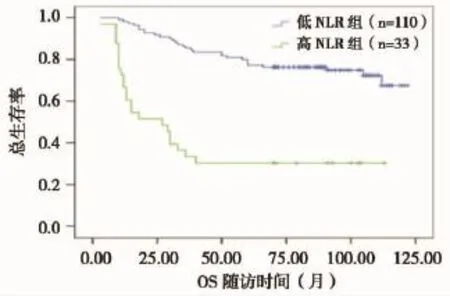
图3 治疗前低NLR组和高NLR组宫颈鳞癌患者OS曲线的比较Figure 3 OS analysis between low NLR and high NLR groups from the patients w ith cervical squamous cell carcinoma before treatment

图4 治疗前低NLR组和高NLR组宫颈鳞癌患者DFS曲线的比较Figure 4 DFS analysis between low NLR and high NLR groups from the patientsw ith cervical squamous cell carcinoma before treatment
2.2 PLR与宫颈鳞癌预后及各临床病理因素的相关性
2.2.1 PLR截断值的选取
全组患者治疗前PLR中位值为119.6(范围:20.6~384.9)。根据PLR与OS、DFS的关系分别绘制ROC曲线(图5、图6),PLR与OS关系的ROC曲线下面积AUC=0.633,P=0.006,说明PLR与宫颈鳞癌患者的总生存期具有相关性;PLR与DFS关系的ROC曲线下面积AUC=0.662,P=0.001,说明PLR与宫颈鳞癌患者的无病生存期具有相关性。通过PLR与宫颈鳞癌患者预后相关性的ROC曲线,根据统计学方法,选取PLR=125作为截断值。

图5 治疗前PLR与OS关系的ROC曲线图Figure 5 ROC curve for the relationship between OS and PLR before treatment

图6 治疗前PLR与DFS关系的ROC曲线图Figure 6 ROC curve for the relationship between PLR and DFS before treatment
2.2.2 PLR与宫颈鳞癌患者预后的相关性
根据截断值125将全部患者分为2组:PLR≥125的高PLR组(n=67),PLR<125的低PLR组(n=76)。其中,高PLR组患者5年生存率为54.5%,低PLR组患者5年生存率为81.6%,高PLR组患者的5年生存率明显低于低PLR组患者,两者之间差异有统计学意义(P=0.000)(图7)。高PLR组患者复发率为50%,低PLR组患者复发率为22.4%,高PLR组患者的复发率明显高于低PLR组,两者之间差异有统计学意义(P=0.000)(图8)。

表1 NLR<2.8组患者与NLR≥2.8组患者临床病例特征比较Table 1 The analysis for the clinic pathological features between NLR<2.8 and≥2.8 groups
2.2.3 PLR与临床病理因素的关系
经过单因素分析,高PLR组和低PLR组在年龄(P=0.028)、FIGO分期(P=0.001)、病灶大小(P=0.004)、术前有无化疗(P=0.028)、血小板计数(P=0.000)方面差异有统计学意义。其他各方面无统计学差异(表2)。
2.3 治疗前外周血血小板计数与宫颈鳞癌患者预后的关系
将治疗前外周血血小板计数PLT与患者的预后情况绘制ROC曲线,ROC曲线下面积AUC=0.645,P=0.004,说明治疗前的外周血血小板数量与宫颈鳞癌患者的预后具有相关性。通过ROC曲
线,根据统计学方法,选取PLT=272作为截断值。按截断值将患者分组:PLT≥272的患者为高血小板组(49例),PLT<272的患者为低血小板组(94例),高血小板组患者的5年生存率为34.3%,低血小板组患者的5年生存率为65.7%,高血小板组患者的5年生存率明显低于低血小板组患者,两组患者的总生存期有统计学差异(P=0.000);两组患者的无病生存期有统计学差异(P=0.001),说明治疗前外周血血小板计数为宫颈鳞癌患者预后的影响因素。

图7 治疗前低PLR组和高PLR组宫颈鳞癌患者OS曲线的比较Figure 7 OSanalysis between low PLR and high PLR groups from the patientsw ith cervical squamous cell carcinoma before treatment
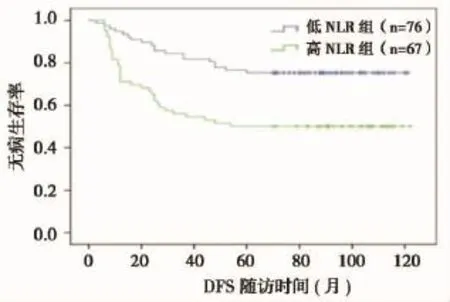
图8 治疗前低PLR组和高PLR组宫颈鳞癌患者DFS曲线的比较Figure 8 DFS analysis between low PLR and high PLR groups from the patients w ith cervical squamous cell carcinoma before treatment
2.4 各临床病理因素与患者预后的相关性
经过单因素分析,FIGO分期、术前有无化疗、病灶大小、NLR、PLR和血小板计数均与宫颈鳞癌患者的预后具有相关性。而其他临床病理因素与宫颈鳞癌患者的预后不具有相关性(表3)。
2.5 Cox回归分析
建立Cox模型,将单因素分析有意义的因素(包括FIGO分期、术前是否进行化疗、病灶大小、治疗前血小板计数、NLR和PLR)纳入模型进行多因素分析。结果显示,NLR(P=0.000)、PLR(P=0.001)、FIGO分期(P=0.000)、病灶大小(P=0.001)、术前是否有化疗(P=0.038)、治疗前血小板计数(P=0.000)均是影响是宫颈麟癌患者术后生存和复发的独立危险因素。
3 讨论
现已被广泛证实机体的炎症反应与免疫状态之间的关系对肿瘤细胞与间质组织相互作用中发挥了巨大的作用。早在1990年,Letom i就发现当有肿瘤细胞生长时外周血中中性粒细胞数目增多,并据此猜测NLR可能与肿瘤患者预后相关。此后,在小细胞肺癌、结直肠癌、胃癌、肝癌、胰腺癌、乳腺癌等方面已经证实血液中NLR与患者的预后呈负相关,在结肠癌患者中、可切除的胰腺导管癌患者中以及卵巢癌患者中也证实术前的PLR提示不良预后[2-3,13-15]。
目前,关于NLR、PLR与宫颈癌患者预后相关性的研究较少,Zhang等曾报道高NLR是宫颈癌患者无病生存时间短的独立危险因素,但不是总生存率低的独立危险因素;而PLR与宫颈癌患者预后不具有相关性[14]。但是该研究入组的宫颈癌患者即包括宫颈鳞癌患者又包括宫颈腺癌患者,由于宫颈鳞癌与宫颈腺癌病理类型不同,患者预后具有明显差异,所以将两者合并研究并不恰当。由于宫颈鳞癌在宫颈癌患者中占75%~80%,所以本研究单独选取宫颈鳞癌患者,研究NLR及PLR与宫颈鳞癌患者预后的相关性。另外Zhang等的研究将NLR和PLR的中位数作为截断值,可能会影响NLR及PLR在预测宫颈癌患者预后价值的敏感性和特异性,而本研究根据ROC曲线兼顾敏感性和特异性,选取敏感性和特异性最高的数值作为截断值,更有利于判断NLR和PLR对宫颈癌
患者预后的预测价值。本研究结论NLR与宫颈癌患者的无病生存期具有相关性,这与Zhang等的研究结论相一致。本研究还得出结论NLR与宫颈癌患者的总生存期具有相关性,且PLR与宫颈癌患者的无病生存期及总生存期均具有相关性,并且两者均为影响患者预后的独立危险因素,这与Zhang的研究结论不相符,但是与目前关于NLR及PLR与乳腺癌、结直肠癌、肝癌、非小细胞肺癌等恶性肿瘤相关性的研究结论相一致,考虑这个差异是由于病例选择范围不同以及截断值选取不同所造成的。

表2 PLR<125组患者与PLR≥125组患者临床病例特征比较Table 2 The analysis for the clinic pathological features between PLR<125 and≥125 groups
肿瘤细胞可产生促粒细胞生成素,引起白细胞和中性粒细胞数目增多。增多的中性粒细胞一方面可产生活性氧以及细胞因子,非特异性的杀死肿瘤细胞,对肿瘤的发展起到抑制作用。另一方面,中性粒细胞还可以抑制肿瘤坏死因子-α的生成,释放弹性蛋白酶,产生白细胞介素-1、白细胞介素-6和血管内皮生长因子等细胞因子,促进肿瘤的血管生成以及远处转移[15-16]。随着肿瘤细胞以及细胞因子的不断增多,中性粒细胞活化程度逐渐升高,开始表现为以促肿瘤生长作用为主。

表3 DFS和OS的单因素生存分析情况Table 3 Univariate survivalanalysis for DFS and OS
作为肿瘤免疫应答重要成员的淋巴细胞,既可以抑制肿瘤细胞的成熟,又可以通过多种机制促进肿瘤细胞的凋亡,进而抑制肿瘤的发生、发展和复发[17]。在卵巢癌、结直肠癌和黑色素瘤的研究中都发现,肿瘤部位的淋巴细胞增多与肿瘤患者的预后呈正相关。这种针对肿瘤细胞特异性抗原的机体免疫反应不仅发生在癌组织周围,亦存在于患者外周血中,并可作为评估肿瘤患者预后的相关因素。有研究发现,外周血中CD8T淋巴细胞数目增多,与肿瘤患者的预后成正相关[18]。多项研究证实肾癌、胃肠道肿瘤、肝癌、非小细胞肺癌患者围手术期淋巴细胞数的变化与术后复发、远期生存率具有明显关系[2-3]。因此,淋巴细胞减少可能提示患者的免疫调节功能异常,抗肿瘤物质分泌减少以及免疫应答功能减弱,从而导致抗肿瘤能力下降。
血小板不仅参与机体的凝血功能,还可以分泌多种细胞因子,直接或间接的参与机体的炎症反应,是人体炎症反应的一项指标。肿瘤患者慢性失血、营养不良以及组织坏死会引起血小板反应性的增高,而肿瘤细胞对血小板的破坏以及凝血功能异常也会引起血小板代偿性增高。有研究报道10%~60%的肿瘤患者出现血小板升高[19]。增多的血小板可以分泌一些细胞因子,如血小板衍生生长因子、血管内皮生长因子、血小板因子Ⅳ、转化生长因子-β、凝血酶敏感蛋白-1等,这些细胞因子是强有力的促有丝分裂剂,可以刺激肿瘤细胞增殖、促进肿瘤微血管生成,从而促进肿瘤的生长。同时,增多的血小板与肿瘤细胞相粘附形成癌栓,既可以保护肿瘤细胞逃避免疫监视,又可以促进肿瘤细胞与血管壁及组织粘附,完成转移。肿瘤患者的不良预后可能是肿瘤细胞与血小板之间相互促进的结果,在食管癌及胃癌患者中这一理论已被证实[20-21]。已经有报道,抗血栓形成药可抑制肿瘤转移。在本研究中也发现,外周血血小板数目为影响宫颈鳞癌患者预后的独立危险因素,这与现有报道的研究结果相一致[22]。
NLR和PLR都是2种细胞数目的绝对值的比值,具有相对的稳定性,对肿瘤患者预后的预测价值更高。其增高往往并非由于单一种类的细胞数目变化所引起,而是由2种细胞比例失衡所造成。当NLR或PRL升高,机体的炎症反应和免疫状态之间的平衡被打破,促肿瘤细胞发展和转移的作用增强,抑制肿瘤的作用减弱,提示肿瘤患者的不良预后[23]。
经过单因素和多因素Cox分析发现,NLR和PLR均为影响宫颈鳞癌患者预后的独立危险因素,说明机体的炎症反应与免疫状态之间的平衡影响着患者的预后。就此,我们可以通过降低患者机体的炎症反应以及提高免疫功能,进一步改善宫颈鳞癌患者的预后。已有的研究结果显示,非甾体类抗炎药可以降低40%~50%结肠癌发病风险,并且对预防胃癌、食管癌和肺癌具有一定的效果[24-25]。或许这一类药物对宫颈鳞癌的预防也有一定效果,有待进一步研究。
目前很多研究已经证明高NLR和PLR与肿瘤患者的不良预后有关,但是不同种类的肿瘤之间甚至同一肿瘤的不同研究之间,截断值选择并不相同[2-12]。Perez在NLR与胃肠间质瘤患者预后相关性的研究中将中位数2.7作为临界值[26],Kishi在NLR与直肠癌肝转移患者预后关系的研究中以NLR=5作为临界值[27]。而本研究是根据ROC曲线及统计学方法分别选取NLR=2.8、PLR=125作为截断值,由于本研究所选取的样本数较少,且为单机构的回顾性研究,对截断值选取造成了一定的局限性。考虑到不同部位的肿瘤生物学特征并不相同,以及现有的研究样本数量以及研究方法也并不相同,如果想选取统一的截断值用以预测肿瘤患者的预后,或者仅是用于预测某一种肿瘤患者的预后,仍需要进行多中心、大规模的前瞻性研究。
另外与宫颈鳞癌预后可能具有相关性的炎症指标如C反应蛋白、免疫学标志物鳞状上皮细胞癌抗原和与宫颈癌发病相关的人乳头瘤病毒在本研究中并未涉及到,主要是由于在2005年~2009年
以上几项指标并非为入院时常规检查,资料并不完整,所以此研究可能存在着不均衡性。因此,在进一步的研究过程中,我们可以选取以上资料完整的患者,结合NLR和PLR的动态变化,进一步分析与患者治疗效果以及预后的相关性,这样可以更好的评估炎症反应标志物与宫颈癌发生及发展的相关性。
由于NLR和PLR的获取具有简便、经济的优点,作为宫颈鳞癌患者病情评估的一个有益补充,值得广泛推广。
[1]Templeton AJ,Ace O,Mcnamara MG,et al.Prognostic role of platelet to lymphocyte ratio in solid tumors;a systematic review and meta-analysis[J].Cancer Epidem iol Biomarkers Prev,2014,23(7):1204-1212.
[2]Sm ith RA,Bosonnet L,Raraly M,et al.Preoperative platelet-lymphocyte ratio is an independent significant prognostic marker in resected pancreatic ductal adenocarcinoma[J].The American Journal of Surgery,2009, 197(4):466-472.
[3]Kwon HC,Kim SH,Oh SY,et al.Clinical significance of preoperative neutrophil-lymphocyte versus plateletlymphocyte ratio in patients w ith operable colorectal cancer[J].Biomarkers,2012,17(3):216-222.
[4]Tom ita M,Shimizu T,Ayabe T,et al.Preoperative neutrophil to lymphocyte ratio as a prognostic predictor after curative resection for non-small cell lung cancer [J].Anticancer Research,2011,31(9):2995-2998.
[5]Shimada H,Takiguchi N,Kainuma O,et al.High preoperative neutrophil-lymphocyteratio predicts poor survival in patients w ith gastric cancer[J].Gastric Cancer, 2010,13(3):170-176.
[6]Sharaiha RZ,Halazun KJ,M irza F,et al.Elevated preoperative neutrophil:lymphocyte ratio as apredictor of postoperative disease recurrence in esophageal cancer [J].Annals of Surgical Oncology,2011,18(12):3362-3369.
[7]Bhatti I,Peacock O,Lloyd G,et al.Preoperative hematologic markers as independent predictors of prognosis in resected pancreatic ductaladeno carcinoma: neutrophil-lymphocyte versus platelet-lymphocyte ratio [J].The American Journal of Surgery,2010,200(2): 197-203.
[8]Gomez D,Farid S,Malik HZ,et al.Prasad preoperative neutrophil-to-lymphocyte ratio as a prognostic predictor after curative resection for hepatocellular carcinoma[J].World J ournal of S urgery,2008,32(8):1757-1762.
[9]Gomez D,Morris-Stiff G,Toogood GJ,et al.Impact of system ic inflammation on outcome follow ing resection for intrahepatic cholangio carcinoma[J].Journal of Surgical Oncology,2008,97(6):513-518.
[10]Ohno Y,Nakashima J,Ohori M,et al.Pretreatment neutrophil-to-lymphocyte ratio as an independent predictor of recurrence in patients w ith nonmetastatic renal cell carcinoma[J].The Journal of Urology,2010,184 (3):873-878.
[11]Azab B,Bhatt VR,Phookan J,et al.Usefulness of the neutrophil-to-lymphocyte ratio in predicting short-and longterm mortality in breast cancer patients[J].Annals of Surgical Oncology,2012,19(1):217-224.
[12]Cho H,Hur HW,Kim SW,et al.Pre-treatment neutrophil to lymphocyte ratio is elevated in epithelial ovarian cancer and predicts survival after treatment[J].Cancer Immunology Immunotherapy,2009,58(1):15-23.
[13]Asher V,Lee J,Innamaa A,et al.Preoperative platelet lymphocyte ratio as an independent prognostic marker in ovarian cancer[J].Clin Transl Oncol,2011,13(7): 499-503.
[14]Zhang Y,Wang L,Liu Y,et al.Preoperative neutrophil-lymphocyte ratio before platelet-lymphocyte ratio predicts clinical outcome in patients w ith cervical cancer treated w ith initial radical surgery[J].International Journal of Gynecological Cancer,2014,24(7): 1319-1325.
[15]Duan RD,Nilsson A.Metabolism of sphingolipids in the gut and its relation to inflammation and cancer development[J].Progress in Lipid Research,2009,48(1): 62-72.
[16]Paramanathan A,Saxena A,Morris DL.A systematic review and meta-analysis on the impact of pre-operative neutrophil lymphocyte ratio on long term outcomes after curative intent resection of solid tumours[J].Surg Oncol,2014,23(1):31-39.
[17]Qin M,Brummel S,Singh KK,et al.Associations of host genetic variants on CD4+lymphocyte count and plasma HIV-1 RAN in antiretroviral naïve children[J].Pediatr Infect Dis J,2014,33(9):946-952.
[18]Mahmoud SM,Paish EC,Powe DG,et al.Tumor-infiltrating CD8 lymphocytes predict clinical outcome in
breast cancer[J].JClin Oncol,2011,29(15):1949-955.
[19]Coussens LM,Werb Z.Inflammation and cancer[J]. Nature,2002,420(6917):860-867.
[20]Shimada H,Oohira G,Okazum i S,et al.Thrombocytosis associated w ith poor prognosisin patients w ith esophageal carcinoma[J].JAm CollSurg,2004,198(5): 737-741.
[21]Ikeda M,Furu e kawa H,Imamura H,et al.Poor prognosis associated w ith thrombocytosis in patients w ith gastric cancer[J].Ann Surg Oncol,2002,9(3):287-291.
[22]Mousa SA.Antithrombotics in thrombosis and cancer [J].Expert Rev Cardiovasc Ther,2003,1(2):283-291.
[23]Smith RA,Bosonnet L,Ghaneh P,et al.The plateletlymphocyte ratio improves the predictive value of serum CA19-9 levels in determ ining patient selection for staging laparoscopy in suspected periampullary cancer[J].Surgery,2008,143(5):658-666.
[24]Garcia-Rodriguez LA,Huerta-Alvarez C.Reduced risk of colorectal cancer among long-term users of aspirin and nonaspirinn on steroidalanti inflammatory drugs[J]. Epidem iology,2001,12(1):88-93
[25]Langman MJ,Cheng KK,Gilman EA,et al.Effect of anti-inflammatory drugs on overall risk of common cancer:case-control study in general prac tice research database[J].British Medical Journal,2000,320(7250): 1642-1646.
[26]Perez DR,Baser RE,Cavnar MJ,et al.Blood Neutrophil-to-lymphocyte ratio is prognostic in gastrointestinal stromal Tumor[J].Surgical Oncology,2013,20 (2):593-599.
[27]Kishi Y,Kopetz S,Chun YS,et al.Blood neutrophilto-lymphocyte ratio predicts survival in patients with colorectal liver metastases treated w ith systemic chemotherapy[J].Surgical Oncology,2009,16(13): 614-622.
Effect of NLR and PLR from pre-treatment on the prognosis of patients w ith cervical squamous cell carcinoma
GUO Xu1,XIE Hongzhe2★,KE Zunfu3
(1.Physical Exam ination Center,the First Affiliate Hospital of Sun Yat-Sen University,Guangzhou,Guangdong,China,510080;2.The Department of Obstetrics and Gynecology,the First A ffiliate Hospital of Sun Yat-Sen University,Guangzhou,Guangdong,China,510080;3.The Department of Pathology,the First Affiliate Hospital of Sun Yat-Sen University,Guangzhou,Guangdong,China,510080)
Objective To investigate the correlation between neutrophil-to-lymphocyte ratio(NLR) and platelet-to-lymphocyteratio(PLR)from pre-treatment and clinical parameters including overall survival (OS),disease-free survival(DFS)and clinical pathologic factors in the patients with cervical squamous cell carcinoma.Methods In this retrospective analysis from January 1,2005 to December 31,2009,143 cases of cervical squamous carcinoma patients were collected,which were firstly treated and undergone surgery in the first affiliated hospital of Sun Yat-sen university.According to the statisticalmethods,the patients were
Neutrophil-to-lymphocyte ratio(NLR);Platelet-to-lymphocyte ratio(PLR);Cervical squamous cell carcinoma;Overall survival(OS);Disease-free survival(DFS)
国家自然科学基金(81372501)
1.中山大学附属第一医院体检中心,广东,广州510080 2.中山大学附属第一医院妇产科,广东,广州510080 3.中山大学附属第一医院病理科,广东,广州510080
★通讯作者:谢洪哲,E-mail:67477528@qq.com
divided into different groups based on the cut-off value of NLR or PLR.Then the relationship between NLR and PLR w ith the survival and recurrence situation of patients and the the factors of clinical and pathological were analyzed.Results NLR=2.8 and PLR=125 were selected as the cut-off value.The 5-year survival rate of high NLR group is 30.3%,while the 5-year survival rate of low NLR group is 80%,and the difference was statistically significant(P=0.000).The recurrence rate of high NLR group is 69.7%,while in low NLR group is 24.5%,and the difference was statistically significant(P=0.000).The 5-year survival rate of high PLR group is 53.7%,while the 5-year survival rate of low PLR group is 81.6%,and the difference was statistically significant(P=0.000).The recurrence rate of high PLR group is 50%,while in low NLR group is 22.4%,and the difference was statistically significant(P=0.000).Univariate analysis and Cox regression analysis all showed that International Federation of Gynecology and Obstetrics(FIGO)stage,preoperative chemotherapy,the tumor size,platelet(PLT),NLR and PLR are all independent prognostic factors for overall survival rate and disease-free survival rate in cervical squamous cell carcinoma patients.Conclusion NLR and PLR values from pre-treatment are independent prognostic factor for cervical squamous cell carcinoma patients,respectively.
