c-Kit+Lin-细胞移植改善急性肝损伤的实验研究
2015-12-14张守华杨慎华杨文萍徐红艳雷俊黄慧刘志强陶强
张守华杨慎华杨文萍徐红艳雷俊黄慧刘志强陶强★
·论著·
c-Kit+Lin-细胞移植改善急性肝损伤的实验研究
张守华1杨慎华2杨文萍3徐红艳3雷俊1黄慧3刘志强3陶强1★
目的探讨骨髓c-Kit+Lin-(CD117)细胞移植治疗小鼠急性肝损伤的效果以及机制,为骨髓源性肝干细胞的临床应用提供实验依据。方法18只成年BALB/c小鼠随机分为正常组、实验组和干细胞移植组,正常组不予任何处理,模型组小鼠腹腔注射CCl4后仅输入生理盐水,移植组小鼠在腹腔注射CCl4后尾静脉输注骨髓CD117细胞(1×106),48 h后观察各组小鼠肝功能水平变化,苏木素-伊红(hematoxylin-eosin,HE)染色分析肝脏病理学改变,免疫组化检测肝脏细胞增殖情况。结果模型组腹腔注射CCl4后肝功能严重受损,血清谷丙转氨酶(alanine transam inase,ALT)、谷草转氨酶(glutam ic oxalacetic transaminase,AST)、胆红素(bilirubin)等升高,肝脏的HE染色可见片状坏死,炎症细胞浸润;移植组小鼠移植干细胞48 h后小鼠肝功能有所恢复,病理提示肝脏坏死区域有所减小,Ki67免疫组化提示干细胞可促进肝脏再生。结论经尾静脉注入的骨髓来源的CD117干细胞能改善急性肝损伤肝功能以及修复受损肝脏,是治疗急性肝损伤的一种安全有效的方法。
骨髓c-Kit+lin-细胞;肝干细胞;急性肝损伤
众多学者已经证实骨髓来源的干细胞可分化为肝细胞、胆管细胞等[1]。本课题组总结以往的研究成果,并结合自己的前期研究,发现在骨髓干细胞群中c-kit+Lin-(CD117)干细胞群具有很强的向肝细胞分化的能力[2-3],并且已经在以往的实验中发现可以分化为肝细胞并且改善肝纤维化小鼠的肝功能以及肝纤维化病变程度。但是CD117细胞是否可以改善急性肝损伤目前报道较少。本实验采用CCl4建立急性肝损伤模型,探讨移植CD117细胞是否有改善肝损伤作用以及机制。
1 材料与方法
1.1 免疫磁珠法分离骨髓c-kit+Lin-细胞
取10只Balb/c小鼠,无特殊病原体(specific pathogen free,SPF)级,5周龄~6周龄、体质量15 g~18 g,购自南昌大学实验动物中心。小鼠颈椎脱臼处死,置75%的乙醇浸泡15m in;无菌取出解剖双侧股骨,离断两端骨骺,PBS反复冲洗骨髓腔;细胞悬液吹打后加入红细胞裂解液6m L,30μm 400目尼龙膜过滤,获取细胞悬液。利用德国M iltenyi Biotec公司lin-细胞单抗分离系统先分离富集lin-细胞,在此基础上再阳性分选出c-kit+细胞,最后富集得到CD117细胞。分离方法按c-kit+以及Lin-试剂盒(德国M iltenyi Biotec公司)说明书进行。利用FACSCalibur流式细胞仪(美国BD公司)检测分选的CD117细胞,其纯度为90%以上,台盼蓝染色细胞活力超过95%。
1.2 实验动物和分组
小鼠急性CCl4肝损伤模型的建立:取BALB/c小鼠18只,雌雄各半,自由饮水及进食。采用橄榄油作溶剂,将CCl4溶于橄榄油中,配成10%(V/V)CCl4橄榄油。
小鼠随机分为3组,每组6只:正常组仅仅腹腔注射300μL/kg橄榄油;模型组腹腔注射10% CCl4300μL/kg;移植组腹腔注射10%CCl4300 μL/kg后1 h给予尾静脉注射新鲜分选的CD117细胞,移植数量为1×106/只。
1.3 移植后的观察
移植后48 h,取各组小鼠肝组织行常规组织病理学检查苏木素-伊红(hematoxylin-eosin,HE)染色,同时眼球取血检测小鼠血清丙氨酸氨基转移酶(alanine transam inase,ALT)、天门冬氨酸氨基转移酶(glutam ic oxalacetic transam inase,AST)、白蛋白(album in,ALB)、总胆红素(total bilirubin,TBIL)等肝功能指标。
免疫组织化学法检测Ki67:肝组织切片厚度4μm,常规脱蜡至水化,微波对抗原修复,5%的羊血清封闭非特异性蛋白,加Ki67第一抗体,37℃恒温孵育30m in,再置4℃冰箱过夜;加第二抗体,37℃恒温孵育30m in;采用链霉菌抗生物素蛋白-过氧化物酶连结法(streptavidin-perosidase,SP),DAB显色,阳性染色的细胞为棕黄色或棕褐色。用光学显微镜观察Ki67在肝组织中的分布情况以及表达指数:取3张不连续切片,每张切片随机选取10个视野,计数每个视野中的阳性细胞和总细胞数,取其均值,计算Ki67阳性表达指数,即阳性细胞数/总细胞数×100%。
1.4 统计学处理
应用SPSS 19.0统计软件进行统计分析。所有数据以均数±标准差表示。各组间数据的比较采用完全随机设计资料的多个样本均数比较。方差不齐时采用Tamhane检验。P≤0.05表示差异有统计学意义。
2 结果
2.1 组织病理学变化
正常组小鼠肝脏颜色为暗红色,表面光滑,有光泽,HE染色可见肝细胞以中央静脉为中心呈放射状排列,结构清晰,未见炎性细胞浸润,肝索排列整齐(图1)。模型组小鼠肝脏肝HE染色可见肝细胞片状坏死(箭头所示),细胞索紊乱,肝小叶中心带肝细胞胞浆肿大疏松,脂肪样变,炎性细胞浸
润(图2)。移植CD117细胞48 h后,HE染色可见移植组小鼠肝脏坏死区域减小,肝细胞形态有所恢复,气球样变性减轻(图3)。
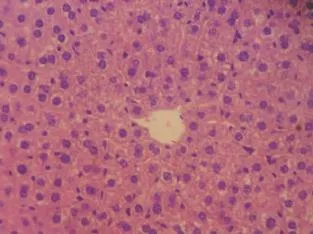
图1 正常组小鼠肝组织(HE×400)Figure 1 Liver tissue of normal group(HE×400)

图2 模型组小鼠肝组织(HE×200)Figure 2 Liver tissue ofmodel group(HE×200)

图3 移植组小鼠肝组织(HE×200)Figure 3 Liver tissue of transplantion group(HE×200)
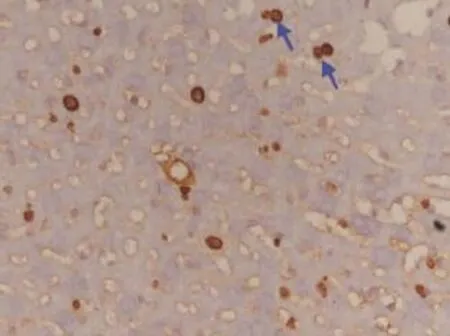
图4 移植组肝组织ki67的表达(×400)Figure 4 Ki67 in liver of transplantion group(×400)
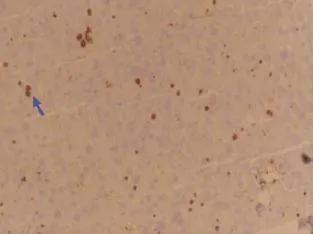
图5 正常组肝组织ki67的表达(×200)Figure 5 Ki67 in liver of normalgroup(×200)

图6 模型组肝组织ki67的表达(×200)Figure 6 Ki67 in liver ofmodel group(×200)
2.2 肝功能变化
移植48 h后移植组与模型组相比,肝功能均有改善,AST、ALT、ALB以及TBIL均有所恢复(表1)。

表1 肝功能相关指标的变化Table1 The changes of liver function related indices
2.3 Ki67蛋白在各组肝组织中的表达
Ki67阳性表达定位于细胞核,呈棕黄色颗粒,细胞膜、细胞浆均不染色。免疫组化结果显示移植组(图4)ki67的表达指数(4.0±1.0)明显高于正常组(0.9±0.2)(P=0.001)(图5)以及模型组(1.9± 0.4)(P=0.005)(图6)。
3 讨论
自从骨髓中的干细胞能够在体内外分化成为肝细胞的现象被发现之后,越来越多的研究证实了肝脏干细胞在治疗肝脏疾病的有效性[3]。CD117细胞即为骨髓衍生肝干细胞(bonemarrow derived liverstem cells,BMDLSC),我们在以往干细胞治疗肝纤维化的前期工作已经初步证实了c-kit+Lin-(CD117)细胞向肝细胞分化的能力较强,移植入肝纤维化模型鼠体内可以改善病变过程,在一定程度上能恢复肝功能。本实验将CD117细胞移植入急性肝损伤小鼠体内,观察其对急性肝损伤是否有治疗效果。
目前,CCl4诱导的小鼠急性肝衰竭是国内外学者普遍认可和使用的动物模型。CCl4对肝脏毒性作用的机制复杂,与氧化应激和脂质过氧化反应有关。当CCl4进入肝细胞后,经过细胞色素P450酶代谢激活,产生三氯甲基自由基(CCl3-)和过氧化三氯甲基自由基(OOCCl3-),这些自由基与肝细胞膜、内质网和线粒体上的磷脂分子发生共价结合,引发脂质过氧化反应损害膜的结构和功能以及钙泵的活性,引起能量代谢障碍,导致细胞损伤[4-5]。细胞损伤坏死刺激炎症细胞募集,释放炎性介质,进一步损伤肝细胞。膜结构的破坏使胞内的转氨酶ALT、AST溢出,使血浆中的ALT、AST等升高,在一定程度上反映了肝细胞的损伤程度[6-7]。本实验运用CCl4腹腔注射建立小鼠急性肝损伤模型,注射后小鼠转氨酶明显升高,实验结果显示建模成功。
Ki67是一种与细胞分裂及增殖有关的蛋白,只在增殖细胞中表达,定位于细胞核,参与细胞周期调控,可准确反映细胞的增殖情况。Ki67基因定位于第10号染色体的长臂(10q25)上,其表达出现在G1中期到晚期,在S期和G2期逐渐增加,且有丝分裂达到高峰,离开增殖周期后迅速降解或者抗原决定簇丢失,在G0期消失[8]。由于Ki67半衰期短,仅1 h或更短,能有效地检测细胞的增殖活性与水平,出现假阴性或假阳性的概率较低[9]。因此本实验采用Ki67作为肝脏损伤后肝脏再生、修复的一个重要指标。
在本研究中,考虑到免疫排斥因素,供体和受体均采用近交系的BALB/c小鼠,移植途径选择从尾静脉注入,移植过程安全、方便。移植组在接受CD117细胞移植后,结果显示肝功能与模型组相比有所恢复,AST和ALT均下降,ALB有所升高。腹腔注射CCl4后,模型小鼠肝脏病理可见众多区域的片状坏死,炎症细胞浸润,肝细胞胞浆气球样变;而移植组小鼠肝脏片状坏死区域减小,肝细胞结构有所恢复,ki67免疫组化也显示移植组阳性率明显高于模型组,提示移植的CD117干细胞可促进肝脏再生。我们的前期研究提示,CD117细胞体内移植后,需要一周以上的时间才能分化为肝样细胞,本实验移植时间仅仅48 h,由此推论其改善肝功能并非通过定向分化这条途径。我们推测肝细胞坏死以及炎性细胞浸润所释放的炎性介质促使CD117细胞归巢于肝脏,在肝脏定居后分泌细胞因子如肝细胞生长因子、表皮生长因子等从而促进肝脏再生。有文献报道来源于脂肪的间充质干细胞可分泌IL-18保护CCl4诱导的肝脏损伤[10],CD117细胞刺激肝细胞的再生其机制需要进一步研究。
急性肝损伤是短期时间内由于各种因素如用药不当、病毒、肝脏缺血再灌注、食物添加剂、乙醇摄入过多及接触、食入有毒食物、放射性损伤等诱发的肝细胞变性坏死,表现为转氨酶的升高,白蛋白下降,可导致肝脏不可逆的损伤,严重的可合并肝肾综合征、肝性脑病,凝血功能障碍,甚至导致个体死亡[11]。近年来干细胞的研究在生物医学领域中取得的进展为肝脏疾病的治疗提供了新的契机。本实验所研究的CD117干细胞为造血干细胞的一种,肝脏与造血之间存在天然的内在联系,在胚胎发育过程中,胎肝是主要的造血器官,也是造血干细胞生存的场所,已有众多实验证实造血干细胞向肝细胞横向分化是可行的[12]。骨髓中存在着与肝脏相同标志的干细胞如c-Kit、CD34、Thy-1+等[13-14],本实验所研究的CD117细胞即是此类细胞的一种,发现其有效的辅助治疗了急性肝损伤,为肝脏疾病的治疗开辟了新的领域。
[1]Krause DS,Theise ND,Collector M I,et al.Multi-organ,multi-lineage engraftment by a single bone marrow-derived stem cell[J].Cell,2001,105(3):3692377.
[2]唐浩,廖彩仙,周杰,等.小鼠c-Kit+Lin-骨髓细胞移植生成肝细胞的实验研究[J].南方医科大学学报,2006, 26(5):567-569.
[3]张守华,肖菊花,邓庆强,等.骨髓c-Kit+Lin-细胞移植改善肝纤维化的实验研究[J].中国普通外科杂志, 2012,21(7):821-824.
[4]朱安妮,李蕊,刘三海,等.四氯化碳诱导小鼠急性肝损伤模型的建立和优化[J].中国肝脏病杂志(电子版), 2014,6(1):27-31.
[5]Lin JC,Peng YJ,Wang SY,et al.Role of the sympathetic nervous system in carbon tetrachloride-induced hepatotoxicity and system ic inflammation[J].Plos One, 2015,10(3):e0121365.
[6]Lin X,Huang R,Zhang S,et al.Methyl helicterate protects againstCCl4-induced liver injury in rats by inhibiting oxidative stress,NF-κB activation,Fas/FasL pathway and cytochrome P4502E1 level[J].Food Chem Toxicol,2012,50(10):3413-3420.
[7]Liu H,Wang Z,Now icki MJ,et al.Caspase-12 mediates carbon tetrachloride-induced hepatocyte apoptosis in m ice[J].World JGastroenterol,2014,20(48):18189-18198.
[8]张继屏,范静平,邓月,等.Ki67和nm23蛋白在鼻咽癌中的表达及临床意义[J].中国眼耳鼻喉科杂志,2015, 15(1):20-24.
[9]Bridger JM,Kill IR,Lichter P.Association of pKi-67 w ith satellite DNA of the human genome in early G1 cells[J].Chromosome Res,1998,6(1):13-24.
[10]Deng L,Liu G,Wu X,et al.Adipose derived mesenchymal stem cells efficiently rescue carbon tetrachloride-induced acute liver failure in mouse[J].Scientific World Journal,2014,2014:103643.
[11]Shalimar,Acharya SK.Management in acute liver failure[J].J Clin Exp Hepatol,2015,5(Suppl 1):S104-115.
[12]M ichalopoulos GK,Khan Z.Liver stem cells:Experimental findings and implications for human liver disease[J].Gastroenterology,2015,doi:10.1053/j.gastro. 2015.08.004.[Epub ahead of print].
[13]Fiegel HC,Lioznov MV,Cortes-Dericks L,et al.Liver-specific gene expression in cultured human hematopoietic stem cells[J].Stem Cells,2003,21(10: 98-104.
[14]Lagasse E,Connors H,A l-Dhalimy M,et al.Purified hematopoietic stem cells can differentiate into hepatocytes in vivo[J].Nat Med,2000,6(11):1229-1234.
The study of transp lantation of c-Kit+Lin-cell for treatment of acute liver injure
ZHANG Shouhua1,YANG Shenhua2,YANG Wenping3,XU Hongyan3,LEI Jun1,HUANG Hui3,LIU Zhiqiang3,TAO Qiang1★
(1.Department of General Surgery,Children’s Hospital of Jiangxi Province,Nanchang,Jiangxi,China,330006;2.Institute of Occupational Medicine of Jiangxi Province,Nanchang,Jiangxi,China,330006;3.Department of Pathlogy,Children’s Hospital of Jiangxi Province,Nanchang,Jiangxi,China,330006)
Objective To investigate the effects of bone marrow c-Kit+lin-cell(CD117)transplantation on acute liver injury micemodel and provide experimental basis for clinical application.Methods 18 BALB/c mice were random ly divided into 3 groups:normal group,experiment group and stem cell transplantation group.In normal group,the m ice did not give any processing.In experiment group,the CCl4was injected intraperitoneally,and then infused saline.In stem cell transplantation group,the m ice injected bone marrow CD117 cell(1×106)via tail vein after CCL4intraperitoneal injection.The liver functional was measured after 48 hours.The liver histologic changes were assessed by hematoxylin-eosin(HE)staining.The hepatocyte proliferation was assessed by immunohistochem ical.Results The liver functional of experiment group was severely damaged after CCL4intraperitoneal injection.The expressions of alanine transaminase(ALT),glutam ic oxalacetic transam inase(AST)and bilirubin in experiment group increased.The HE staining revealed extensive hepatocellular necrosis in mice subjected to CCL4intraperitoneal injection.In stem cell transplantation group.The liver function was recovered after 48h of stem cell transplantation,and the
Bonemarrow c-Kit+Lin-cell;Hepatic stem cell;Acute liver injury
江西省卫生厅科技计划(20155568);江西省科技支撑计划项目(20112BBG70069)
1.江西省儿童医院普外科,江西,南昌330006 2.江西省职业病防治研究院,江西,南昌330006 3.江西省儿童医院病理科,江西,南昌330006
★通讯作者:陶强,E-mail:taoqiang_2008@126.com
area of necrosis was significantly lower.The Ki67 expressions indicated the stem cell can improve hepatocyte proliferation.Conclusion Inject bonemarrow CD117 cell via tail vein can protect the liver from acute liver injury and repair the damaged liver.It can be considered as a therapeutic option to prevent acute liver injury.
