NDRG1与E-cadherin下调表达及其与胃癌淋巴结转移的关系研究
2015-12-14廖爱辉刘展雷志胜
廖爱辉刘展雷志胜
·论著·
NDRG1与E-cadherin下调表达及其与胃癌淋巴结转移的关系研究
廖爱辉1刘展2★雷志胜3
目的探讨NDRG1和E-cadhein基因mRNA表达与胃癌淋巴结转移关系。方法收集51例液氮保存的新鲜原发性胃癌组织和33例淋巴结转移的胃癌,Trizol常规方法提取组织总RNA。在将这些总RNA逆转录成cDNA后,利用实时荧光定量PCR检测NDRG1和E-cadhein基因在这两种组织中的表达情况,统计分析它们表达变化与胃癌淋巴结转移的关系。结果与原发性胃癌组织相比,NDRG1与E-cadhein mRNA在淋巴结转移的胃癌组织中表达下调,且两者表达明显呈正相关性。结论降低的NDRG1和E-cadhein基因表达与胃癌的淋巴结转移密切相关。
NDRG1;E-cadherin;胃癌;荧光定量PCR
胃癌是我国常见的恶性肿瘤之一,其发病率居各类肿瘤的前列[1]。该疾病是一种严重威胁人类身体健康的疾病,其发病原因不明,可能与多种因素,如饮食种类、环境因素、遗传素质、以及长期幽
门螺杆菌(helicobacter pylori,HP)感染等有一定的关系。胃正常黏膜在这些因素共同作用下,其细胞内基因表达会发生异常的改变,特别是瘤基因的激活和抑瘤基因的失活,最终会导致肿瘤的发生。
NDRG1是转录因子v-myc禽髓细胞瘤病毒癌基因神经母细胞瘤衍生同系物(v-myc avian myelocytomatosis viral oncogene neuroblastoma derived homolog,N-MYC)的下游调节基因,在肿瘤中主要受其抑制而下调表达。NDRG1在多种肿瘤组织中表达明显减低。最近,Jiang发现该基因在胃癌中表达也明显下调[2],提示NDRG1参与了胃癌的发病过程。E-Cadherin是一个上皮间充质转化标志基因,其在肿瘤侵袭转移过程中也常常发生表达下调,包括胃癌[3-5]。在以往的研究中,虽有报道显示这两个基因与胃癌转移有一定的关系,但很少有使用原发性胃癌组织以及淋巴结转移胃癌组织探讨这两个基因在胃癌中转移的作用,且鲜有研究报道两者在胃癌淋巴结转移过程中的表达相关性。
1 材料与方法
1.1 组织标本
51例原发性胃癌组织和33淋巴结转移性胃癌来自于中南大学湘雅二医院2012年3月到2013年5月收集的液氮保存标本。该组病人年龄在31到76岁之间,中位年龄52.2岁。其病理类型都为腺癌。
1.2 主要试剂
逆转录试剂盒及实时荧光定量PCR试剂盒购自日本Takara公司,Trizol购自美国Invitrogen公司。
1.3 引物设计
在线Primer-blast工具设计NDRG1和E-cadherin基因荧光定量PCR引物,NDRG1上游引物:5′-GTTCTGGAGGTCGGGAAGGG-3′,NDRG1下游引物:5′-CCAAAGGCTTCACCTCAGCG-3′,全长201 bp。E-cadherin上游引物:5′-AAGAGAGTG GAAGTGTCCGA-3′,E-cadherin下游引物:5′-GAT CAGCAGAAGTGTCCCTG-3′,全长282 bp。内参照引物为Beta Actin,上游引物:5′-CACCCAGCACAATGAAGAT-3′,下游引物:5′-CAAATAAAGC CATGCCAAT-3′,全长255 bp。引物由上海英骏公司合成。
1.4 RNA提取及逆转录
常规Trizol提取总RNA,总RNA随即被逆转录成cDNA,反应条件如下:总RNA 1μg,2μL dNTPm ix(10mmol/L),2μL oligo(dT)18(0.5μg/μL),添加无RNA酶的去离子水13.5μL,混匀,离心。70℃变性5m in,室温静置2m in。然后依次添加4μL 5×Buffer,1μL 0.1 M DTT,0.5μL RNase inhibitor(40 U/μL),1μL逆转录酶(200 U/μL),混匀,离心,放入42℃水浴中反应1h,95℃灭活5m in。-20℃冷冻备用。
1.5 表达检测
应用实时荧光定量PCR在胃癌组织中扩增NDRG1和E-cadherin基因,反应体系为SYBR Prem ix Ex(2×)10μL,上下游引物(10μmol)各0.4 μL、ROX Reference DyeⅡ(50×)0.4μL、cDNA模板1μL和灭菌去离子水7.8μL,共20μL。反应条件如下:94℃变性2m in;94℃变性10 s,55℃退火10 s,72℃延伸15 s,45个循环;最后,产物在72℃延伸5min,溶解曲线分析。实验重复3次。
1.6 实验数据处理及分析
采用SPSS 11.5统计分析软件包进行数据处理。在本研究中,我们基于目的基因和看家基因实时荧光定量扩增曲线得到Ct(C:循环周期,Cycle;t:阈值,threshold)值,通过ΔCT=Ct目的基因-Ct内参基因公式,计算出目的基因相对于看家基因的表达强度。ΔΔCt=ΔCt(肿瘤样品)-ΔCt(正常样品)。目的基因相对肿瘤为2-ΔΔCt,当>1的时候,目的基因表达上调,反则下调。基因表达相关系分析采用Bivariate程序进行分析。
2 结果
2.1 RNA提取
对样品总RNA行260/280的比值检测,样品基本上都在1.7~2.1之间,这表明这些提取的总RNA质量基本合格,可用于下一步实验(见图1)。
2.2 NDRG1在淋巴结转移胃癌中表达降低
我们利用实时荧光定量PCR检测了NDRG1在原发性胃癌组织与淋巴结转移的胃癌组织中表达(图2)。结果显示,与原发性胃癌组织相比,NDRG1在淋巴结转移的胃癌组织中表达明显下调(P=0.0097)(图3)。

图1 1%琼脂糖凝胶RNA电泳图Figure 1 1%agarose gel electrophoresismap of RNA

图2 NDRG1实时荧光定量PCR检测图Figure 2 The exam ination map of real-time quantitative PCR of NDRG1
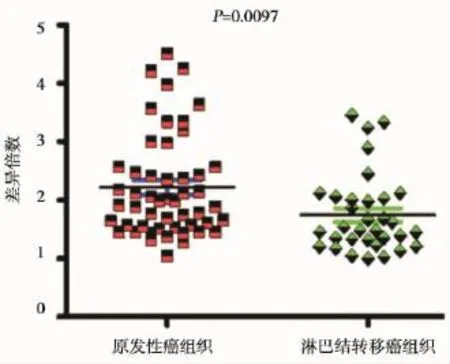
图3 NDRG1基因在原发性胃癌组织和淋巴结转移胃癌组织中差异表达Figure 3 Differential expression of NDRG1 between primary gastric samples and gastric cancer tissues of lymphonode metastasis
2.3 E-cadherin在淋巴结转移胃癌中表达降低
我们利用实时荧光定量PCR检测了E-cadherin在原发性胃癌组织与淋巴结转移的胃癌组织中表达(图4)。结果显示,与原发性胃癌组织相比,E-cadherin在淋巴结转移的胃癌组织中表达明显下调(P=0.014)(图5)。

图4 E-cadherin实时荧光定量PCR检测图Figure 4 The examination map of real-time quantitative PCR of E-cadherin
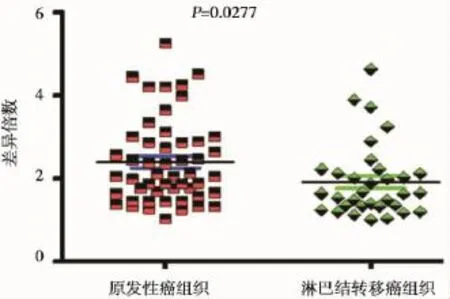
图5 E-cadherin基因在原发性胃癌组织和淋巴结转移胃癌组织中差异表达Figure 5 Differential expression of E-cadherin between primary gastric samples and gastric cancer tissues of lymphonodemetastasis
2.4 NDRG1与E-cadherin淋巴结转移胃癌组织中呈表达正相关性
为了进一步明确NDRG1与E-cadherin基因在淋巴结转移胃癌组织中表达降低可能存在协同作用,我们利用SPSS软件Bivariate程序分析了2
个基因在淋巴结转移的胃癌组织中表达相关性。结果显示,其表达相关系数r=0.857,P<0.001,这表明了NDRG1与E-cadherin表达呈正相关性(图5),提示了它们在胃癌转移过程中发挥了协同作用。
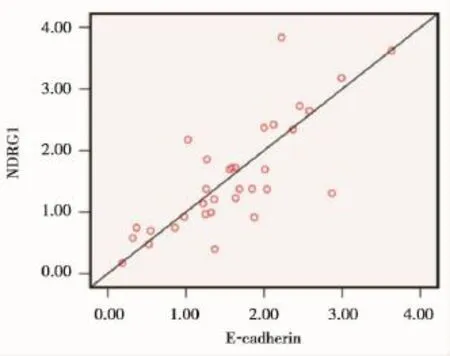
图6 NDRG1在淋巴结转移胃癌组织中与E-cadherin表达相关性分析Figure 6 The expression correlation analysis of NDRG1 w ith E-cadherin in gastric cancer tissues of lymphonode metastasis
3 讨论
胃癌是最常见的恶性肿瘤之一,在消化系肿瘤发病中位居第一,其发病年龄多在40岁以上,男性多于女性[1]。胃癌的发病与其基因调节紊乱密切相关[6]。
NDRG1基因定位于人染色体8q24.3,长约60 kb,其mRNA全长约3 kb,编码蛋白产物含有394个氨基酸,分子质量为43 kd。NDRG1最初是在NMYC敲除的小鼠胚胎组织中发现的,它受NMYC的抑制而得名。该基因被多个学者通过差异显示法相继独立发现和分离[7]。最近的研究显示,该基因在前列腺癌[8]、胃癌[2]和结肠癌[9]中表达下调。将NDRG1 cDNA导入转移性结肠癌细胞系SW 620中,观察到原先高转移性的结肠癌细胞系SW 620体外侵袭能力明显下降;将其种植到裸鼠体内,肝脏转移能力也明显降低,这提示NDRG1基因参与了结肠癌的转移过程[10]。
E-cadherin基因定位于16q22.1染色体上,是一种钙依赖性细胞粘附分子,存在于正常上皮细胞中以维持组织正常形态,这对于保持细胞完整性,防止肿瘤细胞离散、脱落起着很重要的作用。E-cadherin基因作为细胞上皮向间质转化关键基因,其表达降低提示肿瘤细胞开始发生转移[11]。在以往研究中,已有不少报导显示E-cadherin在胃癌组织中表达下调促进了胃癌发病过程[12-13],但这些研究基本上都是基于原发性胃癌标本进行研究。
有意思的是,在最新的研究中已经发现,在口腔鳞状细胞癌、过表达的NDRG1基因前列腺癌以及大肠细胞中能通过抑制β-catenin上调E-cad herin表达,从而抑制肿瘤发病侵袭和转移[14-15]。而在口腔鳞状细胞癌中,NDRG1也能正向调节E-cadherin,从而抑制肿瘤细胞的转移[16]。以上这些研究提示,NDRG1和E-cadherin在肿瘤发病过程中发挥了协同作用,从而抑制发病过程中。
在本次研究中,为了明确NDRG1与E-cadherin是否参与了胃癌转移,我们首先利用实时荧光定量PCR对这两个基因在原发性胃癌与淋巴结转移的胃癌组织中的表达进行了检测。结果显示,与原发性胃癌组织相比,NDRG1与E-cadherin在淋巴结转移的胃癌组织中表达都明显下调,提示它们与胃癌淋巴结转移密切相关。进一步,为了明确NDRG1与E-cadherin是否协同参与了胃癌淋巴结转移,我们分析了NDRG1与E-cadherin在淋巴结转移的胃癌组织表达相关性。与预期相符,NDRG1 mRNA是明显正向相关于E-cadherin mRNA的表达,该结果类似于Chang等研究报告[17]。他们发现,在胃癌转移过程中,下调的NDRG1蛋白表达与E-cadherin蛋白表达呈正向相关。我们的研究进一步支持NDRG1和E-Cadherin在胃癌中丢失的表达与胃癌转移密切相关,只是具体的调控机理还有待进一步研究。
综上所述,NDRG1和E-cadherin作为胃癌转移的标志物,在胃癌淋巴结转移组织中表达呈正相关性,且它们下调的表达与胃癌淋巴结转移密切相关。
[1]邹小农,孙喜斌,陈万青,等.2003-2007年中国胃癌发病与死亡情况分析[J].肿瘤,2012,32(2):109-114.
[2]Jiang K,Shen Z,Ye Y,et al.A novelmolecularmarker for early detection and evaluating prognosis of gastric cancer:N-MYC downstream regulated gene-1(NDRG1) [J].Scand JGastroenterol,2010,45(7-8):898-908.
[3]Nilsson GM,Akhtar N,Kannius-Janson M,et al.Loss of E-cadherin expression is not a prerequisite for c-erbB2-induced epithelial-mesenchymal transition[J]. Int JOncol,2014,45(1):82-94.
[4]Schildberg CW,Abba M,Merkel S,et al.Gastric cancer patients less than 50 years of age exhibit significant downregulation of E-cadherin and CDX2 compared to older reference populations[J].Adv Med Sci,2014,59 (1):142-146.
[5]Kim EY,Kim A,Kim SK,et al.Inhibition ofmTORC1 induces loss of E-cadherin through AKT/GSK-3βsignaling-mediated upregulation of E-cadherin repressor complexes in non-small cell lung cancer cells[J].Respir Res,2014,15:26.
[6]Kang W,Tong J,Lung R,et al.Targeting of YAP1 by m icroRNA-15a and microRNA-16-1 exerts tumor suppressor function in gastric adenocarcinoma[J].Mol Cancer,2015,14(1):52.
[7]Shimono A,Okuda T,Kondoh H.N-MYC-dependent repression of ndr1,a gene identified by direct subtraction of wholemouse embryo cDNAs between w ild type and N-MYCmutant[J].Mech Dev,1999,83(1-2):39-52. [8]Song Y,Oda Y,Hori M,et al.N-MYC downstream regulated gene-1/Cap43 may play an important role in malignant progression of prostate cancer,in its close association w ith E-cadherin[J].Hum Pathol,2010,41(2): 214-222.
[9]Strzelczyk B,Szulc A,Rzepko R,et al.Identification of high-risk stage II colorectal tumors by combined analysis of the NDRG1 gene expression and the depth of tumor invasion[J].Ann Surg Oncol,2009,16(5):1287-1294.
[10]Guan RJ,Ford HL,Fu Y,et al.Drg-1 as a differentiation-related,putativemetastatic suppressor gene in human colon cancer[J].Cancer Res,2000,1(60):749-755.
[11]von Zeidler SV,de Souza BT,Mendon a EF,et al. E-cadherin as a potential biomarker of malignant transformation in oral leukoplakia:a retrospective cohort study[J].BMC Cancer,2014,14(1):972.
[12]Jin R,Liu W,Menezes S,et al.The metastasis suppressor NDRG1 modulates the phosphorylation and nuclear translocation ofβ-catenin through mechanisms involving FRAT1 and PAK4[J].JCell Sci,2014,127(Pt 14):3116-3130.
[13]Ferrari-AmorottiG,Chiodoni C,Shen F,et al.Suppression of invasion and metastasis of triple-negative breast cancer lines by pharmacological or genetic inhibition of slug activity[J].Neoplasia,2014,16(12):1047-1058.
[14]Lee JC,Chung LC,Chen YJ,et al.N-MYC downstream-regulated gene 1 downregulates cell proliferation, invasiveness,and tumorigenesis in human oral squamous cell carcinoma[J].Cancer Lett,2014,355(2):242-252.
[15]Murai T,Yamada S,Fuchs BC,et al.Epithelial-to-mesenchymal transition predicts prognosis in clinical gastric cancer[J].JSurg Oncol,2014,109(7):684-689.
[16]Wang ZS,Shen Y,Li X,et al.Significance and prognostic value of Gli-1 and Snail/E-cadherin expression in progressive gastric cancer[J].Tumour Biol,2014,35(2): 1357-1363.
[17]Chang X,Xu X,Ma J,etal.NDRG1 expression is related to the progression and prognosis of gastric cancer patients throughmodulating proliferation,invasion and cell cycle of gastric cancer cells[J].Mol Biol Rep,2014,41 (9):6215-6223.
The relationship study between the down expression of NDRG1 and E-cadherin w ith lym phonode metastasis in gastric cancer
LIAO Aihui1,LIU Zhan2★,LEIZhisheng3
(1.The First Surgical Department,the Geology and M ineral Hospital of Hunan Province,Changsha,Hunan,China,410000;2.Medical Department of Digestion,People’s Hospital of Hunan Province,Changsha,Hunan,China,410000;3.General Surgical Department,the Center Hospital of Changsha City,Changsha,Hunan,China,410000)
Objective To explore the relationship between the down expression of NDRG1 and E-cadherin mRNA w ith the lymphonode metastasis in gastric cancer.Methods Total RNAs of 51 primary fresh gastric samples and 33 gastric cancer samples spreading to lymphonode were extracted by routine Trizol way.Then total RNAs were transcripted into cDNAs,and the expressions of NDRG1 and E-cadherin gene were detected by real-time quantitative PCR.Finally,the correlation of NDRG1 and E-cadherin expression in gastric cancer tissues of lymphonodemetastasiswas analyzed.Results Compared w ith primary gastric samples,the expressions of NDRG1 and E-cadherin weremarkedly reduced in gastric cancer tissues of lymphonodemetastasis.Furthermore,the positive correlation of expression between NDRG1 and E-cadherin was also observed.Conclusion Reduced expressions of NDRG1 and E-cadherin were closely associated w ith the lymphonodemetastasis of gastric cancer.
NDRG1;E-cadherin;Gastric cancer;Real-time PCR
湖南省发改委科研项目(2014-2)
1.湖南省地矿医院外一科,湖南,长沙410000 2.湖南省人民医院消化内科,湖南,长沙410000 3.长沙市中心医院普外科,湖南,长沙410000
★通讯作者:刘展,E-mail:Liuzhan2004@126.com