应用单管半巢式PCR技术筛查转基因食品
2015-12-10徐桢惠龙丽坤李葱葱李飞武
闫 伟,徐桢惠,龙丽坤,李葱葱,李飞武,*
(1.吉林省农业科学院农业生物技术研究所,吉林 长春 130033;2.哈尔滨师范大学生命科学与技术学院,黑龙江 哈尔滨 150025)
应用单管半巢式PCR技术筛查转基因食品
闫 伟1,徐桢惠2,龙丽坤1,李葱葱1,李飞武1,*
(1.吉林省农业科学院农业生物技术研究所,吉林 长春 130033;2.哈尔滨师范大学生命科学与技术学院,黑龙江 哈尔滨 150025)
建立转基因作物中常见的两种外源调控元件的单管半巢式聚合酶链式反应(polymerase chain reaction,PCR)检测方法,为转基因食品的筛选检测提供一种快速、精确的方法。针对6 种转基因作物中CaMV35S启动子和NOS终止子的一致性核苷酸序列,分别设计巢式PCR的内、外引物,在测试不同引物组合的扩增效率基础上,建立CaMV35S启动子和NOS终止子的单管半巢式PCR方法。结果表明,上述方法对两种转基因成分具有良好的特异性,检测灵敏度分别为0.01%和0.05%,显著优于常规PCR方法。该方法具有便捷、准确、灵敏等特点,适合筛查食品中的转基因成分。
转基因食品;单管半巢式PCR;筛选检测
近年来转基因作物产业呈现稳步增长的态势,2013年全球种植面积超过1.75亿 公顷,涉及大豆、玉米、棉花、油菜、甜菜、番木瓜等多种作物[1],绝大多数可直接作为食品/饲料或食品/饲料的加工原料。由于转基因技术可打破种间生殖隔离,具有一定的非预期效应,社会公众对转基因食品的安全性一直存在争议[2-3]。为此,许多国家对转基因食品实行强制性标识和安全监管制度。
转基因成分检测为标识和监管制度的顺利实施提供必要的技术手段,以外源核酸序列为检测对象的聚合酶链式反应(polymerase chain reaction,PCR)方法是目前应用最为广泛的转基因成分检测技术[4-5],根据不同分类标准,PCR方法可细分为常规PCR、巢式PCR、多重PCR、定量PCR等[6-7]。巢式PCR利用2对引物、通过2 轮常规PCR可实现对靶标序列的高特异性、高灵敏度扩增,若巢式PCR的其中1条引物既做外引物,又当内引物,即只用1对半引物,则称为半巢式PCR[8]。巢式或半巢式PCR技术在转基因作物的检测中已有许多应用[9-12]。
半巢式PCR一般以第1轮扩增的产物作为第2轮扩增的模板,存在操作繁琐、成本增加、污染风险加大等缺点[13]。单管半巢式PCR可通过内外引物的特殊设计和退火温度的不对称设置,在同一反应管内完成2轮PCR扩增,实现对靶标序列的高特异性和高灵敏度检测,在食品成分[14-15]和临床检测上应用较为广泛[16]。本研究以转基因作物中常见的两种外源调控元件CaMV35S启动子和NOS终止子为靶标检测对象,旨在建立两种筛选元件的单管半巢式PCR方法,为食品中转基因成分的筛选检测提供快速、精准、高灵敏度、低成本的检测技术。
1 材料与方法
1.1 材料与试剂
转基因玉米MON89034、Bt176、MON810,转基因大豆GTS40-3-2,转基因棉花MON531,转基因水稻TT51-1均为吉林省农业科学院保存的阳性参考物质,非转基因玉米购自市场。上述样品中的外源调控元件信息见表1。
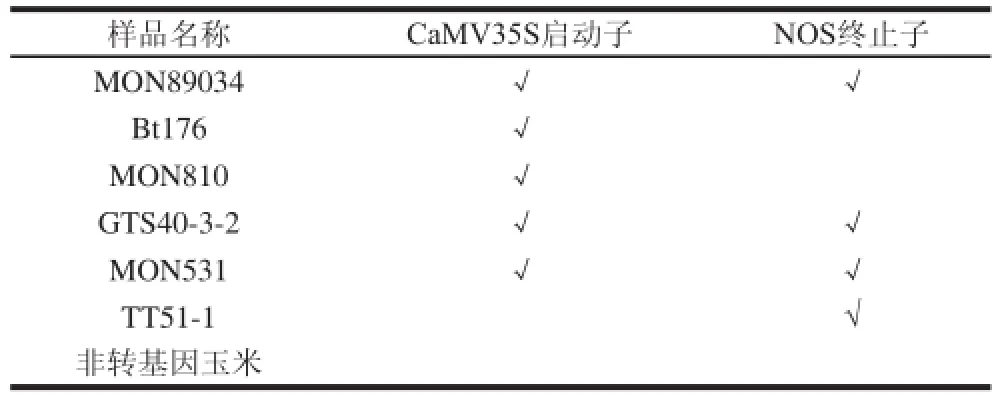
表 1 样品中的外源调控元件信息Table 1 Description of exogenous regulatory elements in samples
新型植物基因组提取试剂盒(货号DP320) 天根生化科技(北京)有限公司;HS Taq DNA聚合酶(货号R007A)、DL2000 DNA Marker(货号3427A)宝生物工程(大连)有限公司;琼脂糖(货号AB0014)生工生物工程(上海)股份有限公司;GeneFinder核酸染料(货号204001) 厦门百维信生物科技有限公司。
1.2 仪器与设备
5424型高速离心机 德国Eppendorf公司;ND1000紫外-可见光分光光度计 美国Thermo Fisher公司;C1000型PCR仪、GelDoc XR+凝胶成像系统 美国Bio-Rad公司。
1.3 方法
1.3.1 DNA提取与纯化
采用试剂盒方法提取样品的基因组DNA,用ND1000紫外-可见光分光光度计测定样品DNA的纯度和质量浓度,并用TE缓冲液将DNA稀释至25 mg/L,4 ℃保存备用。
1.3.2 引物设计
利用Vector NTI 11.5软件对上述转基因样品中的CaMV35S启动子和NOS终止子的核苷酸序列进行同源性比对,以其一致性序列为模板,利用Primer Premier 5.0软件分别设计两种外源转基因成分的半巢式PCR检测引物(表2),引物由生工生物工程(上海)股份有限公司合成,用超纯水稀释至10 μmol/L,备用。
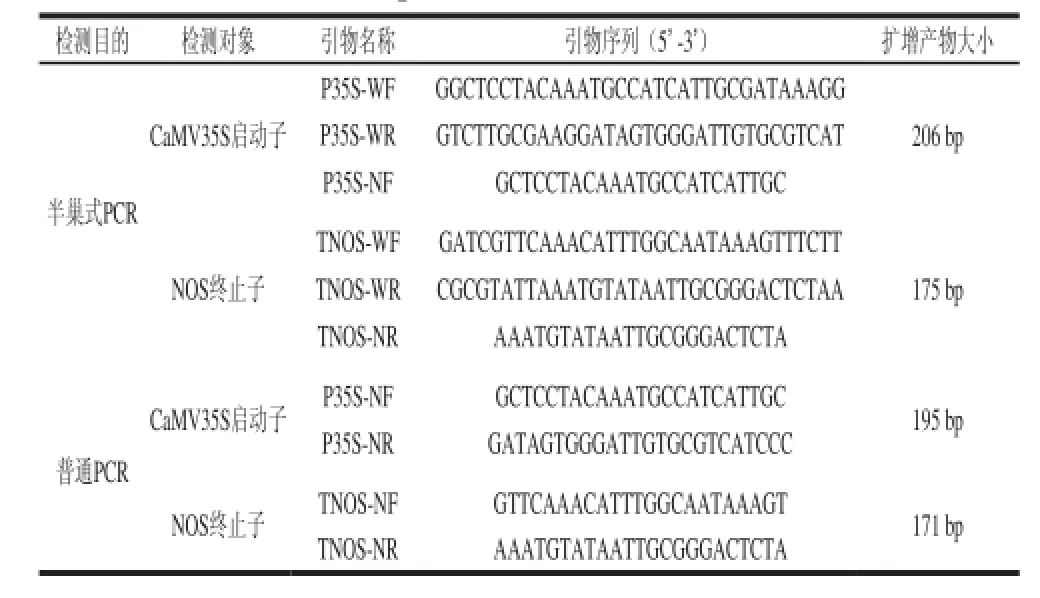
表 2 CaMV35S启动子和NOS终止子的半巢式PCR和普通PCR检测引物Table 2 Primers of semi-nested PCR and conventional PCR for CaMV35S promoter and NOS terminator
1.3.3 单管半巢式PCR检测
CaMV35S启动子:PCR体系中包括1×PCR缓冲液(含1.5 mmol/L Mg2+)、0.2 mmol/L dNTP,0.01 μmol/L正向外引物(P35S-WF)、0.2 μmol/L反向外引物(P35S-WR)、0.2 μmol/L正向内引物(P35S-NF)、1.5 U HS Taq DNA聚合酶、50 ng样品DNA,用超纯水补齐25μL。反应条件为:94 ℃预变性5 min;94 ℃变性30 s、72 ℃延伸40 s,10 个循环;94 ℃变性30 s、58 ℃退火30 s、72 ℃延伸30s,30 个循环;72 ℃延伸5 min。
NOS终止子:PCR体系中包括1×PCR缓冲液(含1.5 mmol/L Mg2+)、0.2 mmol/L dNTP、0.2 μmol/L正向外引物(TNOS-WF)、0.01 μmol/L反向外引物(TNOS-WR)、0.2 μmol/L反向内引物(TNOS-NR)、1.5U HS Taq DNA聚合酶、50 ng样品DNA,用超纯水补齐25 μL。反应条件为:94 ℃预变性5 min;94 ℃变性30 s、67 ℃退火30 s、72 ℃延伸40 s,10 个循环;94 ℃变性30 s、58 ℃退火30 s、72 ℃延伸30 s,30 个循环;72 ℃延伸5 min。
PCR结束后,取5 μL扩增产物,用20 g/L的琼脂糖凝胶电泳检测。
1.3.4 常规PCR检测
PCR体系中包括:1×PCR缓冲液(含1.5 mmol/L Mg2+)、0.2 mmol/L dNTP、0.2 μmol/L正向内引物(NF)、0.2 μmol/L反向内引物(NR)、1U HS Taq DNA聚合酶、50 ng 样品DNA,用超纯水补齐25 μL。反应条件为:94 ℃预变性5 min;94 ℃变性30 s、58 ℃退火30 s、72 ℃延伸30 ,35 个循环;72 ℃延伸5 min。PCR结束后,取5 μL扩增产物,用20 g/L的琼脂糖凝胶电泳检测。
2 结果与分析
2.1 检测引物筛选
通过查阅数据库、专利等文献,获得了表1所列的转基因作物中的CaMV35S启动子和NOS终止子核苷酸序列。为确保检测方法具有更广泛的适用性,利用生物信息学软件Vector NTI 11.5对上述序列进行同源性比对,并在最保守的序列区段设计引物,最终获得了两种筛选元件的半巢式PCR引物(表2),CaMV35S启动子和NOS终止子的半巢式PCR的预期扩增产物大小分别为206bp和175 bp。
单管巢式PCR既可在同一体系中加入2 条外引物和2 条内引物(经典的单管巢式PCR),也可只加入2 条外引物和1 条内引物(改良的单管半巢式PCR)。本研究将这两种策略的单管巢式PCR技术在CaMV35S启动子和NOS终止子的检测中进行了应用,结果表明,对两种筛选元件,在采用1.3.3节所述的半巢式PCR体系时,获得最优的结果。
2.2 方法的特异性测试
以表1所列的实验材料作为测试对象,检验CaMV35S启动子和NOS终止子的半巢式PCR检测方法的特异性。结果表明,应用两种筛选元件的半巢式PCR检测方法均能从相应的转基因材料中获得与预期结果(表1)相一致的扩增产物,见图1。在CaMV35S测试体系中,MON531棉花样品除了206 bp的预期产物外,还出现一条略小于500 bp的片段,经分析,MON531采用了增强型启动子,正向内引物P35S-NF在MON531上有两个结合位点,利用半巢式PCR方法理论上可获得206 bp和467 bp两个扩增产物,与实际结果一致。表明本研究建立的检测方法对两种调控元件具有高度特异性。
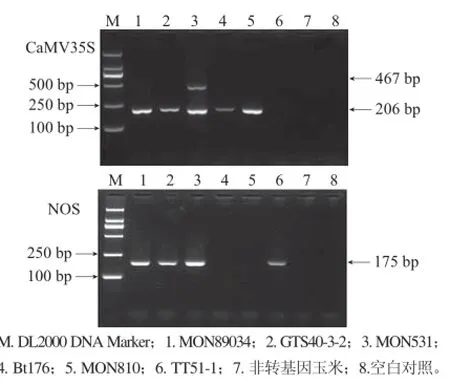
图 1 单管半巢式PCR方法的特异性Fig.1 Specifi city of the single-tube semi-nested PCR method
2.3 方法的灵敏度测试
以DNA质量浓度均为25 mg/L的非转基因玉米基因组DNA和MON89034玉米基因组DNA作为母液,采用基因组DNA梯度稀释法,将MON89034玉米基因组DNA稀释至MON89034 DNA质量分数分别为1%、0.5%、0.1%、0.05%、0.02%、0.01%、0.005%的DNA测试样品,对CaMV35S启动子和NOS终止子的单管半巢式PCR方法的灵敏度进行测试。结果表明,从0.01%及以上含量的测试样品中获得206 bp的CaMV35S启动子的特异性产物,从0.05%及以上含量的测试样品中获得175 bp的NOS终止子的特异性产物,表明半巢式PCR方法对这两种筛选元件的检测灵敏度分别达到0.01%和0.05%(图2)。为比较半巢式PCR与常规PCR的灵敏度,利用表2中的引物对上述样品进行常规PCR检测,预期扩增产物大小分别为195 bp和171 bp,结果见图3,CaMV35S启动子和NOS终止子的常规PCR灵敏度分别为0.05%和0.1%。在本研究中,对两种筛选元件来说,半巢式PCR方法的检测灵敏度均显著优于常规PCR方法。
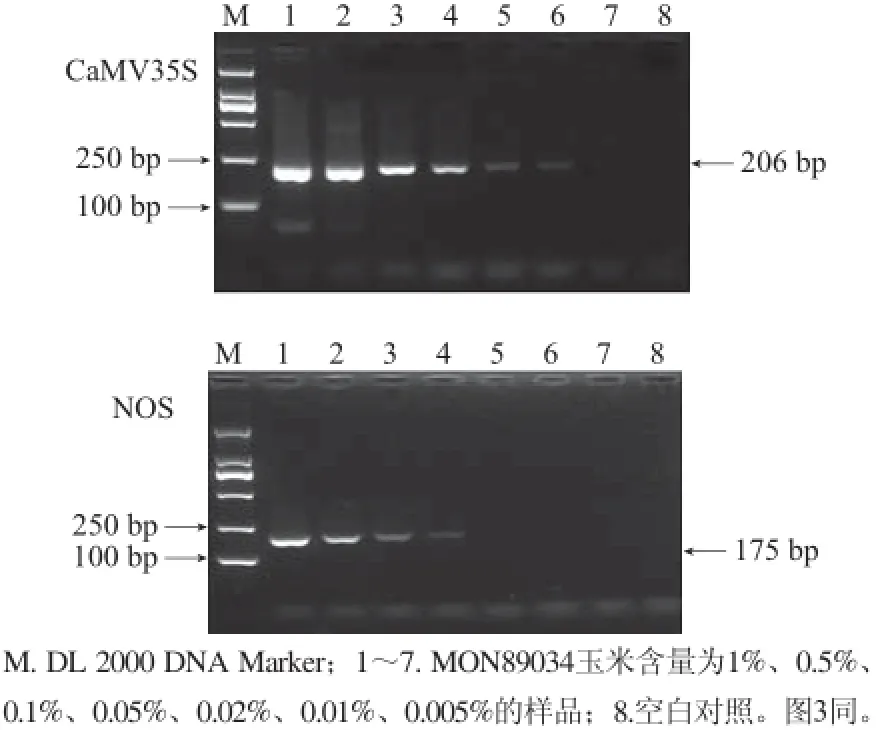
图 2 单管半巢式PCR方法的灵敏度Fig.2 Sensitivity of the single-tube semi-nested PCR method
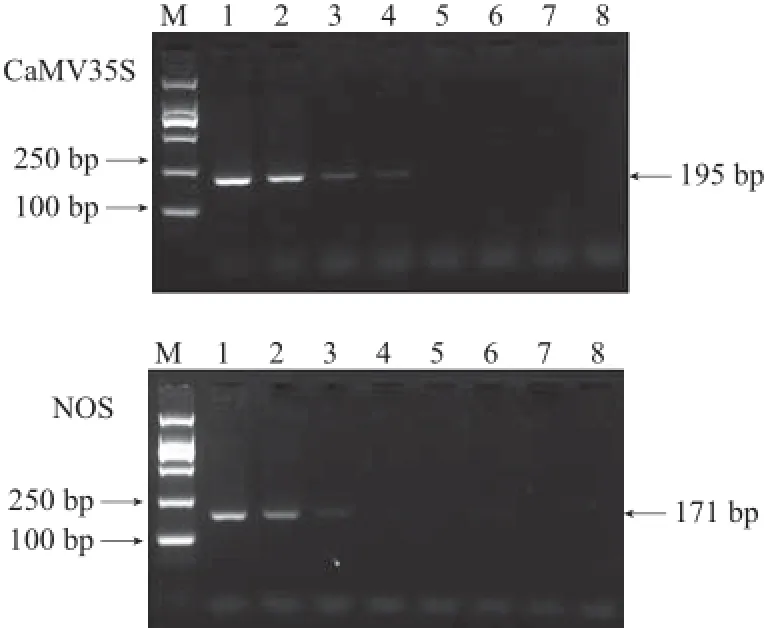
图 3 普通PCR方法的灵敏度Fig.3 Sensitivity of the conventional PCR method
3 结 论
CaMV35S启动子和NOS终止子作为已商业化的转基因作物中最常用的两种调控元件,是目前食品中转基因成分筛选检测的主要对象[17-18],研制这两种转基因外源成分的快速、灵敏、特异、低成本的检测方法,可为转基因食品检测提供一种有效的技术手段。
研究表明,应用半巢式PCR技术可获得比常规PCR更高的检测灵敏度,但经典的半巢式PCR技术一般需进行两轮PCR,不仅操作繁琐,还加大了污染的可能性[19]。本研究将较高退火温度的外引物和较低退火温度的内引物一并放在PCR体系中,并采用先高温退火、再低温退火的热不对称PCR反应程序[20],可在同一管内完成两轮PCR扩增,不仅操作简便、成本降低,还能有效减少污染风险。
序列分析表明,不同转基因作物中应用的CaMV35S启动子和NOS终止子的核苷酸序列不尽相同,为保证检测方法具有更广泛的适用性,本研究在序列分析基础上,选择最保守的序列区段设计检测引物,建立了两种筛选元件的单管半巢式PCR方法。该方法对含有靶标检测对象的转基因作物具有高度特异性,对CaMV35S启动子和NOS终止子的检测灵敏度分别达到0.01%和0.05%,显著优于常规PCR方法。此外,该方法还具有操作简便、经济高效的优点,具有很好的应用前景。
[1] CLIVE J. 2013年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志, 2014, 34(1): 1-8.
[2] 范云六, 黄大昉, 彭于发. 我国转基因生物安全战略研究[J]. 中国农业科技导报, 2012, 14(2): 1-6.
[3] 曲瑛德, 陈源泉, 侯云鹏, 等. 我国转基因生物安全调查Ⅰ. 公众对转基因生物安全与风险的认知[J]. 中国农业大学学报, 2011, 16(6): 1-10.
[4] DIMITRIOS S E, DESPINA P K, KYRIAKI G, et al. Advances in molecular techniques for the detection and quantifi cation of genetically modifi ed organisms[J]. Analytical and Bioanalytical Chemistry, 2008, 392: 347-354.
[5] 张莹, 张永军, 吴孔明, 等. 转基因植物的检测策略和检测技术[J].植物保护, 2007, 33(1): 11-14.
[6] GÜREL F, ARICAN E, GÖZÜKIRMIZI N, et al. Recent molecular tools for detecting transgenic events in genetically modifi ed (GM) crop products[J]. Scientifi c Research and Essays, 2011, 6(24): 5091-5099.
[7] 张大兵, 郭金超. 转基因生物及其产品检测技术和标准化[J]. 生命科学, 2011, 23(2): 195-204.
[8] 黄昆仑, 罗云波. 用巢式和半巢式PCR检测转基因大豆Roundup Ready及其深加工食品[J]. 农业生物技术学报, 2003, 11(5): 461-466.
[9] ZHANG Minghui, GAO Xuejun, YU Yanbo, et al. Detection of Roundup Ready soy in highly processed products by triplex nested PCR[J]. Food Control, 2007, 18(10): 1277-1281.
[10] 彭新凯, 宋涛平, 谭舸, 等. 巢式PCR和SYBR Green Ⅰ实时PCR检测转基因大豆方法的研究[J]. 中国农学通报, 2012, 28(15): 233-237.
[11] 闻伟刚, 盛蕾, 张吉红, 等. 痕量及微量转基因大米成分半巢式PCR检测方法的建立[J]. 食品科学, 2008, 29(12): 622-626.
[12] AO Jinxia, LI Qingzhang, GAO Xuejun, et al. A multiplex nested PCR assay for the simultaneous detection of genetically modifi ed soybean, maize and rice in highly processed products[J]. Food Control, 2011, 22(10): 1617-1623.
[13] ERLICH H A, GELFAND D, SNINSKY J J. Recent advances in the polymerase chain reaction[J]. Science, 1991, 252: 1643-1651.
[14] COSTA J, OLIVEIRA M B P P, MAFRA I. Development of a novel system based on single tube nested real-time PCR system for the quantification of hazelnut in complex foods[J]. Clinical and Translational Allergy, 2013, 3: 144.
[15] COSTA J, MAFRA I, KUCHTA T, et al. Single-tube nested real-time PCR as a new highly sensitive approach to trace hazelnut[J]. Journal of Agricultural and Food Chemistry, 2012, 60(33): 8103-8110.
[16] HOU Minyi, HUNG Minnan, LIN Poshan, et al. Use of a single-tube nested real-time PCR assay to Facilitate the early diagnosis of acute Q fever[J]. Japanese Journal of Infectious Diseases, 2011, 64: 161-162.
[17] 苏锐, 熊嫣, 庆宏, 等. 转基因作物检测新技术研究进展[J]. 化学通报, 2012, 75(2): 121-125.
[18] MATSUOKA T, KURIBARA H, TAKUBO K, et al. Detection of recombinant DNA segments introduced to genetically modifi ed maize (Zea mays)[J]. Journal of Agricultural and Food Chemistry, 2002, 50(7): 2100-2109.
[19] THONGSRI Y, WONGLAKORN L, CHAIPRASERT A, et al. Evaluation for the clinical diagnosis of Pythium insidiosum using a single-tube nested PCR[J]. Mycopathologia, 2013, 176: 369-376.
[20] ALEXANDER A, SUBRAMANIAN N, BUXBAUM J N, et al. Drop-in, drop-out allele-specifi c PCR: a highly sensitive, single-tube method[J]. Molecular Biotechnology, 2004, 28(3): 171-174.
Screening of Genetically Modifi ed Foods by Single-Tube Semi-Nested PCR
YAN Wei1, XU Zhenhui2, LONG Likun1, LI Congcong1, LI Feiwu1,*
(1. Agro-Biotechnology Research Institute, Jilin Academy of Agricultural Sciences, Changchun 130033, China; 2. College of Life Science and Technology, Harbin Normal University, Harbin 150025, China)
A single-tube semi-nested PCR method for common exogenous regulatory elements of transgenic crops was established to provide a fast and accurate assay for screening genetically modifi ed foods. Two sets of element-specifi c nested PCR primers were designed based on the consensus sequence of the exogenous elements in six different transgenic crops, respectively. A single-tube semi-nested PCR assay for CaMV35S promoter and NOS terminator was developed by testing the amplifi cation effi ciency of different combinations of primers. This assay has been successfully applied to distinguish GM crops with CaMV35S promoter or NOS terminator from others with high specifi city. Sensitivity tests showed that the relative limit of detection for CaMV35S promoter and NOS terminator were 0.01% and 0.05%, respectively, signifi cantly better than those of conventional PCR. Consequently, the single-tube semi-nested PCR assay is convenient, accurate, sensitive and suitable for screening genetically modifi ed foods.
genetically modifi ed foods; single-tube semi-nested PCR; screening and detection
TS207.3
A
1002-6630(2015)02-0194-04
10.7506/spkx1002-6630-201502037
2014-04-02
国家转基因生物新品种培育科技重大专项(2014ZX08012-001);吉林省农业科技创新工程项目(2013)
闫伟(1984—),女,研究实习员,硕士,研究方向为转基因生物安全。E-mail:jlndyanwei@126.com
*通信作者:李飞武(1982—),男,助理研究员,硕士,研究方向为转基因生物安全。E-mail:lifeiwu3394@gmail.com
