榆树叶中类胡萝卜素的组成和含量
2015-12-10樊金玲孙晓菲朱文学刘胜男白喜婷
樊金玲,杨 睿,孙晓菲,朱文学,刘胜男,白喜婷
(1.河南科技大学食品与生物工程学院,河南 洛阳 471023;2.三门峡出入境检验检疫局,河南 三门峡 472000)
榆树叶中类胡萝卜素的组成和含量
樊金玲1,杨 睿1,孙晓菲1,朱文学1,刘胜男2,白喜婷1
(1.河南科技大学食品与生物工程学院,河南 洛阳 471023;2.三门峡出入境检验检疫局,河南 三门峡 472000)
目的:分析榆树叶中类胡萝卜素主要组分的结构和含量。方法:丙酮提取榆树叶类胡萝卜素,采用高效液相色谱与二极管阵列检测器和质谱联用技术分析类胡萝卜素组分,依据其光谱和质谱信息并与标准品和文献相比较,确定主要类胡萝卜素的结构;采用高效液相色谱法测定不同采集时间的榆树叶中主要类胡萝卜素的含量。结果:叶黄素和β-胡萝卜素为榆树叶中主要的类胡萝卜素组分,其含量因采集时间不同而异:叶黄素含量范围为880.2~1 385.4 μg/g干样,平均含量为1 098.3 μg/g干样;β-胡萝卜素含量范围为142.8~364.2 μg/g干样,平均含量为297.7 μg/g干样。结论:榆树叶有望成为叶黄素开发的食品新资源。
榆树;叶;类胡萝卜素;高效液相色谱-二极管阵列检测-质谱法;叶黄素;β-胡萝卜素
类胡萝卜素属萜类化合物,基本结构为8 个异戊二烯单位通过共轭双键构成的多烯链,主要分为胡萝卜素类和叶黄素类,前者是不含氧类胡萝卜素的总称,后者是含氧类胡萝卜素的总称[1]。类胡萝卜素具有VA源活性,可用于预防和治疗癌症、心血管和眼部疾病,同时具有抗炎、抗紫外线损伤等多种生理功能[2-4];人体自身不能合成类胡萝卜素,必需从膳食中获取。目前,从天然资源中已分离出650多种类胡萝 卜素,其中,仅有约60 种出现在人类膳食中,约20 种可以在人类血浆和组织中检测到[5],含量最多的为叶黄素、番茄红素、α-胡萝卜素、β-胡萝卜素、β-隐黄 质和玉米黄质[6]。在我国膳食中富含这些类胡萝卜素的蔬菜主要有:胡萝卜、南瓜、番茄和深绿色叶菜等。
使用吸收光谱仪和质谱仪作为检测器的高效液相色谱(high performance liquid chromatography,HPLC)是目前检测类胡萝卜素最常用色谱分析法。Murrillo等[7]采用HPLC-二极管阵列检测器-大气压化学电离质谱(HPLC-diode array detector-mass spectrometry,HPLC-DAD-APCI-MS)法分析了象牙果(A. aculeate)、鱼腥草(Q. cordata)等6 种热带水果中的类胡萝卜素的结构。Kao等[8]采用HPLC-DAD-APCI-MS法分析了台湾蒲公英(Taraxacum formosanum)中类胡萝卜素的组成和含量。Ross等[9]采用HPLC-光电二极管阵列检测-串联质谱(HPLC-photo diode array detector-mass spectrometry-mass spectrometry,HPLC-PDA-MS-MS)法分析了锡兰莓(D. abyssinicaWarb×D. hebecarpa Warb)、树番茄(Cy phomandra betacea)果实中的类胡萝卜素的组成和结构。
榆树(Ulmus pumila L.),又名白榆、家榆,为榆科榆属植物,主要分布于东北、华北、西北及西南各省区[10]。我国民间也素有榆树叶鲜食、拌面蒸制等食用历史。现代医学研究表明榆树具有较强的抗氧化、抗菌、抗炎、抑制前列腺增生等功能[11-14]。迄今为止,国内外对榆树叶生物活性成分的研究报道较少。本研究以开发新食品资源为目的,采用HPLC-DAD-MS法分析榆树叶类胡萝卜素组分,通过各组分峰的特征光谱和质谱信息,并通过与标准品、文献的比较,确定榆树叶中类胡萝卜素主要组分的结构;采用外标法测定榆树叶中主要类胡萝卜素组分的含量。研究结果为综合开发利用榆树植物资源提供理论依据。
1 材料与方法
1.1 材料与试剂
榆树叶20 13年4~10月间每月采摘于河北省林科院苗圃,所采榆树为3 a生,取树冠中部叶。小心地用剪刀将树叶剪下,洗净冻干,于冰箱内避光冷冻保存备用。
丙酮(分析纯)、甲醇(色谱纯) 洛阳昊华化学科技有限公司;叶黄素标准品(纯度HPLC≥95%)、β-胡萝卜素标准品(纯度≥98%) 上海源叶生物科技有限公司。
1.2 仪器与设备
8C-2台式低速离心机 上海医疗器械有限公司手术器械厂;1 01-ZA电热鼓风干燥箱 天津市泰斯特仪器有限公司;RE-52A水浴蒸发仪 上海亚荣生化仪器;2690高效液相质谱联用仪 美国罗门哈斯公司。
1.3 方法
1.3.1 榆树叶中类胡萝卜素的提取
分别精确称取同一批榆树叶样品3 份,每份0.600 0g,剪碎置于研钵中,加入少量石英砂,用40 mL冰丙酮[15]分多次研磨提取至无色;提取液在8 000 r/min条件下离心10 min以除去其中的叶片残渣,继而在30℃水浴条件下减压旋转蒸干,用10 mL冰丙酮复溶,作为样品待测液。
1.3.2 榆树叶类胡萝卜素的HPLC-DAD-MS分析
HPLC条件:色谱柱:BEH C18(2.1 mm×100 mm,1.7 μm);检测器:Waters Acquity DAD;流动相A:水、流动相B:甲醇、流动相C:乙酸乙酯;梯度洗脱:0~5 min,水15%~8%、甲醇85%~92%;5~10 min,水8%~6%、甲醇92%~94%;10~12 min,水6%~5%、甲醇94%~95%;12~17 min,水5%、甲醇95%;17~25 min,水5%~0%、甲醇95%~100%;25~32 min,甲醇100%;32~37 min,甲醇100%~90%;37~52 min,甲醇90%~85%、乙酸乙酯10%~15%;52~67 min,甲醇85%~70%、乙酸乙酯15%~30%;67~70 min,甲醇70%~100%、乙酸乙酯30%~0%;柱温25℃;进样量10 μL;流速1 mL/min;检测波长450 nm。
质谱条件:电喷雾离子源;正离子扫描(m/z 100~1 500);毛细管电压3.5 kV;锥孔电压30 V;光电倍增器电压650 V;离子源温度100 ℃;脱溶剂气温度400 ℃。
1.3.3 榆树叶类胡萝卜素的定量分析
采用HPLC法进行测定。
1.3.3.1 HPLC色谱条件
色谱条件同1.3.2节。
1.3.3.2 标准曲线的制作
分别精密称取叶黄素、β-胡萝卜素标准品各2.5 mg,用冰丙酮溶液溶解并定容于25 mL棕色容量瓶中,摇匀,得到混合标准品储备液(100 μg/mL)。将储备液分别稀释为以下一系列质量浓度的标准品使用液:10、20、40、50、60、80、100 μg/mL,进行HPLC检测。以峰面积为纵坐标,以溶液质量浓度为横坐标,进行线性回归,得到回归方程。
1.3.3.3 榆树叶中类胡萝卜素的测定
取样品待测液进行HPLC分析,记录峰面积,计算相对含量。
2 结果与分析
2.1 榆树叶类胡萝卜素的HPLC-DAD-MS分析
利用HPLC-DAD-MS技术分离并鉴定了榆树叶中的主要类胡萝卜素化合物。图1为450 nm检测波长条件下,榆树叶丙酮提取物的HPLC图。共检测到9 个主要的色谱峰,峰7在469 nm和650 nm波长处有最大吸收,峰8在432 nm和666 nm波长处有最大吸收(图略),分别与文献报道的叶绿素b和叶绿素a的特征吸收峰一致,因此,峰7和峰8为叶绿素b和叶绿素a。其余色谱峰均不同程度地呈“三指峰”结构,为类胡萝卜素物质,其中峰3、峰5和峰9为主要类胡萝卜素物质,分别占类胡萝卜素总峰面积的14.80%、32.98%、34.07%,光谱信息及质谱信息见表1。
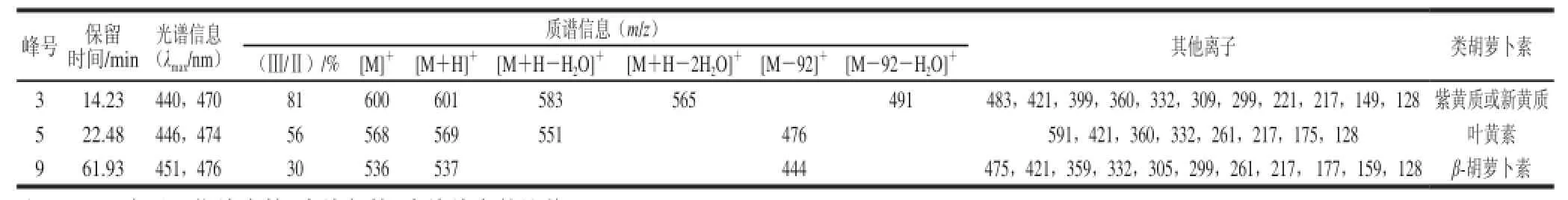
表 1 榆树叶类胡萝卜素的光谱和质谱信息Table 1 Chromatographic, UV-visible and mass spectroscopic characteristics of carotenoids from elm leaves
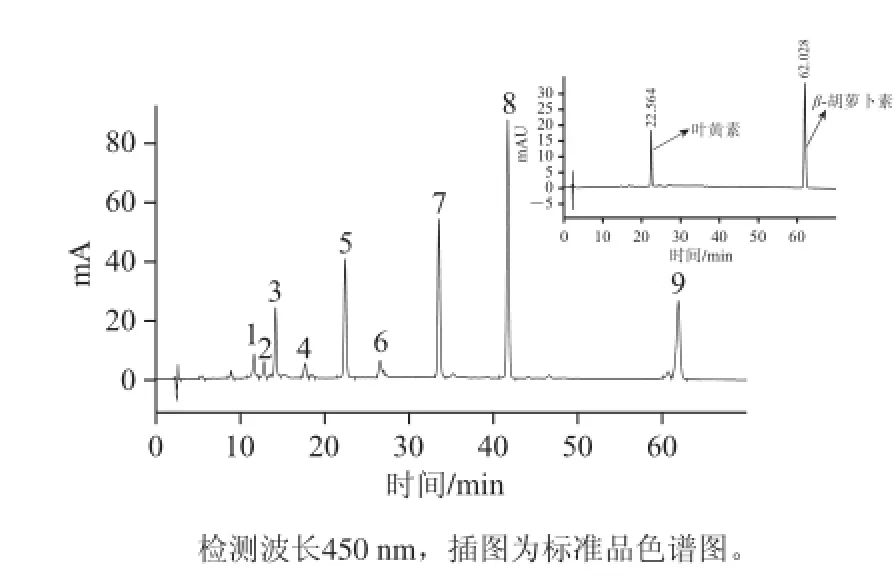
图 1 榆树叶类胡萝卜素提取液的高效液相色谱图Fig.1 HPLC chromatogram of carotenoids extracted from Ulmus pumila L.
峰3:保留时间为14.23 min,光谱图及质谱图如图2所示。分子离子峰[M]+m/z 600和准分子离子峰[M+H]+m/z 601,说明其相对分子质量600,分子式为C40H56O4;m/z 583和565分别为准分子离子峰[M+H]+失去一分子H2O和两分子H2O所得[16-17],m/z 491为该分子多烯链上失去一个m/z 为92的片断和一分子H2O所得(92+18)[1],m/z 221表明该合物结构一侧末端为β环环氧结构,并带有一个羟基[18];其光谱图显示最大吸收峰为440、470 nm,表明该分子为9 个共轭双键或8 个共轭双键加一个累积二烯,均在链上[19]。结合质谱图和光谱图可判断:当分子结构中存在链上9 个共轭双键时,分子的另一末端为带羟基的β环-5,6环氧结构;当分子结构中的链上部分为8 个共轭双键加一个累积二烯时,分子的另一末端为带有2个羟基的环结构。综合以上信息,推测峰2可能为新黄质或紫黄质;m/z 399、m/z 360分别为双键C7~C8和C9~C10处断裂并失去2 个OH所得[18],m/z 221和m/z 299分别为C10~C11和C15~C15′处断裂所得,其分子结构及质谱碎裂模式如图3所示。
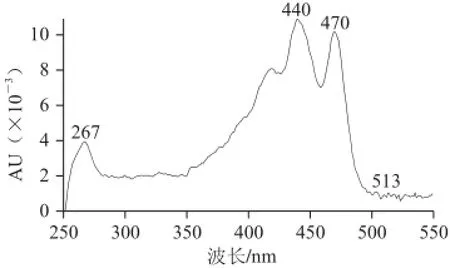
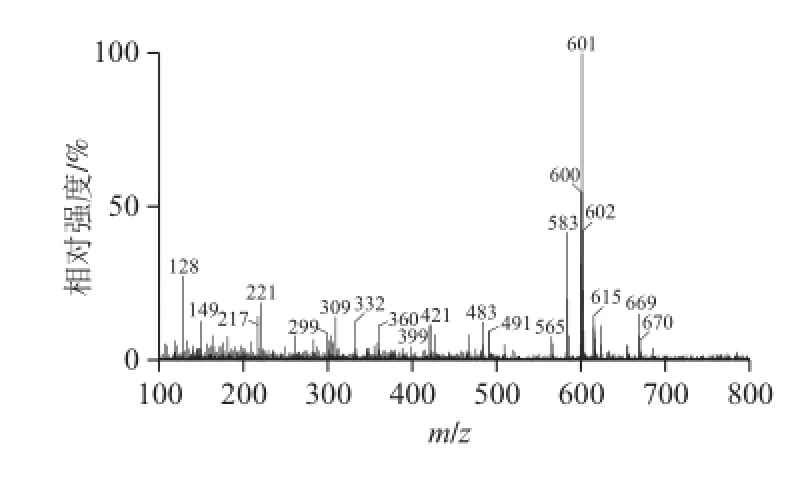
图 2 峰2的光谱图和质谱图(峰号见图1)Fig.2 UV-Vis and mass spectrum of peak 2 shown in Fig.1
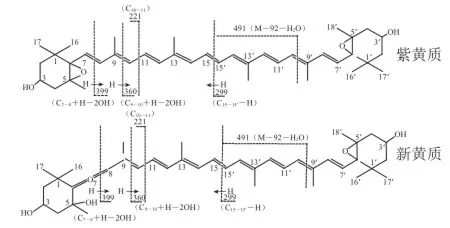
图 3 峰3的质谱碎裂模式(电喷雾电离正离子模式)(峰号见图1)Fig.3 Mass fragmentation pattern of peaks 3 shown in Fig.1 under ESIMS in positive ion mode
峰5:保留时间为22.48 min,光谱图及质谱图如图4所示。其光谱图表明最大吸收峰为446、474 nm,表明该化合物发色团为10 个共轭二烯,其中一个在β环。其分子离子峰[M]+m/z 568和准分子离子峰[M+H]+m/z 569,m/z 599为[M+Na]+,说明其相对分子质量为568,分子式为C40H56O2。m/z 551为准分子离子峰[M+H]+失去一分子H2O所得;m/z 476为该分子多烯链上失去一个m/z 为92的片断所得;m/z 175和m/z 360为C9~C10断裂并失去一个OH所得;无m/z 221,表明该合结构一侧末端不含β环-环氧-羟基结构。甲基化实验结果表明,该化合物存在烯丙基羟基,表明该化合物一侧末端为ε-羟基。结合以上信息,推测该化合物为叶黄素。将该化合物的保留时间、光谱图和质谱图与叶黄素标准品进行了对比,二者完全一致,表明峰5为叶黄素。其分子结构及质谱碎裂模式如图5所示。
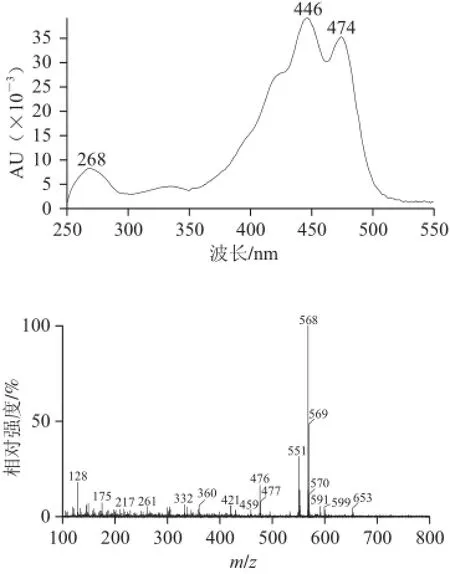
图 4 峰5的光谱图和质谱图(峰号见图1)FFiigg..44 UUVV--vviissiibbllee aanndd mmaassss ssppeeccttrruumm ooff ppeeaakk 55 sshhoowwnn iinn FFiigg..11

图 5 峰5的质谱碎裂模式(电喷雾电离正离子模式,峰号见图1)Fig.5 Mass fragmentation pattern of peaks 5 under ESIMS in positive ion mode
峰9:保留时间为61.93 min,光谱图及质谱图如图6所示。其光谱图表明最大吸收峰为451、476 nm,表明该化合物发色团为11 个共轭二烯,其中二个在β环。其分子离子峰[M]+m/z 536和准分子离子峰[M+H]+m/z 537,说明其相对分子质量为568,分子式为C40H56;m/z 444为该分子多烯链上失去一个m/z 92的片断所得;m/z 177和m/z 359为C9~C10断裂所得;结合以上信息,推测该化合物为β-胡萝卜素。将该化合物的保留时间、光谱图和质谱图与β-胡萝卜素标准品进行了对比,二者完全一致,表明峰9为β-胡萝卜素。其分子结构及质谱碎裂模式如图7所示。
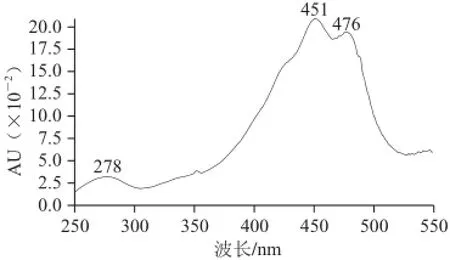
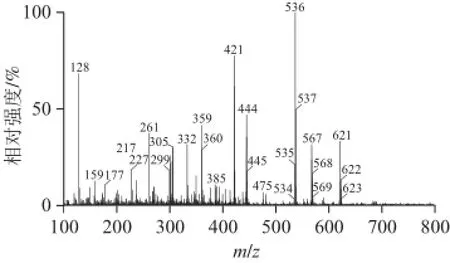
图 6 峰9的光谱图和质谱图(峰号见图1)Fig.6 UV-visible and mass spectrum of peak 9 shown in Fig.1
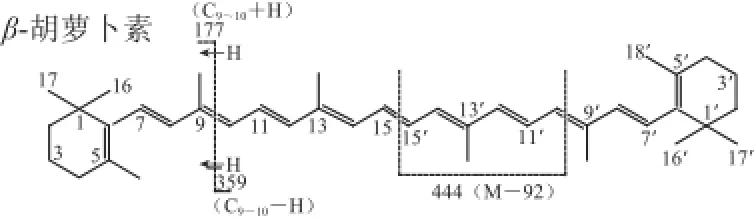
图 7 峰9的质谱碎裂模式(电喷雾电离正离子模式,峰号见图1)Fig.7 Mass fragmentation pattern of peak 9 under ESIMS in positive ion mode
2.2 榆树叶中叶黄素和β-胡萝卜素的含量分析
采用高效液相色谱分析、外标法测定了2013年4月至10月间采集的榆树叶中主要类胡萝卜素、叶黄素和β-胡萝卜素含量,结果如图8所示。榆树叶中叶黄素和β-胡萝卜素含量因采集时间不同而异:叶黄素含量范围为880.2~1 385.4 μg/g干样,平均含量为1 098.3 μg/g干样;其中,7月份采集样品的叶黄素含量较高。β-胡萝卜素含量范围为142.8~364.2 μg/g干样,平均含量为297.7 μg/g干样,除4月份采集样品含量较低外,其他月份之间的差异不显著。
植物类胡萝卜素位于叶绿体和有色体膜中,是植物光合作用的辅助色素;一方面,帮助叶绿素接收光能;另一方面,在高温、强光条件下能通过叶黄素循环,以非辐射的方式耗散光系统Ⅱ的过剩能量保护叶绿素免受破坏[20-22]。本实验表明:在生长初期(4月份)榆树叶片的叶黄素和β-胡萝卜素含量较低。随着幼叶的成长,二者含量也逐渐增加,至夏季(7月份)叶片完全发育成熟时,类胡萝卜素含量达到最大值;其后,随着叶片的衰老,榆树叶叶黄素和β-胡萝卜素含量逐渐呈下降的趋势;至10月份,叶黄素和β-胡萝卜素含量又有小幅度上升(尽管统计学上不显著),这可能与类胡萝卜素是合成植物激素脱落酸的前体有关[23]。
叶黄素是一种含氧类胡萝卜素,具有多种生理活性,能抵御游离基在人体内造成的细胞与器官损伤,可有效预防动脉硬化,增强免疫力,在预防癌变发生、延缓癌症发展、抑制黄斑变性等方面具有重要作用[24-25]。美国食品与药品管理局早于1995年已批准叶黄素作为食品补充剂。我国卫生部2007年第8号文件规定,叶黄素作为营养强化剂,可用于婴儿、较大婴儿、幼儿和学龄前儿童的配方食品;2008年卫生部批准叶黄素酯为新功能食品原料。叶黄素在食用蔬菜、水果中含量较低;羽衣甘蓝和菠菜是食物中叶黄素含量较高的蔬菜品种,其叶黄素含量分别为64~150 μg/g鲜质量(平均含量107 μg/g鲜质量)和39~95 μg/g鲜质量(平均含量65 μg/g 鲜质量)[26]。本研究测得榆树叶中的叶黄素平均含量1 098.3 μg/g干样,折合约为351 μg/g鲜质量(榆树叶含水量为67.84%±0.49%),分别为羽衣甘蓝和菠菜的3.3 倍和5.4 倍。万寿菊是目前工业提取叶黄素的主要原料,不同品种万寿菊的叶黄素含量为170~5 700 μg/g干质量[27],平均含量约为1 700 μg/g干质量[28];榆树叶中叶黄素平均含量约为万寿菊的65%。鉴于榆树叶可食、可入药,且叶黄素含量较高,因此可以考虑开发明目食品、保健品等为人们利用。
3 结 论
叶黄素和β-胡萝卜素为榆树叶中主要的类胡萝卜素组分,其含量因采集时间不同而异:叶黄素含量范围为880.2~1385.4 μg/g干样,平均含量为1 098.3 μg/g干样;β-胡萝卜素含量范围为142.8~364.2 μg/g干样,平均含量为297.7 μg/g干样。榆树叶有望成为叶黄素开发的食品新资源。
[1] van BREEMEN R B, DONG Linlin, PAJKOVIC N D, et al. Atmospheric pressure chemical ionization tandem mass spectrometry of carotenoids[J]. International Journal of Mass Spectrometry, 2012, 312: 163-172.
[2] VILCHEZ C, FORJAN E, CUARESMA M, et al. Marine carotenoids: biological functions and commercial applications[J]. Marines Drugs, 2011, 9(3): 319-333.
[3] 黄丽, 於洪建. 枸杞中类胡萝卜素的研究进展[J]. 食品研究与开发, 2012, 33(5): 233-236.
[4] 刘振, 洗晓霞, 舒小丽. 叶黄素的结构功能及其应用进展[J]. 中国科技博览, 2009(28): 225-226.
[5] DURING A, HARRISON E H. Intestinal absorption and metabolism of carotenoids: insights from cell culture[J]. Archives of Biochemistry and Biophysics, 2004, 430: 77-88.
[6] KHACHIK F, BEECHER G R, GOLI M B. Separation and identifi cation of carotenoids and their oxidation products in extracts of human plasma[J]. Analytical Chemistry, 1992, 64: 2111-2122.
[7] MURILLO E, GIUFFRIDA D, MENCHACA D, et al. Native carotenoids composition of some tropical fruits[J]. Food Chemistry, 2013, 140: 825-836.
[8] KAO T H, LOH C H, INBARAJ B S, et al. Determination of carotenoids in Taraxacum formosanum by HPLC-DAD-APCI-MS and preparation by column chromatography[J]. Journal of Pharmaceutical and Biomedical Analysis, 2012, 66: 144-153.
[9] ROSSO V V D, MERCADANTE A Z. HPLC-PDA-MS/MS of anthocyanins and carotenoids from dovyalis and tamarillo fruits[J]. Agricultural and Food Chemistry, 2007, 55: 9135-9141.
[10] 张畅, 姜卫兵, 韩健. 论榆树及其在园林绿化中的应用[N]. 中国农学通报, 201 0-02-06(10).
[11] KIM S I, SIM K H, CHOI H Y. A Comparative study of antioxidant activity in some Korean medicinal plant used as food materials[J]. Molecular & Cellular Toxicology, 2010, 6(3): 279-285.
[12] LEE H Y, MUN T K, LIM C J, et al. Antibacterial activity of Ulmus pumila L. extract[J]. Korean Journal of Applied Microbiology and Biotechnology, 1992, 20(1): 1-5.
[13] 杨明非. 榆树皮粗多糖组成及体外抗氧化作用[J]. 东北林业大学学报, 2011, 39(9): 121-125.
[14] GHOSH C, CHUNG H Y, NANDRE R M, et al. An active extract of Ulmus pumila inhibits adipogenesis through regulation of cell cycle progression in 3T3-L1 cells[J]. Food and Chemical Toxicology, 2012, 50(6): 2009-2015.
[15] RODRIGUEZ-AMAYA D B, KIMURA M. Harvestplus handbook for carotenoid analysis[M]. 2 th ed. Washington D C: International Center for Tropical Agriculture, 2004: 10.
[16] REN D D, ZHANG S H. Separation and identifi cation of the yellow carotenoids in Potamogeton crispus L.[J]. Food Chemistry, 2008, 106: 410-414.
[17] ROSSO V V, MERCADANTE A Z. Identifi cation and quantifi cation of carotenoids, by HPLC-PDA-MS/MS, from Amazonian fruits[J]. Journal of Agricultural and Food Chemistry, 2007, 55(13): 5062-5072.
[18] RIVERA S M, CANELA-GARAYO R. Analytical tools for the analysis of carotenoids in diverse materials[J]. Journal of Chromatography A, 2012, 1224: 1-10.
[19] KOBORI C N, AMAYA D B R. Uncultivated brazilian green leaves are richer sources of carotenoids than are commercially produced leafy vegetables[J]. Food and Nutrition Bulletin, 2008, 29(4): 320-327.
[20] MATTHEWS P D, LUO R, WURTZEL E T. Maize Phytoene desaturase and ξ-carotene desaturase catalyse a poly-Z desaturation pathway: implications for genetic engineering of carotenoid content among cereal crops[J]. Journal of Experimental Botany, 2003, 54(391): 2215-2230.
[21] NIYOGI K K. Photoprotection revisitied[J]. Annual Review Plant Physiology and Plant Molecular Biology, 1999, 50: 391-417.
[22] GOODWIN T W, BRITTON G. Plant pigments[M]. London: Academic Press, 1988: 61-132.
[23] ROCK C D, ZEEVAART J A D. The aba mutant of arobidopsis thaliana is inpaired in epoxy-crotenoids biosyntheses[J]. Proceedings of the National Academy of Science of USA, 1991, 88: 7496-7499.
[24] 刘娟, 姜永华. 叶黄素对眼科疾病防治作用的研究进展[J]. 中国实用眼科杂志, 2011, 29(7): 660-662.
[25] 曾瑶池, 胡敏予. 叶黄素、番茄红素与黄斑变性研究进展[J]. 中国老年学杂志, 2009, 29(17): 2281-2283.
[26] CABALLERO B. Guide to nutritional supplements[M]. Manhattan: Acadmic Press, 2009: 92-96.
[27] PICCAGLIA R, MAROTTI M, GRANDI S. Lutein and lutein ester content in different types of Tagetes patula and T. erecta[J]. Industrial Crops and Products, 1998, 8(1): 45-51.
[28] 郑建仙. 植物活性成分开发[M]. 北京: 中国轻工业出版社, 2005: 104.
Identifi cation and Quantifi cation of Carotenoids in Leaves of Ulmus pumila L.
FAN Jinling1, YANG Rui1, SUN Xiaofei1, ZHU Wenxue1, LIU Shengnan2, BAI Xiting1
(1. College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471023, China; 2. Sanmenxia Entry Exit Inspection and Quarantine Bureau, Sanmenxia 472000, China)
Objective: To determine the structures and contents of major carotenoids in leaves of elm (Ulmus pumila L.) collected at different time points during one year. Methods: Carotenoids from elm leaves were extracted using acetone. The major carotenoids were analyzed with the use of high performance liquid chromatography with diode array detection coupled to mass spectrometry (HPLC-DAD-MS) and identifi ed by comparison of UV-visible and mass spectral data with reference standards or data reported in the literature. The contents of major carotenoids were measured by HPLC. Results: Two major carotenoids were identifi ed as lutein and β-carotene. The level ranged from 880.2 to 1385.4 μg/g (dry weight) for lutein and from 142.8 to 364.2 μg/g (dry w eight) for β-carotene with an average content of 1098.3 and 297.7 μg/g (dry weight), respectively. Conclusion: Ulmus pumila L. is a new resource of lutein.
Ulmus pumila L.; leaves; carotenoids; high performance liquid chromatography-diode array detector-mass spectrometry (HPLC-DAD-MS); lutein; β-carotene
O629.4
A
1002-6630(2015)02-0155-05
10.7506/sp kx1002-6630-201502030
2014-06-27
樊金玲(1973—),女,教授,博士,研究方向为天然产物化学。E-mail:fanjinling@haust.edu.cn
