酿酒葡萄成熟期间果实质地特性和花色苷含量变化
2015-12-10张芳芳张振文
刘 旭,杨 丽,张芳芳,张振文*
(西北农林科技大学葡萄酒学院,陕西省 葡萄与葡萄酒工程中心,陕西 杨凌 712100)
酿酒葡萄成熟期间果实质地特性和花色苷含量变化
刘 旭,杨 丽,张芳芳,张振文*
(西北农林科技大学葡萄酒学院,陕西省 葡萄与葡萄酒工程中心,陕西 杨凌 712100)
研究酿酒葡萄果实成熟期间质地特性和花色苷含量的变化规律,以酿酒葡萄赤霞珠(Vitis vinifera L.)为研究对象,采用物性分析仪对其果皮机械特性和果实质构多面特性进行分析,并测定了果皮中总花色苷和9种花色苷组分的含量,以及花色苷可提取率。研究表明:赤霞珠葡萄果实成熟期间果皮中总花色苷和可提取花色苷含量逐渐增加,至转色后第6周达到最高,分别为880.29 mg/kg和841.38 mg/kg。果实成熟期间果皮厚度逐渐增加,并与花色苷含量呈极显著正相关(R2=0.568),与花色苷可提取率呈极显著负相关(R2=—0.475)。表征果皮硬度的参数杨氏模量(Esk)与花色苷含量呈极显著正相关(R2=0.581),与花色苷可提取率呈显著负相关(R2=—0.609)。果实质构多面分析各参数与果皮花色苷含量和可提取率之间均无相关性。
酿酒葡萄;质地特性;花色苷
花色苷是葡萄与葡萄酒中一类重要的酚类化合物,主要存在于葡萄浆果表皮下3~4 层细胞的液泡中[1],对葡萄酒的颜色深浅和色调至关重要[2]。葡萄果实转色后花色苷开始迅速积累,并于果实成熟时含量达到最高[3]。此时花色苷的组分、含量以及提取率很大程度上决定了其在酒中的含量和葡萄酒的相关品质[4]。研究发现,葡萄果实转色后其质地特性不断发生变化[5],并与果皮细胞壁组分、细胞结构、组织膨压的变化[6],以及果胶酶主导的果皮细胞壁降解等有关[7-9]。另外,在葡萄浸渍发酵阶段果皮中花色苷的释放能力也与果实质地特性密切相关[10-11]。
质地特性是葡萄果实的重要物理特性之一,国内外自20世纪80年代开始在鲜食葡萄的成熟进程、采后生理等方面开展了相关研究[12-13],并侧重于建立果实硬度变化与糖含量变化之间的关系,从而用于预测果实成熟过程中糖含量[14]和贮藏过程中果实硬度的变化[15-16]。目前国内对酿酒葡萄成熟期间果实质地特性的变化规律及其与花色苷含量变化的关系还没有进行过系统研究。国外的相关研究也主要集中于果实质地特性的品种差异,并发现葡萄果皮的机械特性和浆果的质地特性是葡萄品种的重要特征之一,特别是果实硬度、咀嚼性、黏附性以及果皮硬度能较好地区分不同品种[17],并且在不同的产地和气候条件下表现出一定的差异。
由于酿酒葡萄的花色苷主要存在于果皮中,在果实成熟期间含量不断增加,并伴随着果皮硬度和厚度以及浆果质地特性的相应变化。因此,二者之间可能存在一定的相关性。本实验以红色酿酒葡萄赤霞珠为材料,研究了果实成熟期间花色苷含量和质地特性的动态变化规律,并分析了二者之间的相关性,为下一步构建酿酒葡萄果实中花色苷含量的快速检测提供理论依据。
1 材料与方法
1.1 材料与试剂
赤霞珠果实采自陕西省泾阳县酿酒葡萄种植园,篱架栽培,单干单臂整形。2013年果实转色1周后(weeks after veraison,WAV)开始,每隔7 d采样1次,共6 次。具体采用“Z”字形方法采样:选择有代表性的两行葡萄树,分别标记每行的第7、14、21、28、35、42、49、56、63、70棵树。第1次取样为第1行的第7、21、35、49、63棵葡萄树和第2行的第14、28、42、56、70棵葡萄树,每株采集1 穗果,共计10 穗。为了兼顾植株东西两侧的果穗,第1行均采集植株东面的果穗,第2行采集植株西面的果穗。第2次取样从第1行的第6棵植株和第2行的第13棵植株开始,同上依次取样。样品迅速带回实验室,用剪刀逐粒剪下,并随机分为3 份作为重复。
盐酸、甲醇、氯化钠、醋酸、醋酸钠 国药集团化学试剂公司;乙腈、二甲花翠素-3-O-葡萄糖苷 美国Sigma-Aldrich公司。
1.2 仪器与设备
TA-XTplus型物性分析仪 英国Stable Micro System公司;UV2450紫外分光光度计、LC-2010A高效液相色谱仪 日本Shimadzu公司。
1.3 方法
1.3.1 质地特性测试
质地特性测试系统如图1所示,由物性分析仪和计算机组成。物性分析仪搭载一个HDP/90和负载5 kg的平台,工作频率为400 Hz,质地分析软件为Texture Expert Exceed(version 2.54)。

图 1 质地特性测试系统示意图Fig.1 Schematic diagram of textural analysis system
质地特性测试包括果皮机械特性和果实质构多面分析(texture profile analysis,TPA),经预实验确定的测试参数见表1。每次测试前进行校准力和距离的校正。

表 1 质地特性测试参数Table 1 Operating conditions for determination of textural properties
具体测试方法为:每个重复随机取20 粒大小相近的浆果,测定果粒赤道线处的果皮硬度。本实验中分别用果皮穿刺力(Fsk)、果皮穿刺能量(Wsk)和杨氏模量(Esk)表征果皮硬度。测试结束后用刀片小心撕下0.25 cm2的果皮,并尽量去掉果皮上的果肉,然后置于物性仪测试平台上,防止果皮卷曲,测定果皮厚度。另从每个重复中随机选取20 粒大小相近的浆果进行质构多面分析。其表征参数为:硬度(berry hardness,BH)、凝聚性(berry cohesiveness,BCo)、黏附性(berry gumminess,BG)、弹性(berry springiness,BS)、咀嚼性(berry chewiness,BCh)和回复性(berry resilience,BR)。质地特性测试的特征曲线如图2所示。
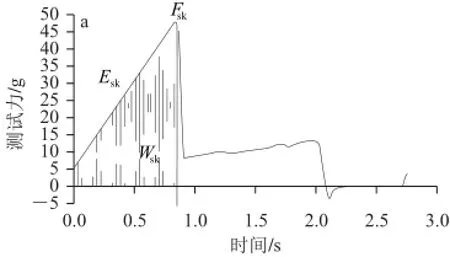
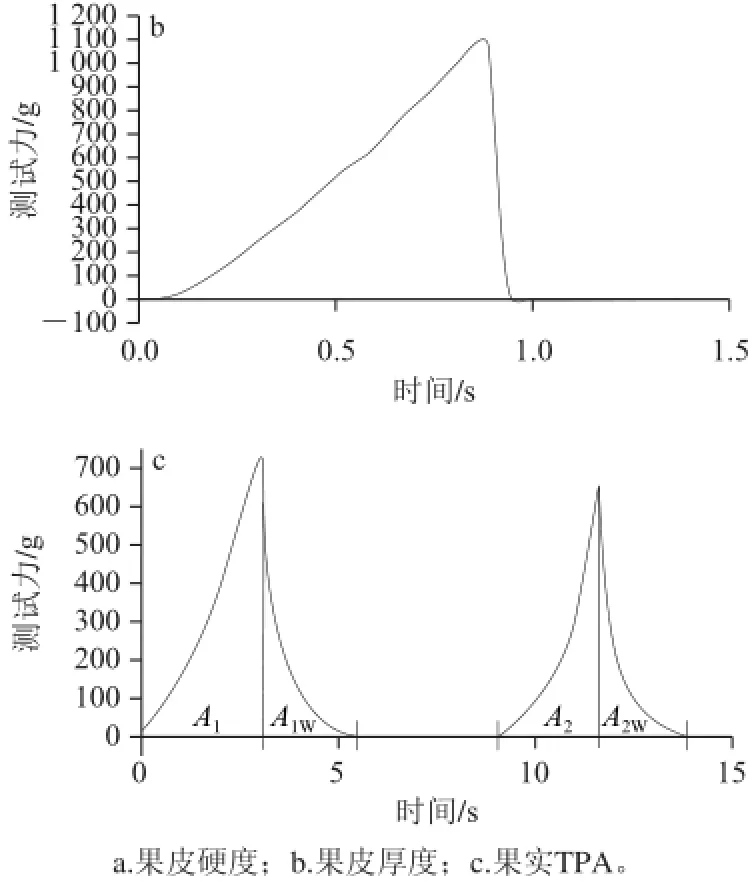
图 2 酿酒葡萄果实质地分析典型曲线Fig.2 Typical TPA curves: grape skin hardness (a), grape skin thickness (b) and grape berry TPA (c)
1.3.2 花色苷含量的测定
对每个采样时期的样品进行质构多面分析后,将所有浆果(20 粒)的果皮小心撕下来用于花色苷含量测定。花色苷提取、总花色苷含量、可提取花色苷含量以及花色苷组分含量的测定参考文献[18]进行,花色苷含量以二甲花翠素-3-O-葡萄糖苷表示,单位为mg/kg。
1.4 数据处理
实验数据采用SPSS 19.0软件进行统计分析和Excel作图。
2 结果与分析
2.1 赤霞珠果实成熟期间果皮机械特性的变化
表征果皮硬度的参数Fsk定义为探针穿透果皮需要的力,而Wsk定义为探针穿透果皮所做的功,为穿刺力和穿刺距离的乘积,因此本实验中这两个表征参数的变化规律相似。Esk用以表征果皮受力后形变的大小,其数值越大说明果皮越不容易发生形变,即果皮越硬。
由图3可见,赤霞珠果实成熟期间表征果皮硬度的参数Fsk和Wsk的变化规律相似,均在果实转色后第2周(2 WAV)达到最高,分别为0.528 N和0.459 mJ。随着果实的发育有所下降,5 WAV时达到最低值,分别为0.364 N和0.284 mJ,此时葡萄接近充分成熟,果皮进一步变软,硬度显著降低。但是,两个参数在技术成熟度时即6 WAV显著上升(P≤0.05),这与当年果实成熟后期连续的高温干旱有关,造成果粒不同程度的脱水,甚至部分果粒出现皱缩现象,因此其Fsk和Wsk值在6 WAV时有所增加。这与在Mondeuse[19]、Nebbiolo[20]葡萄上的研究结果一致。而表征果皮硬度的参数Esk在果实转色后总体上表现出较为明显的下降趋势,在6 WAV时达到最低值,为0.481 N/mm。葡萄果实转色后果皮逐渐变软,但果皮厚度逐渐增加,果皮硬度参数Fsk和Wsk既和穿刺果皮所需要力的大小有关,同时受果皮厚度影响。而Esk则表现为穿刺单位厚度的果皮所需要的力,排除了厚度的影响。
由图3b可以看出,果实转色后随着葡萄的发育其果皮厚度逐渐增加,在技术成熟度时(6 WAV)达到最大,为249 μm。这与转色后果皮细胞体积和细胞间的间隙增加,以及胞内物质如花色苷等的含量急剧增加有关[21]。
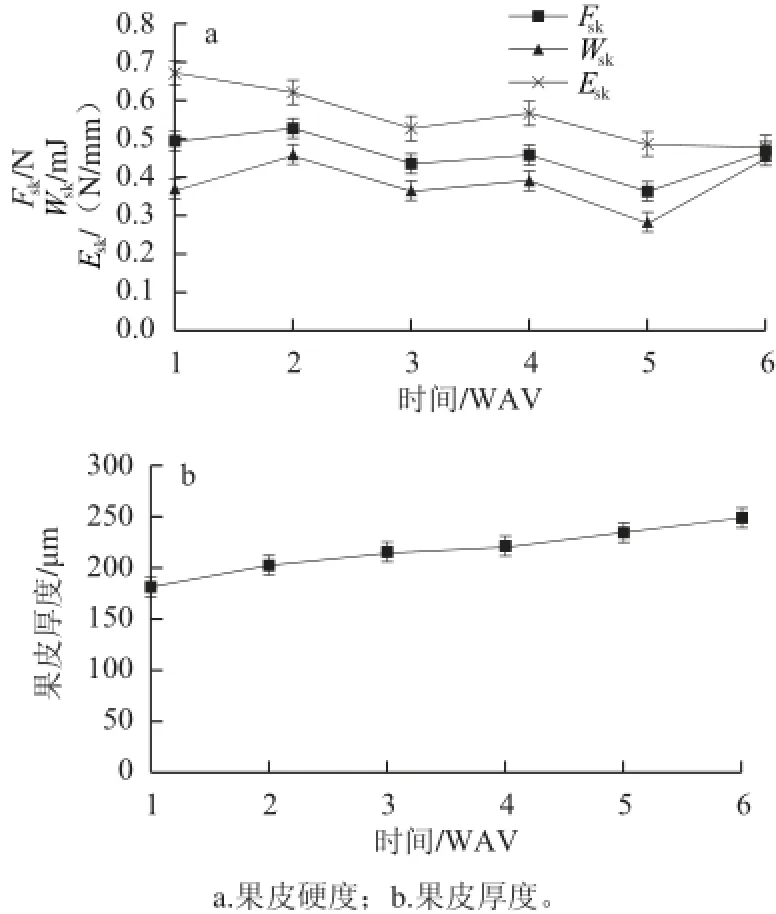
图 3 赤霞珠葡萄成熟期间果皮机械特性的变化Fig.3 Changes in mechanical properties of CS grape skin during ripening: hardness (a) and thickness (b)
2.2 赤霞珠果实成熟期间质构多面分析特性的变化

图 4 赤霞珠葡萄成熟期间浆果质构多面分析参数的变化Fig.4 Changes in textural profi le analysis parameters of CS grape during maturation
由图4可见,6 个表征参数可以近似地分为两组,其中葡萄BS、BCo和BR这3 个参数在成熟期间的变化较为平缓,特别是果实BCo在成熟期间没有显著变化。BCo反映的是咀嚼葡萄果肉时果肉抵抗牙齿咀嚼破坏而表现出的内部结合力,反映了果肉组织细胞间结合力的大小。BS指样品经过第1次压缩以后能够再恢复的程度。BR则指表示样品在第1次压缩过程中回弹的能力。在酿酒葡萄上,上述3 个参数与果实除梗破碎后汁液的浸出效率和发酵结束后的压榨效率密切相关。本实验条件下葡萄浆果BS、BCo和BR的动态变化较为平缓说明赤霞珠葡萄在成熟期间果肉组织的完整性比较稳定,成熟后期果实软化进程较为缓慢,有利于葡萄原料的采收和实现机械采收。
但是,由图4可以看出果实转色后BH、BG和BCh的变化较为复杂。其中BH随着果实的成熟而逐渐降低,直至6 WAV时降到最低值,为4.24 N。BG和BCh分别在2 WAV达到最大值,分别为3.79 N和2.75 mJ,果实成熟前变化较小。果实BH反映的是葡萄整个浆果在外力作用下发生形变所需要的屈服力大小。BG用于描述半固态测试样品的黏性特性。BCh为牙齿咀嚼果实样品时需要的能量,综合反映了果实对咀嚼的抵抗能力。研究发现,葡萄果实转色后果皮中多种细胞壁降解酶(如果胶酯酶、多聚半乳糖醛酸酶及β-半乳糖苷酶等)促使细胞壁物质降解引起细胞壁结构变化,而果肉中的原果胶在果胶酶的作用下分解为果胶,细胞间失去黏结作用,使果实细胞组织变得松弛,从而果实的硬度和坚实度下降[22-23]。
2.3 赤霞珠葡萄成熟期间花色苷含量的变化
红葡萄酒中的花色苷含量取决于葡萄浆果中花色苷的总量及可提取率。赤霞珠果实成熟期间果皮中花色苷含量的变化如表2所示。
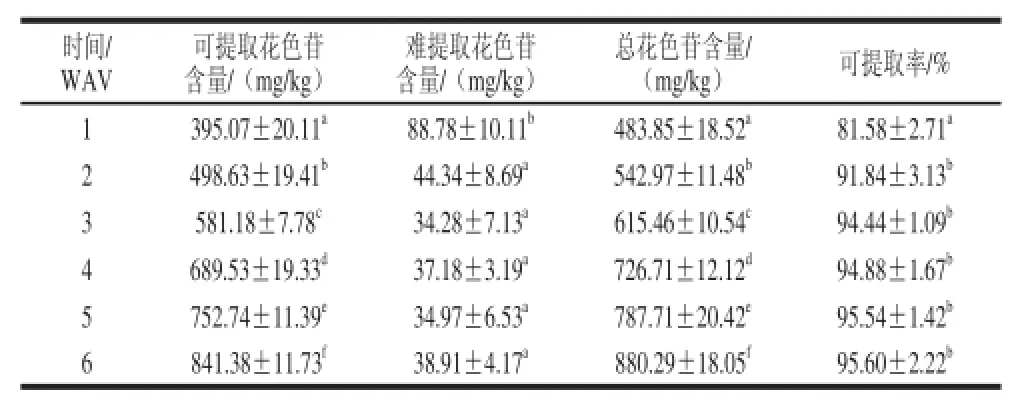
表 2 赤霞珠葡萄成熟期间果皮中花色苷含量和可提取率的变化Table 2 Changes in anthocyanins content and extractability in CS grape skin during maturation
由表2可以看出,葡萄转色后随着果实的发育果皮中的总花色苷含量和可提取花色苷含量均显著增加(P≤0.05),并在技术成熟度时(6 WAV)达到最大值,分别为880.29 mg/kg和841.38 mg/kg。而在转色后第1周果皮中的难提取花色苷含量最大,为88.78 mg/kg,然后显著降低,但转色后2周至果实成熟时果皮中难提取花色苷的含量变化较小,差异不显著。由表2还可以看出,赤霞珠葡萄果实转色后不同发育阶段果皮中的大部分花色苷均可被提取出来,其可提取率在整个成熟期间呈上升趋势,尤其是在2 WAV时显著上升(P≤0.05),此后各个时期间的差异不显著,并保持在95%左右。红色酿酒葡萄转色后随着果实的发育果皮中的细胞壁降解酶含量也逐渐增加,果皮逐渐变软,位于果皮细胞液泡中的花色苷能更加容易地被浸提出来。
2.4 赤霞珠果实成熟期间花色苷特性的变化
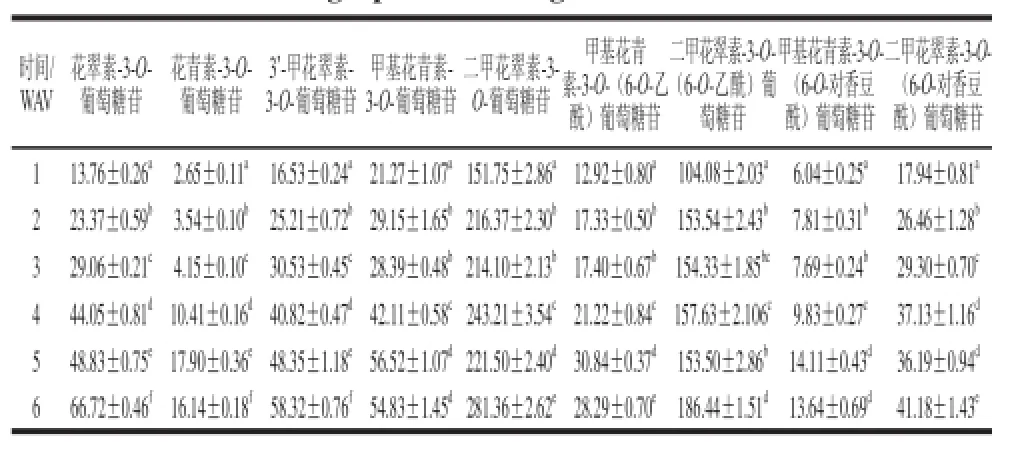
表 3 赤霞珠葡萄成熟期间果皮中9 种花色苷组分含量的变化Table 3 Changes in the contents of 9 anthocyanins components in of CS grape skin during maturation
由表3可以看出,葡萄果实的不同成熟阶段,在检测的9种主要花色苷中含量最多的是二甲花翠素-3-O-葡萄糖苷和二甲花翠素-3-O-(6-O-乙酰)葡萄糖苷。其中,二甲花翠素-3-O-葡萄糖苷的含量在2 WAV时显著增加,但随后变化规律不明显,这与果皮中不同花色苷组分的合成途径和相互转化有关。在技术成熟度时(6 WAV)二甲花翠素-3-O-葡萄糖苷含量达到最高,为281.36 mg/kg,占总花色苷含量的37.67%;其次是二甲花翠素-3-O-(6-O-乙酰)葡萄糖苷,果实成熟期间其含量变化规律和二甲花翠素-3-O-葡萄糖苷相似。在6 WAV时达到最高,为186.44 mg/kg,占总花色苷含量的24.96%。上述两种花色苷组分的含量构成了赤霞珠葡萄果皮中花色苷的主要部分,在果实成熟期间占花色苷总量的59.97%~73.74%,这与在红色酿酒葡萄Syrah[24]和 Tempranillo[25]上的研究结果一致。
2.5 赤霞珠果实成熟期间质地特性与花色苷含量的相关性
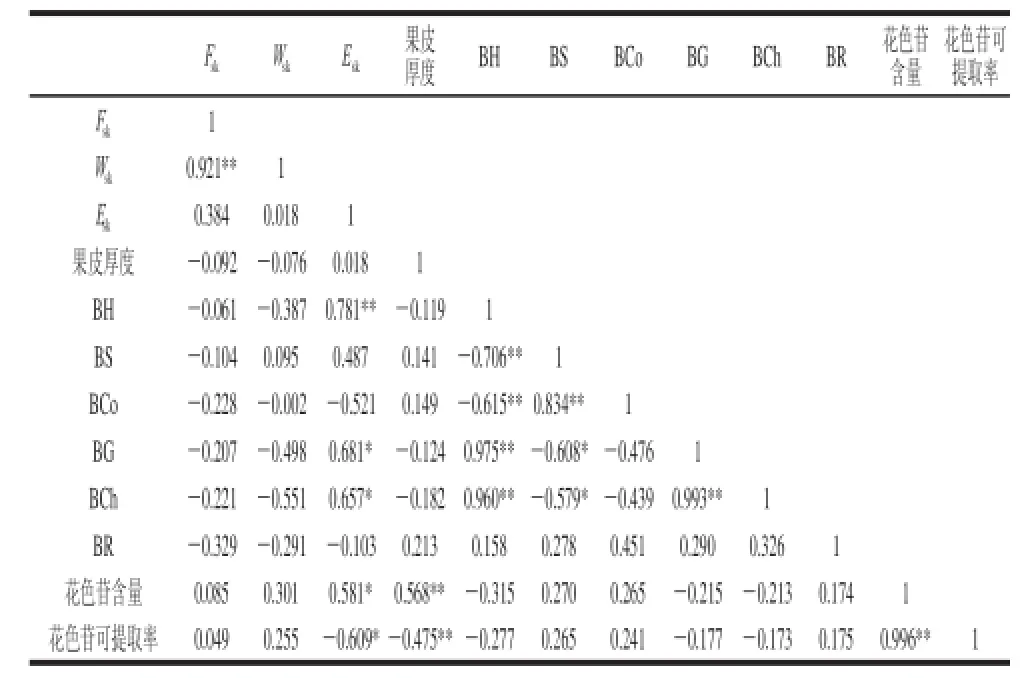
表 4 赤霞珠葡萄成熟期间质地特性与花色苷含量的相关性Table 4 Correlation between textural parameters and anthocyanins contents of CS grape during maturation
由表4可以看出,表征果皮硬度的两个参数Fsk和Wsk与质构多面分析的各参数及果皮中花色苷含量间没有相关性。但是当用Esk表征果皮硬度时其与果实BH、BG、BCh均呈显著或极显著正相关(R2为0.781、0.681、0.657)。另外,Esk与果皮总花色苷含量呈显著正相关(P≤0.05),而与花色苷可提取率呈现出显著的负相关(P≤0.05)。Esk值越大,表示穿过单位厚度的果皮需要的力越大,该参数既考虑了穿刺所需要的力,同时考虑了穿刺距离。另外,本实验条件下果皮厚度与总花色苷含量呈极显著正相关(R2=0.568),表明随着赤霞珠葡萄果实的逐步成熟,其果皮逐渐加厚,果皮细胞液泡中的花色苷总量逐渐增加。TPA各参数与果皮花色苷含量和提取率之间没有相关性。因为TPA表征的是整个浆果水平的质地特点,与果皮和果肉特性,以及种子的数量和大小等均有关[26]。
在本实验条件下赤霞珠葡萄果实BH与BCh呈较好的正相关性(R2=0.960),而与BCo呈负相关,这说明葡萄果实BH越大,BCh越强,二者均能反映果实的致密度及坚实度。此外,果实BH与BG也呈极显著的正相关性(P≤0.01)。果实BCh与BH、BG则呈现出极显著的正相关性(R2为0.960、0.993),这说明葡萄果实BCh越强,果实弹性越好,BG也越强。
3 结 论
1)酿酒葡萄赤霞珠果实成熟期间总花色苷和可提取花色苷含量逐渐增加,至转色后第6周(6 WAV)达到最大,分别为880.29 mg/kg和841.38 mg/kg。2)赤霞珠葡萄果实成熟期间果皮厚度逐渐增加,并与其花色苷含量呈极显著正相关(R2=0.568,P≤0.01),与可提取率呈极显著负相关(R2=—0.475,P≤0.01)。表征果皮硬度的3个参数中Esk与花色苷含量呈极显著正相关(R2=0.581,P≤0.01),与花色苷可提取率呈显著负相关(R2=—0.609,P≤0.05)。其他两个硬度参数Fsk和Wsk与花色苷含量和可提取率之间无相关性。3)质构多面分析各参数与果皮花色苷含量和可提取率之间均无相关性。
[1] HARDIE W J, OBRIEN T P, JAUDZEMS V G. Morphology, anatomy and development of the pericarp after anthesis in grape, Vitis vinifera L.[J]. Australian Journal of Grape and Wine Research, 1996, 2(2): 97-142.
[2] JENSEN J S, DEMIRAY S, EGEBO M, et al. Prediction of wine color attributes from the phenolic profi les of red grapes (Vitis vinifera)[J]. Journal of Agricultural and Food Chemistry, 2008, 56: 1105-1115.
[3] REVILLA E, GARCÍA-BENEYTEZ E, CABELLO F. Anthocyanin fingerprint of clones of Tempranillo grapes and wines made with them[J]. Australian Journal of Grape and Wine Research, 2009, 15(1): 70-78.
[4] RÍO-SEGADE S, VAZQUEZ E S, LOSADA E D. Influence of ripeness grade on accumulation and extractability of grape skin anthocyanins in different cultivars[J]. Journal of Food Composition and Analysis, 2008, 21: 599-607.
[5] CADOT Y, MIÑANA-CASTELLÓ M T, CHEVALIER M. Anatomical, histological, and histochemical changes in grape seeds from Vitis vinifera L. cv Cabernet franc during fruit development[J]. Journal of Agricultural and Food Chemistry, 2006, 54(24): 9206-9215.
[6] MOIGNE M L, MAURY C, BERTRAND D, et al. Sensory and instrumental characterization of Cabernet Franc grapes according to ripening stages and growing location[J]. Food Quality and Preference, 2008, 19(2): 220-231.
[7] ROMERO-CASCALES I, ORTEGA-REGULES A, LÓPEZ-ROCA J M, et al. Differences in anthocyanin extractability from grapes to wines according to variety[J]. American Journal of Enology and Viticulture, 2005, 56(3): 212-219.
[8] OREGA-REGULES A, ROMERO-CASCALES I, ROS-GARCÍA J M, et al. A fi rst approach towards the relationship between grape skin cellwall composition and anthocyanin extractability[J]. Analytica Chimica Acta, 2006, 563(1/2): 26-32.
[9] HERNÁNDEZ-HIERRO J M, QUIJADA-MORÍN N, MARÍNEZLAPUENTE L, et al. Relationship between skin cell wall composition and anthocyanin extractability of Vitis vinifera L. cv. Tempranillo at different grape ripeness degree[J]. Food Chemistry, 2014, 146: 41-47.
[10] BARNAVON L, DOCO T, TERRIER N, et al. Analysis of cell wall neutral sugar composition, β-galactosidase activity and a related cDNA clone throughout the development of Vitis vinifera grape berries[J]. Plant Physiology and Biochemistry, 2000, 38(4): 289-300.
[11] PINELO M, ARNOUS A, MEYER A S. Upgrading of grape skins: significance of plant cell-wall structural components and extraction techniques for phenol release[J]. Trends in Food Science and Technology, 2006, 17(11): 579-590.
[12] ROLLE L, SIRET R, RÍO SEGADE S, et al. Instrumental texture analysis parameters as markers of table-grape and winegrape quality: a review[J]. American Journal of Enology and Viticulture, 2012, 63(1): 11-28.
[13] 刘亚平, 刘兴华. 采后失水处理对葡萄电学特性的影响[J]. 农业机械学报, 2012, 43(9): 144-149.
[14] SATO A, YAMANE H, HIRAKAWA N, et al. Varietals differences in the texture of grape berries measured by penetration tests[J]. Vitis, 1997, 36(1): 7-10.
[15] 李志文, 张平, 张昆明, 等. 1-MCP结合冰温贮藏对葡萄果实质地的影响[J]. 农业机械学报, 2011, 42(7): 176-181.
[16] SATO A, YAMADA M. Berry texture of table, wine, and dual-purpose grape cultivars quantifi ed[J]. Hortiscience, 2003, 38(4): 578-581.
[17] ROLLE L, GIACOSA S, GERBI V, et al. Comparative study of texture properties, color characteristics, and chemical composition of ten white table-grape varieties[J]. American Journal of Enology and Viticulture, 2011, 62(1): 49-56.
[18] ROLLE L, RÍO-SEGADE S, FABRIZIO T, et al. Infl uence of grape density and harvest date on changes in phenolic composition, phenol extractability indices, and instrumental texture properties during ripening[J]. Journal of Agricultural and Food Chemistry, 2011, 59: 8796-8805.
[19] ROLLE L, TORCHIO F, GIACOSA S, et al. Modifications of mechanical characteristics and phenolic composition in berry skins and seeds of Mondeuse winegrapes throughout the on-vine drying process[J]. Journal of the Science of Food and Agriculture, 2009, 89: 1973-1980.
[20] ROLLE L, TORCHIO F, FERRANDINO A, et al. Infl uence of winegrape skin hardness on the kinetics of anthocyanin extraction[J]. International Journal of Food Properties, 2012, 15: 249-261.
[21] HARDIE W J, O’BRIEN T P, JAUDZEMS V G. Morphology, anatomy and development of the pericarp after anthesis in grape, Vitis vinifera L.[J]. Australian Journal of Grape and Wine Research, 1996, 2: 97-142.
[22] VICENS A, FOURNAND D, WILLIAMS P, et al. Changes in polysaccharide and protein composition of cell walls in grape berry skin (cv. Shiraz) during ripening and over-ripening[J]. Journal of Agricultural and Food Chemistry, 2009, 57: 2955-2960.
[23] 潘秀娟, 屠康. 质构仪质地多面分析(TPA)方法对苹果采后质地变化的检测[J]. 农业工程学报, 2005, 21(3): 166-170.
[24] JIN Zanmin, HE Jianjun, BI Heqiong, et al. Phenolic compound profi les in berry skins from nine red wine grape cultivars in northwest China[J]. Molecules, 2009, 14: 4922-4935.
[25] GUERRERO R F, LIAZID A, PALMA M, et al. Phenolic characterisation of red grapes autochthonous to Andalusia[J]. Food Chemistry, 2009, 112: 949- 955.
[26] 刘亚平, 刘兴华, 李红波. 葡萄冷藏中电学参数与质地特性变化规律[J]. 农业工程学报, 2011, 27(10): 343-348.
Changes in Textural Properties and Anthocyanins Content of Wine Grape during Maturation
LIU Xu, YANG Li, ZHANG Fangfang, ZHANG Zhenwen*
(Shaanxi Engineering Research Center for Viti-Viniculture, College of Enology, Northwest A&F University, Yangling 712100, China)
The changes in textural properties and anthocyanins content of Cabernet Sauvignon (Vitis vinifera L.) grapes were determined during maturation in the present study. The mechanical properties of grape skins and texture profile analysis (TPA) of berries were detected with a texture analyzer. Furthermore, the total anthocyanins content, the contents of 9 anthocyanins components and the extraction rate of anthocyanins in grape skin were determined at different maturity stages by spectrophotometry and high performance liquid chromatography (HPLC). The results showed that the contents of total and extractable anthocyanins in the skins of Cabernet Sauvignon grapes gradually increased after veraison, reaching the maximum level (880.29 and 841.38 mg/kg berry, respectively) at 6 weeks after veraison (WAV). The skin thickness increased during maturation and was signifi cantly positively correlated with the anthocyanins content in skin (R2= 0.568). However, the skin thickness showed an extremely negative correlation with the extraction rate of anthocyanins (R2= - 0.475). One of the skin hardness parameters, Young’s modulus (Esk) was found to be positively correlated with the anthocyanins content in skin (R2= 0.581), and to be negatively correlated with the extraction rate of anthocyanins (R2= - 0.609). However, no statistical relationship was found among the TPA parameters, the anthocyanins content and the extraction rate of anthocyanins in skin.
wine grape; textural properties; anthocyanins
S663.1
A
1002-6630(2015)02-0105-05
10.7506/spkx1002-6630-201502020
2014-04-04
中央高校基本科研业务费专项(QN2011099);国家葡萄产业技术体系酿酒葡萄栽培岗位子项目(CARS-30-02A);
西北农林科技大学基本科研业务费专项(XNY2013-60);“十二五”国家科技支撑计划项目(2012BAD31B07);
陕西省农业攻关项目(2014K01-08-01)
刘旭(1980—),男,讲师,博士,研究方向为葡萄果实生理与质量控制。E-mail:liuxu@nwsuaf.edu.cn
*通信作者:张振文(1960—),男,教授,硕士,研究方向为葡萄栽培生理与生态。E-mail:zhangzhw60@nwsuaf.edu.cn
