气相色谱法检测油脂中低热量短长链甘油三酯
2015-12-10操丽丽操新民潘丽军姜绍通
操丽丽,操新民,庞 敏,潘丽军,姜绍通*
(合肥工业大学生物与食品工程学院,安徽省农产品精深加工重点实验室,安徽 合肥 230009)
气相色谱法检测油脂中低热量短长链甘油三酯
操丽丽,操新民,庞 敏,潘丽军,姜绍通*
(合肥工业大学生物与食品工程学院,安徽省农产品精深加工重点实验室,安徽 合肥 230009)
利用气相色谱-质谱联用技术结合计算机质谱库检索和特征离子,对短长链甘油三酯进行组分鉴定。建立以DB-17 ht熔融石英毛细管柱作为分析柱,气相色谱-氢火焰离子化检测器分析油脂样品中短长链甘油三酯含量的方法。结果表明,在质量浓度0.5~20.0 mg/mL范围内,含量与峰面积呈现良好的线性关系;各组分的保留时间和峰面积的相对标准偏差分别小于0.05%和2.0%,方法的重复性好。转酯化和普通大豆油加标回收实验表明,平均回收率分别为98.62%和97.59%。该方法可对短长链甘油三酯各组分进行分离,精确度高、重复性好,可用于油脂中短长链甘油三酯的含量分析。
气相色谱;短长链甘油三酯;质谱;氢火焰离子化检测器
短长链甘油三酯(short and long chain triglycerides,SLCTs)是指含有2 个短碳链脂肪酸(乙酸、丙酸和/或丁酸)和1 个长碳链脂肪酸的甘油三酯(triglycerides with two short-chain and one long-chain fatty acids,SSL)或是含有1 个短碳链脂肪酸和2 个长碳链脂肪酸的甘油三酯(triglycerides with one short-chain and two long-chain fatty acids,SLL)[1]。SLCTs具有与普通油脂相似的物化性质和口感,但其热量(4.5~6 kcal/g)要比普通油脂热量(9 kcal/g)低,且具有降低胆固醇、降血脂的功效[2-3]。以Nabisco食品公司生产的Salatrim为代表的SLCTs作为油脂替代品,因其热量低、安全性好,在国内外具有非常良好的应用前景。
SLCTs的分析方法主要有薄层色谱(thin layer chromatography,TLC)法[4]、高效液相色谱(high performance liquid chromatography,HPLC)法[5-9]、气相色谱(gas chromatography,GC)法[10-12]、质谱(mass spectrometry,MS)法[13-14]等。TLC是分离中性脂类最简单、最常用的一种方法[15],但定量不是十分精确。由于甘油三酯沸点高,目前普遍采用HPLC-蒸发光散射检测器(evaporative light-scattering detector,ELSD)法对SLCTs和其他类甘油三酯进行组分和含量的分析,但此法需要标准品作对照进行定性分析,在应用中需消耗有机溶剂,费用高且会造成污染。MS包括HPLC-MS和GCMS,可以同时对SLCTs进行定性分析和定量分析,但设备昂贵。
GC因其高效、快速、费用低、污染小等分离特性,是有机物分析的最有效手段之一。随着高温气相色谱柱的发展,使得运用GC分析高沸点的甘油三酯成为可能。Tomáš等[16]利用高温毛细管色谱柱,采用气相色谱-火焰离子化检测器(gas chromatography-flame ionization detector,GC-FID)对13 种植物油中甘油三酯的组成进行了分析;Cristina等[17-18]通过GC-MS分析了标准橄榄油中甘油三酯的组成,并对各组分的含量进行了测定。在对于SLCTs分析中,Huang等[10-11]用5 m短的非极性熔融石英毛细管,采用GC-FID结合GC-MS法对食品中的SLCTs进行定性和定量分析;Yang等[12]用25 m长的极性熔融石英毛细管柱对酶催化三乙酸甘油酯和硬脂酸转酯化反应体系中SLCTs进行GC定量分析。
DB-17 ht熔融石英毛细管柱是中等极性色谱柱,一般用来分析中等极性物质单甘酯、甘油二酯[19-20]。由于SLCTs的甘油骨架上的2 个长链脂肪酸被短链脂肪酸替代,相较于长链甘油三酯来说,极性增强了。故本研究以DB-17 ht熔融石英毛细管柱作为分析柱,通过GC-MS法对SLCTs的质谱进行定性分析,并利用三丁酸甘油三酯作为内标,GC-FID法对油脂中SLCTs进行定量分析,研究建立一种快速、简便、精确的低热量结构脂质的分析方法。
1 材料与方法
1.1 材料与试剂
大豆油(一级) 益海粮油工业有限公司;Lipozyme TL IM酶(来自Thermomyces lanuginosa) 诺维信生物制药有限公司;三丁酸甘油酯(含量大于99%)美国Sigma公司;三乙酸甘油酯(含量大于98.5%)、正己烷(色谱纯)、乙腈(色谱纯)、丙酮(色谱纯)国药集团化学试剂有限公司;其他试剂皆为分析纯。
1.2 仪器与设备
SHY-2A型恒温气浴摇床 江苏金坛市金城国胜实验仪器厂;旋转蒸发器 德国Heidolph公司;分子蒸馏仪 德国U.I.C公司;GCMS-QP2010气相质谱仪(配备四极杆质谱和FID检测器) 日本岛津公司;2695高效液相色谱仪(配备2424蒸发光散射检测器) 美国Waters公司。
1.3 方法
1.3.1 转酯化合成SLCTs
称取15 g固定化脂肪酶Lipozyme TL IM,装入经烘干的500 mL锥形瓶中,加入150 μL蒸馏水,混匀后将锥形瓶封口后放入冰箱中过夜;再分别称取100 g大豆油、50 g三乙酸甘油酯加入锥形瓶中,用封口膜密封后置于摇床,55 ℃,180 r/min,反应12 h。反应结束后,取出锥形瓶,并静置一段时间使脂肪酶自然沉降,取出上层油样进行分析和纯化。
1.3.2 分子蒸馏纯化SLCTs
对转酯化产物进行二级分子蒸馏并结合碱炼脱酸进行纯化。一级分子蒸馏条件为:蒸馏温度110 ℃、压力0.1 Pa、刮板转速240 r/min、进料速率3 mL/min,收集重相油样用于碱炼脱酸。经一级分子蒸馏后的油样,测定酸值[21],参照罗晓岚[22]碱炼方法进行脱酸。二级分子蒸馏条件为:蒸馏温度180 ℃、压力0.1 Pa、刮板转速240 r/min、进料速率3 mL/min,收集轻相,用于SLCTs的纯度检测及后续实验。
1.3.3 HPLC-ELSD测定纯度
准确称取200 mg纯化后SLCTs油样,用正己烷定容至100 mL。取1 mL进行HPLC-ELSD分析。
色谱条件:Symmetry RP C18色谱柱(4.6 mm× 250 mm,5 μm);流动相:乙腈-丙酮(50∶50,V/V);流速1.0 mL/min;柱温30 ℃;漂移管温度60℃;N2压力25 psi;进样量5 μL;增益50。
1.3.4 GC-MS分析条件
样品准备:称取约20 mg转酯化反应结束后的油样,用10 mL正己烷溶解,过0.45 μm滤膜后用于GC-MS分析。
色谱条件:DB-17 ht熔融石英毛细管柱(30 m× 0.25 mm,0.25 μm);载气为高纯氦气;流速1.5mL/min;分流比50∶1;进样量1 μL;溶剂延迟3 min。进样口温度350 ℃;接口温度320 ℃;升温程序:柱温100 ℃,保持1 min,以10 ℃/min速率升至150 ℃,再以20 ℃/min速率升至270 ℃,最后以5 ℃/min速率升至320 ℃,保持8 min。
质谱条件:电子电离源;电子能量70 eV;离子源温度250 ℃;扫描范围m/z 40~1000;电子倍增器电压1.25 kV。
1.3.5 GC-FID分析条件
样品准备:准确称取三丁酸甘油三酯,用正己烷溶液溶解定容,配制成质量浓度1 mg/mL含内标物的溶液。将转酯化反应产物油样用含内标的正己烷溶液配制20.0 mg/mL的样品溶液,过0.45 μm滤膜后用于GC-FID分析。
色谱条件:DB-17 ht熔融石英毛细管柱(30 m× 0.25 mm,0.25 μm);载气为高纯氦气;流速1.5 mL/min;分流比50∶1;进样量1 μL;溶剂延迟2 min。进样口温度350 ℃;FID温度360 ℃;升温程序:柱温180 ℃,以10 ℃/min速率升至230 ℃,再以5 ℃/min速率升至270 ℃,最后以20 ℃/min升至320 ℃,保持10 min;空气流速400 mL/min;氢气流速50 mL/min。
1.4 数据处理
1.4.1 SLCTs定性分析
通过离子碎片信息结合NIST 05和NIST 05S谱库判断甘油骨架上脂肪酸种类,推断甘油三酯的类型。
1.4.2 SLCTs定量分析

式中:Ws为样品中SLCTs含量/(mg/100 mg);Ri为标准样中内标物的峰面积与样品中内标物的峰面积的比值;ρ标为标准样的质量浓度/(mg/mL);As为样品中SLCTs总峰面积;A标为标准样中SLCTs总峰面积;ms为样品质量/mg。
2 结果与分析
2.1 GC-MS定性分析
按照1.3.4节色谱条件对转酯化反应后的SLCTs样品进行测定,其总离子流图见图1。

图 1 SLCTs样品的GC-MS总离子色谱图Fig.1 GC-MS total ion chromatogram of SLCTs sample
大豆油是由棕榈酸、硬脂酸、油酸、亚油酸、亚麻酸等脂肪酸组成的甘油三酯,与三乙酸甘油酯在1,3-位特异性脂肪酸Lipozyme TL IM催化条件下转酯化反应后生成的SLCTs,合成的SLCTs的脂肪酸主要是乙酸、棕榈酸、硬脂酸、油酸、亚油酸、亚麻酸。由于SLCTs没有商品化的标准品可买,质谱数据库也仅三乙酸甘油酯、三棕榈酸甘油酯等少量标准图谱对照,需要对照每种物质的实验质谱图对其结构进行分析。甘油三酯的GC-MS质谱很有规律,主要有[RCO]+、[M—RCO2]+、[RCO+ 74]+和[RCO+128]+4 类碎片离子,其中[RCO]+、[M—RCO2]+丰度较大[10,23-24]。乙酸、棕榈酸、硬脂酸、油酸、亚油酸、亚麻酸对应的[RCO]+的m/z分别为43、239、267、265、263、261,二酰基总碳数为4、6、8、 10、12、14、16、18、20、22、24、26、28、30、32、34、36对应的[M—RCO2]+的m/z分别为159、187、215、243、271、299、327、355、383、411、439、467、495、523、551、579、607。
根据实验所得的质谱数据,并结合NIST 05和NIST 05S谱库信息,对转酯化反应得到的SLCTs样品进行分析,结果见表1。在保留时间13~15 min之间的甘油三酯主要是含有SSL,也是实验目标产物;保留时间在24~30 min之间的甘油三酯主要是SLL。从峰面积上来说,SSL的含量明显超出SLL,且SSL相较与SLL来说,热量更低一些,所以本研究更侧重于对SSL进行定量分析。图2为峰6的质谱图,从其中特征离子m/z 43、117、159、171、239、355,可以判断为乙酸棕榈酸乙酸甘油三酯。
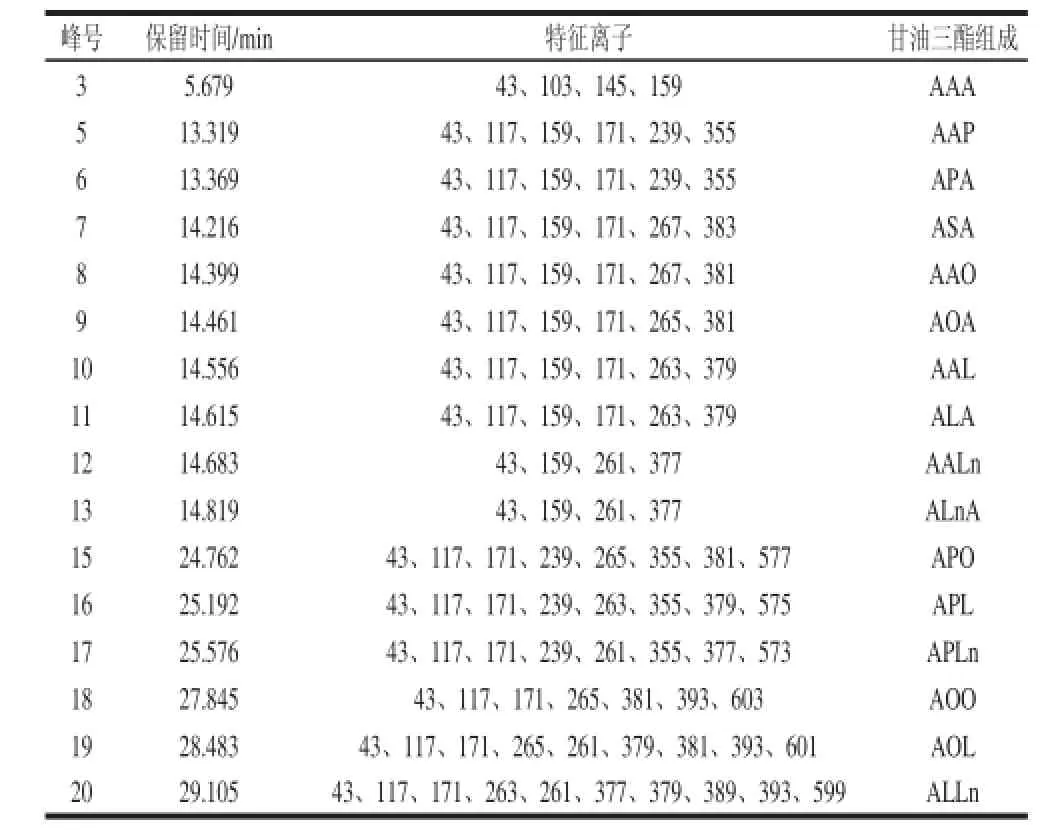
表 1 SLCTs样品组成分析结果Table 1 Analytical results for the composition of SLCTs sample

图 2 6号峰的质谱图Fig.2 Mass spectrum of peak 6
2.2 SLCTs纯度的测定
由于SLCTs的商品化的标准品买不到,为了对油品中SLCTs准确定量,实验室自制了SLCTs混合标品。利用二级分子蒸馏结合碱法脱酸,得到的SLCTs混合的纯品,通过HPLC-ELSD测定其纯度,其图谱见图3。由于反相HPLC分离甘油三酯是依据甘油骨架上总碳原子递增的顺序流出、不饱和度比饱和先流出的原则[6],从图3结果可以判断,SLCTs纯品中没有3 个长链脂肪酸的甘油三酯,并且保留时间在3.0~5.0 min之间的组分是SSL型短长链甘油三酯,保留时间在7.0~10.0 min之间的组分是SLL型短长链甘油三酯。采用面积归一化法,确定SSL型SLCTs的含量达到了98.52%,可作为SLCTs混合物的标准品来进行定量。

图 3 SLCTs纯品的HPLC图谱Fig.3 HPLC chromatogram of pure SLCTs
2.3 GC-FID分析样品
取一定量的转酯化油样用含三丁酸甘油酯做为内标物的正己烷溶液溶解后,在1.3.4节GC-MS色谱条件的基础上进行GC分析。为了缩短分离时间并保证SLCTs各组分足够分离度,选用不同载气流量(1.0、1.5、2.0、2.5、3.0 mL/min),以及不同的程序升温的方法对分离条件进行了优化,最终确定了1.3.5节GC分离条件,在此色谱条件基础上,对样品进行GC分析,结果见图4。从图4可看出,SSL型SLCTs在13 min内得到了很好的分离,且内标物与SLCTs各组分不会产生干扰,分离度大。

图 4 SLCTs样品的GC图谱Fig.4 GC chromatogram of SLCTs sample
2.4 标准曲线的建立
将SLCTs混合纯品用含1.0 mg/mL三丁酸甘油酯的正己烷溶液配成质量浓度为20.0、10.0、4.0、2.0、1.0、0.5 mg/mL的标准溶液,分别在1.3.5节色谱条件下进行GC分析。以SLCTs质量浓度(x,mg/mL)为横坐标,经内标物校正后SLCTs的峰面积(y)为纵坐标绘制标准曲线,得到方程y=109 614x—21 485,R2=0.999 7。结果表明,SLCTs在0.5~20.0 mg/mL范围内,质量浓度与峰面积具有良好的线性关系。
2.5 精密度实验
将含内标物的20.0 mg/mL的SLCTs样品进行GC分析,重复进样6 次,以峰面积和保留时间计算精密度,见表2。从表2可以看出,样品中各种SLCTs组分保留时间和峰面积的相对标准偏差(relative standard deviation,RSD)分别小于0.05%和2.0%,说明该方法精密度高。

表 2 精密度实验结果(n=6)Table 2 Precision of the method (n = 6)
2.6 回收率测定
在转酯化油样和大豆油中加入SLCTs纯品,在1.3.5节色谱条件下进行GC分析,结果见表3。SLCTs在转酯化样品和大豆油中的平均回收率分别为98.62%和97.59%,RSD值均小于2%,表明该方法具有较高的准确度。

表 3 样品加标回收率(n=3)Table 3 Recovery rates of SLCTs (n = 3)
3 结 论
本实验以中等极性DB-17 ht熔融石英毛细管柱作为分析柱,利用GC-MS联用技术结合计算机质谱库检索和特征离子,对油脂样品中SLCTs各个组分进行鉴定分析。以实验室自制的SLCTs纯品(SLL含量大于98.5%)作为标准品,以三丁酸甘油三酯作为内标物,建立了GC-FID快速检测SLCTs含量的分析方法。实验结果表明,该方法前处理简单,准确度高,有良好的精密度和准确度。为测定油脂中SLCTs物质提供了较为准确、可靠的分析方法,从而为功能性油脂的质量控制和安全性评价提供可科学依据。
参考文献:
[1] SOFTLY B J, HUANG A S, FINLEY J W, et al. Composition of representative SALATRIM fat preparations[J]. Journal of Agricultural and Food Chemistry, 1994, 42(2): 461-467.
[2] MANGOS T J, JONES K C, FOGLIA T A. Lipase-catalyzed synthesis of structured low-calorie triacylglycerols[J]. Journal of the American Oil Chemists’ Society, 1999, 76(10): 1127-1132.
[3] FINLEY J W, KLEMANN L P, LEVEILLE G A, et al. Caloric availability of salatrim in rats and humans[J]. Journal of Agricultural and Food Chemistry, 1994, 42(2): 495-499.
[4] TSUZUKI W. Acidolysis between triolein and short chain fatty acid by lipase in organic solvents[J]. Bioscience Biotechnology and Biochemistry, 2005, 69(7): 1256-1261.
[5] FOMUSO L B, AKOH C C. Enzymatic modification of triolein: incorporation of caproic and butyric acids to produce reduced-calorie structured lipids[J]. Journal of the American Oil Chemists’ Society, 1997, 74(3): 269-272.
[6] LEE K T, JONES K C, FOGLIA T A. Separation of structured lipids by high performance liquid chromatography[J]. Chromatographia, 2002, 55(3): 197-201.
[7] LEE J H, JONES K C, FOGLIA T A, et al. Separation of triacylglycerol species from interesterifi ed oils by high-performance liquid chromatography[J]. Journal of the American Oil Chemists’Society, 2007, 84(3): 211-217.
[8] CAO Y, QI S J, ZHANG Y, et al. Synthesis of structured lipids by lipase-catalyzed interesterifi cation of triacetin with camellia oil methyl esters and preliminary evaluation of their plasma lipid-lowering effect in mice[J]. Molecules, 2013, 18(4): 3733-3744.
[9] HAN L, XU Z, HUANG J, et al. Enzymatically catalyzed synthesis of low-calorie structured lipid in a solvent-free system: optimization by response surface methodology[J]. Journal of Agricultural and Food Chemistry, 2011, 59(23): 12635-12642.
[10] HUANG A S, ROBINSON L R, GURSKY L, et al. Quantifi cation of generic Salatrim material in foods by the combination of nontraditional crude fat extraction and short nonpolar high temperature capillary gas chromatography[J]. Journal of Agricultural and Food Chemistry, 1995, 43(7): 1834-1844.
[11] HUANG A S, ROBINSON L R, PELLUSO T A, et al. Quantifi cation of generic Salatrim in foods containing Salatrim and other fats having medium-and long-chain fatty acids[J]. Journal of Agricultural and Food Chemistry, 1997, 45(5): 1770-1778.
[12] YANG T H, JANG Y, HAN J J, et al. Enzymatic synthesis of lowcalorie structured lipids in a solvent-free system[J]. Journal of the American Oil Chemists’ Society, 2001, 78(3): 291-296.
[13] HUANG A S, ROBINSON L R, GURSKY L, et al. The identifi cation and quantifi cation of Salatrim 23CA in foods by the combination of supercritical fluid extraction, particle peam LC-mass spectrometry, and HPLC with light scattering detector[J]. Journal of Agricultural and Food Chemistry, 1994, 42(2): 468-473.
[14] LEE J H, JONES K C, LEE K T, et al. High-performance liquid chromatographic separation of structured lipids produced by interesterifi cation of macadamia oil with tributyrin and tricaprylin[J]. Chromatographia, 2003, 58(9/10): 653-658.
[15] 孟祥河, 章银军, 毛忠贵. 甘油酯的分析方法[J]. 中国油脂, 2004, 29(1): 44-46.
[16] TOMÁŠ Ř, HANA Ř. Characterization of fatty acids and triacylglycerols in vegetableoils by gas chromatography and statistical analysis[J]. Analytica Chimica Acta, 1999, 398(2/3): 253-261.
[17] CEISTINA R S, FEDERICO M, LUIS C R, et al. Quantification of blending of olive oils and edible vegetable oils by triacylglycerol fi ngerprint gas chromatography and chemometric tools[J]. Journal of Chromatography B, 2012, 910(23): 71-77.
[18] CEISTINA R S, LUIS C R, ANTONIO G C, et al. Multivariate analysis of HT/GC-(IT) MS chromatographic profi les of triacylglycerol for classifi cation of olive oil varieties[J]. Analytical and Bio analytical Chemistry, 2011, 399: 2093-2103.
[19] 王丽丽, 汪勇, 胡长鹰, 等. 高温气相色谱分析甘油酯的研究[J]. 中国油脂, 2011, 36(1): 75-79.
[20] PAIKA M J, KIMB H, LEEB J, et al. Separation of triacylglycerols and free fatty acids in microalgal lipids by solid-phase extraction for separate fatty acid profiling analysis by gas chromatography[J]. Journal of Chromatography A, 2009, 1216: 5917-5923.
[21] 国粮局西安油脂科研院. GB/T 5530—2005 动植物油脂酸值和酸度的测定[S]. 北京: 中国标准出版社, 2005.
[22] 罗晓岚. 对油脂碱炼工艺的改进[J]. 中国油脂, 2006, 31(5): 17-19.
[23] 邹建凯. 椰子油甘油三酯的高温气相色谱/质谱分析[J]. 分析化学, 2002, 30(4): 428-431.
[24] 邹建凯. 奶油甘油三酯的毛细管气相色谱-EI质谱分析[J]. 分析测试学报, 2002, 21(5): 79-81.
[25] 朱桃花, 范璐, 钱向明, 等. HPLC分析植物油脂甘油三酯结构组成的研究现状[J]. 中国油脂, 2011, 36(5): 59-63.
Determination of Short and Long Chain Triglycerides in Edible Oils by Gas Chromatography
CAO Lili, CAO Xinmin, PANG Min, PAN Lijun, JIANG Shaotong*
(Anhui Key Laboratory of Intensive Processing of Agricultural Products, College of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China)
The chemical compositions of short and long chain triglycerides (SLCTs) were analyzed by gas chromatographymass spectrometry (GC-MS) through mass spectral library searching and characteristic ions. A gas chromatography with fl ame ionization detection (GC-FID) method was developed for determining the content of SLCTs in edible oil samples using DB-17 ht fused silica capillary column as the analytical column. The results showed a good linear correlation between peak area and concentration in the range of 0.5–20.0 mg/mL. The relative standard deviations for retention time and peak area of each SLCT were less than 0.05% and 2.0%, respectively, suggesting good reproducibility of the developed method. The average recoveries from spiked samples of transesterifi ed and original soybean oil were 98.62% and 97.59%, respectively. This method allowed accurate and highly repeatable quantifi cation of SLCTs in edible oils.
gas chromatography (GC); short and long chain triglycerides; mass spectrometry (MS); flame ionization detector (FID)
TS227
A
1002-6630(2015)02-0085-05
10.7506/spkx1002-6630-201502016
2014-07-03
国家自然科学基金面上项目(31371729);“十一五”国家科技支撑计划项目(2010BAD01B07);
合肥工业大学青年教师创新项目(2013HGQC0006)
操丽丽(1979—),女,讲师,博士研究生,主要从事油脂加工与分析研究。E-mail:lilycao504@hotmail.com
*通信作者:姜绍通(1954—),男,教授,学士,主要从事农产品加工与贮藏研究。E-mail:jiangshaotong@163.com
