八角 茴香叶中黄酮的微波提取及纯化
2015-12-10张禄捷姜子涛
刘 韬,李 荣*,张禄捷,姜子涛
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
八角 茴香叶中黄酮的微波提取及纯化
刘 韬,李 荣*,张禄捷,姜子涛
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
通过Plackett-Bu rman试验设计和响应面法确定八角茴香叶黄酮的最佳微波提取条件:乙醇体积分数67%、液料比26∶1、微波温度75℃、微波起始功率500W、微波时间8 min。在此条件下,黄酮的得率为6.97%。采用D101大孔树脂和制备色谱两种方式纯化八角茴香叶黄酮,结果表明制备色谱不仅能够高效快速地纯化八角茴香叶黄酮,并且能够对黄酮成分进行初步分离。
八角茴香叶;响应面;大孔树脂;制备色谱
八角茴香(Illicium verum Hook. f.)为木兰科八角属植物,别名大料、八角、大茴香。八角茴香原产于我国的广 西,现云南、福建、浙江、广东以及越南与我国接壤的地区也有栽培。八角茴香的果实是中国传统的调味香料和中药材[1-2]。除用于食品的调味外,也用于治疗呕吐、胃痛、失眠、皮肤红肿和风湿痛等症[3-6]。关于八角茴香果实化学成分的研究,已有八角茴香油[7]、莽草酸[8-9]和其他倍半萜内酯[10-11]方面的报道。但目前对八角茴香叶的化学成分的研究还很少,八角茴香叶来源丰富,且可用来提取八角茴香叶油,每100kg八角茴香鲜叶可生产八角茴香叶油0.8~1. 0kg[12]。杜正彩等[13]优化了从八角茴香枝叶提取挥发油所产生的废水中分离莽草酸的工艺。另外,八角茴香叶富含黄酮类化合物,莫丽玲等[14]报道了八角茴香叶总黄酮的提取方法,并测定了该黄酮混合物清除自由基的能力;鲍泥满等[15]从八角枝叶中分离出2 种黄酮类成分;易国富等[16]测定了八角茴香叶的黄酮苷元的种类及其含量。
为了充分利用八角茴香叶资源,本研究采用微波辅助快速提取的方式[17]提取了八角茴香叶黄酮,大大缩短了八角茴香叶黄酮的提取时间,通过Plackett-Burman试验设计和响应面法确定了微波辅助提取八角茴香叶黄酮的最佳条件。并且利用大孔吸附树脂和制备色谱对所获得的黄酮进行了提纯,为八角茴香叶的综合利用提供了科学依据。
1 材料与方法
1.1 材料与试剂
八角茴香叶产自广西壮族自治区河池市,经清洗后在70℃鼓风干燥箱中烘干,粉碎约40目备用。
D101聚苯乙烯交联二乙烯苯型非极性大孔树脂、AB-8聚苯乙烯交联二乙烯苯弱极性大孔树脂、NKA-9聚苯乙烯交联二乙烯苯极性大孔树脂、聚酰胺型大孔树脂南开大学化学工厂;芦丁标准品(分析纯) 北京化学试剂公司;纯净水 杭州娃哈哈集团有限公司;甲醇(色谱纯) 天津市科密欧化学试剂有限公司;石油醚(分析纯,沸程30~60℃) 天津市风船化学试剂科技有限公司。其他试剂均为分析纯。
1.2 仪器与设备
Grace RevelerisTM全息快速纯化色谱系统、SSI 1500高效液相色谱(high performance liquid chromatography,HPLC)仪(配备四元梯度泵) 美国Alltech公司;Lambda 25紫外-可见分光光度计 珀金埃尔默仪器有限公司;Multisynth微波合成仪 意大利Milestone公司;Alpha-1500紫外-可见分光光度计 上海谱元仪器有限公司;FA1104N型电子天平 上海精密仪器有限公司;RE52-86A型旋转蒸发仪 上海亚荣生化仪器厂。
1.3 方法
1.3.1 八角茴香叶黄酮微波提取工艺
称取1.0g八角茴香叶粉末,放入微波合成仪的圆底烧瓶中,加入一定比例的乙醇溶液,在一定的微波功率、微波温度和微波时间条件下,用微波合成仪萃取,待提取液冷却后过滤,滤液经石油醚萃取3 次,弃去石油醚层,所得滤液定容至30 mL作为黄酮提取液。
1.3.2 提取条件优化试验设计
确定Plackett-Burman试验的因素及水平,包括乙醇体积分数、液料比、微波温度、微波时间、微波起始功率5 个因素以及每个因素的高低2 个水平,共12 组试验,每组试验重复3 次,响应值为268 nm波长处的吸光度。Plackett-Burman试验因素与水平见表1。
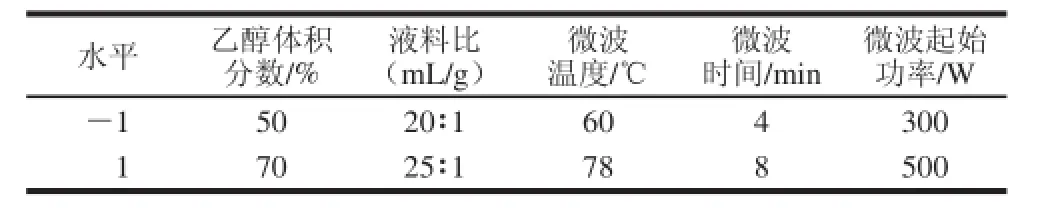
表 1 Plackett-Burman试验因素及水平Table 1 Factors and levels used in Plackett-Burman design
在Plackett-Burman试验的基础上,根据Box-Behnken试验设计,以268 nm波长处吸光度为响应值,选取乙醇体积分数、液料比、微波温度作为3 个影响因素,每个因素设定高中低三水平,设计三因素三水平的试验方案,共计15 组试验。其中,中心试验重复3 次,编码水平见表2。

表 2 响应面试验因素编码及水平Table 2 Factors and levels used in response surface design
1.3.3 八角茴香叶黄酮含量测定
取1.0 mL提取液,按照1∶40稀释,于268 nm波长处测定吸光度,根据芦丁标准曲线得到黄酮质量浓度,按式(1)计算黄酮得率:
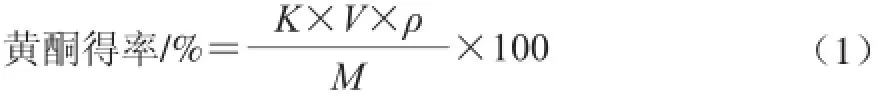
式中:K为稀释倍数;V为提取液总体积/mL;ρ为黄酮质量浓度/(mg/L);M为八角叶质量/mg。
1.3.4 八角茴香叶黄酮样品液的制备
按照1.3.1节方法在最佳工艺条件下得到黄酮提取液,再经减压旋蒸至无乙醇后,冷冻干燥。称取冷冻干燥的八角茴香叶粗黄酮粉末0.5 g,加入少量乙醇溶解,转移至500 mL容量瓶中用水定容,即得1.0 mg/mL的八角茴香叶粗黄酮储备液,为样品液备用。
1.3.5 大孔吸附树脂的筛选
1.3.5.1 树脂预处理
将大孔树脂于体积分数95%乙醇中浸泡12h,用蒸馏水洗至无醇,然后用5% HCl溶液浸泡3h,用蒸馏水洗至流出液pH值为中性,之后用5% NaOH溶液浸泡3h,用蒸馏水洗至流出液pH值为中性,用蒸馏水浸泡备用[18]。
1.3.5.2 树脂的静态吸附与解吸
称取经预处理的D101、AB-8、NKA-9或聚酰胺大孔树脂各1.0 g于100 mL具塞锥形瓶中,分别加入20 mL样品液(1.0 mg/mL),室温条件下水浴振荡24 h,分别扫描经大孔树脂吸附的上清液(按1∶10稀释)吸收光谱。
将上述吸附黄酮的大孔树脂分别转移至新的100 mL具塞瓶中,分别加入20 mL 70%乙醇溶液,室温条件下水浴振荡24 h,扫描解吸液(按1∶10稀释)的吸收光谱。
根据268 nm波长处的吸光度,计算吸附率和解吸率:
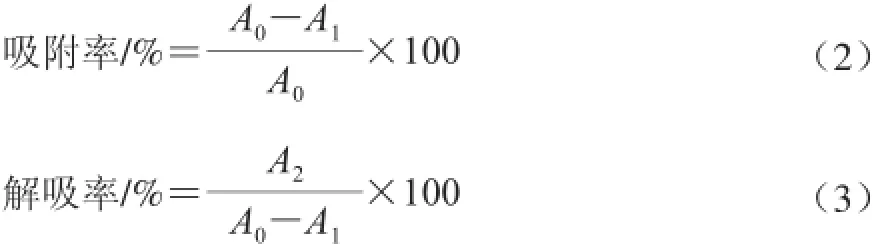
式中:A0为0.1 mg/mL样品液在268 nm波长处的吸光度;A1为吸附上清液按1∶10稀释,在268 nm波长处的吸光度;A2为解吸液按1∶10稀释,在268 nm波长处的吸光度。
1.3.5.3 静态吸附动力学曲线的测定
称取1.08g经预处理的D101大孔树脂于100mL的具塞瓶中,加入1.0mg/mL的样品液22mL,室温条件下水浴振荡,每隔15min测定一次上清液(按1∶10稀释)的吸光度,以时间为横坐标、吸附量为纵坐标绘制D101大孔树脂对样品液的静态吸附动力学曲线。
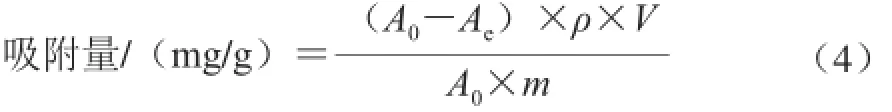
式中:A0为0.1 mg/mL样品液在268 nm波长处的吸光度;Ae为吸附上清液按1∶10稀释,在268 nm波长处的吸光度;ρ为样品储备液的质量浓度/(mg/mL);V为样品液体积/mL;m为树脂的质量/mg。
1.3.6 D101大孔树脂纯化八角茴香叶黄酮
称取80 g经预处理的D101大孔树脂,采用湿法装柱。将质量浓度1.0 mg/mL、pH 4样品液,以2BV/h的流速进行动态吸附,每隔8 min测量一次在268 nm波长处流出液的吸光度,当流出液的吸光度为样品液吸光度的1/10(泄漏点)时,停止上样。用2BV蒸馏水洗净柱内残留样品液,然后用70%乙醇溶液解吸,解吸液体积3BV、流速2BV/h。
1.3.7 制备色谱纯化八角茴香叶黄酮
称取粗黄酮5.0 g,溶解在100 mL甲醇溶液中,转移至500 mL容量瓶中,用水定容,使其质量浓度为10.0 mg/mL。制备色谱条件:柱填料为12 g Reveleris™RP C18cartridge,流动相为5%乙酸溶液(A)和甲醇(B),流速为10 mL/min,进样量为15 mL,检测波长为268 nm(UV1)和328 nm(UV2)。梯度洗脱条件为:0~2 min:0~30% B;2~5 min:30%~50% B;5~13 min:50%~70% B;13~15 min:70%~70% B。
1.3.8 纯化效果的检测
按1.3.6节和1.3.7节方法,将经大孔树脂和制备色谱纯化的八角茴香叶黄酮溶液,用旋转蒸发仪除去醇后,冷冻干燥得纯化后的八角茴香叶黄酮粉末。用30%甲醇溶解并稀释至1 mg/mL,进HPLC仪分析。分析条件:Zorbax SB-C18(250 mm×4.6 mm,5 μm),流动相:甲醇(A)、水(B)、5%乙酸溶液(C),流速0.8mL/min,进样量15μL。梯度洗脱条件为:0~5min,30%~50% A;5~15min,50%~60% A;15~23min,60%~65% A;23~28min,65%~67% A,C溶液一直维持在10%。
1.4 数据处理
用Minitab对Plackett-Burman试验数据进行分析,用Design-Expert对响应面试验数据进行分析。
2 结果与分析
2.1 标准曲线
根据1.3.3节方法,以芦丁质量浓度为横坐标,吸光度A为纵坐标,绘制标准曲线,得回归方程为:A=11.591 85C—0.019 25,C为稀释溶液中芦丁的质量浓度/(mg/mL)。
2.2 Plackett-Burman试验设计及结果
利用Minitab对表3的数据进行分析,模型的主效应是极显著的(P<0.01),证明选取的因素恰当。其中有关微波的3 个因素中,微波温度是影响八角茴香叶黄酮提取的极显著因素(P<0.01),而微波时间和微波起始功率都是不显著影响因素(P>0.05)。这是因为微波辅助提取中,微波作用于分子,使分子热运动加剧,温度升高,破坏细胞壁,使细胞内物质溶出。当微波温度一定时,微波起始功率越大,达到所需要微波温度的时间就越短。同时,当达到了微波温度时,微波合成仪会根据所设定的温度自动调整功率,即会在剩下的微波时间中维持较低的微波功率。因此对于八角茴香叶黄酮的提取试验中,三者的协同效应表现出来的是微波温度极显著,微波起始功率和微波时间都是不显著影响因素。因素乙醇体积分数和液料比都是显著影响因素(P<0.05),乙醇溶液是黄酮的良好提取剂,适宜体积分数的乙醇对于八角茴香叶黄酮会有更好的溶解性。因此在下一步的响应面分析中,考察乙醇体积分数、液料比、微波温度这3个主要影响因素。

表 3 Plackett-Burman试验设计及相应值Table 3 Plackett-Burman design and results
2.3 响应面试验结果
表 4 响应面试验方案及结果Table 4 Response surface design and results
用Design-Expert软件对表4的数据进行分析,整个模型是极显著的(P<0.01),而失拟项不显著(P>0.05),其中R2=0.983 8,这说明方程拟合良好并且无其他显著因素的影响,试验条件是合适的。乙醇体积分数、液料比、微波温度都是极显著影响因素(P<0.01)。二次项中,B2、C2都是极显著影响因素(P<0.01)。三因素的交互作用中,乙醇体积分数和微波温度是显著(P<0.05),液料比和微波温度是极显著(P<0.01)。而乙醇体积分数和液料比的交互作用、乙醇体积分数的平方都不是显著因素(P>0.01)。
在建立的回归模型中,以A268nm为响应值,分别将乙醇体积分数、液料比和微波温度定为0水平,得到其他两个因素的方程,绘制响应值与这两个因素的三维空间曲面图。
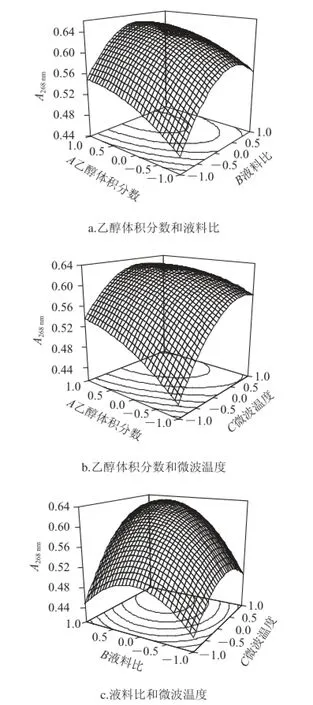
图 1 各因素交互作用对吸光度的影响Fig.1 Effects of interactions of various factors on absorbance
由图1a可见,随着乙醇体积分数的升高,吸光度增大,在乙醇体积分数达到70%附近时,吸光度达到最大值。微波提取的溶剂必须满足两点:一是溶剂的极性不能太低,二是溶剂对提取成份有较强的溶解性,且对后续操作影响较小[19]。微波加热的吸收体需要微波吸能物质,而极性物质是微波的吸能物质。当乙醇体积分数较低时,此时溶液的极性较大,吸能较多,许多杂质如水溶性的糖类都能被溶解,并且为后续分离纯化黄酮带来了不利影响。随着乙醇体积分数的升高,虽然吸能会降低,但是弱极性的黄酮物质在此极性下能被充分溶解,从而使吸光度增大。乙醇体积分数的持续增大,对微波能的吸收也将持续减弱,此时由于能量的减少,分子振动减弱,脂溶性的物质如叶绿素溶出[20],高体积分数的乙醇溶液会使细胞内的蛋白质凝固[21],多方面的因素都会影响黄酮的溶出。因此找到一个合适的乙醇体积分数是需要兼顾极性和吸能两方面因素。
随着液料比的增加,吸光度也随之增大,液料比是提取过程中的的重要因素,主要影响着固相和液相之间的浓度差,即传质推动力[22]。液料比的提高会在很大程度上提高传质推动力,当比例在27∶1附近时,吸光度已达到最大,说明此时溶剂的量已经能充分溶解八角茴香叶中的黄酮,更多的溶液不仅会使溶液溅失,造成溶剂的浪费,也影响了对微波能的吸收[23],还会对提取罐造成更大的压力。因此找到一个合适的液料比是需要考虑溶解黄酮的总量和一定的经济因素。
由图1b可见,随着微波温度的升高,吸光度明显增大,并且在75 ℃附近达到最大值。温度的升高,意味着加热和维持微波温度时所需要的功率变大,这能促进黄酮的溶出。同时高的温度会使溶剂的表面张力和黏性降低,从而使溶剂的渗透力以及对黄酮的溶解能力的增加。但是温度的持续升高,不仅会造成一些非黄酮类物质溶解性增大,还会使部分黄酮分子在高温条件下被破坏,使吸光度降低。同时乙醇体积分数和微波温度的协同作用中,乙醇体积分数越大,沸点越接近乙醇的沸点(78.4 ℃),因此当温度达到79 ℃附近时,能观察到回流管中有大量的液体,即溶剂已达到沸点开始剧烈的沸腾,这时提取罐内实际与八角茴香叶接触的溶剂变少,影响到了黄酮的浸出。
由图1c可见,吸光度随着微波温度的升高而升高,在高温时随着液料比的增大而增大。液料比和微波温度的协同作用体现在微波温度较高时,较高的温度使溶剂的黏性降低,更多的溶剂能渗透进植物,此时较大的液料比就能更充分的溶解黄酮,使吸光度增大。
对表4数据进行二次多元回归拟合,得到吸光度A268nm对三因素的二次多项式回归方程:A268nm=0.61+ 0.032A+0.036B+0.053C—0.009125AB—0.02AC+0.031BC—0.019A2—0.063B2—0.051C2。通过回归模型预测的八角茴香叶总黄酮最佳提取条件为:乙醇体积分数66.46%、液料比25.77∶1、微波温度75.35 ℃、微波起始功率500 W、微波时间8 min(0~1.5 min,功率为500 W,1.5~8 min,功率自动调整到100W),此条件下A268nm的预测值为0.633。考虑可操作性,最佳工艺修正为:乙醇体积分数67%、液料比26∶1、微波温度75℃。在此条件下做验证实验,经过3 次平行实验,实测A268nm为0.654,相对误差为3.32%,根据2.1节中的回归方程计算稀释溶液中黄酮的质量浓度ρ,根据公式(1)计算黄酮得率为6.97%。证明响应面法得到八角茴香叶黄酮的提取条件和模型是真实可靠的。
2.4 4种树脂的静态吸附与解吸
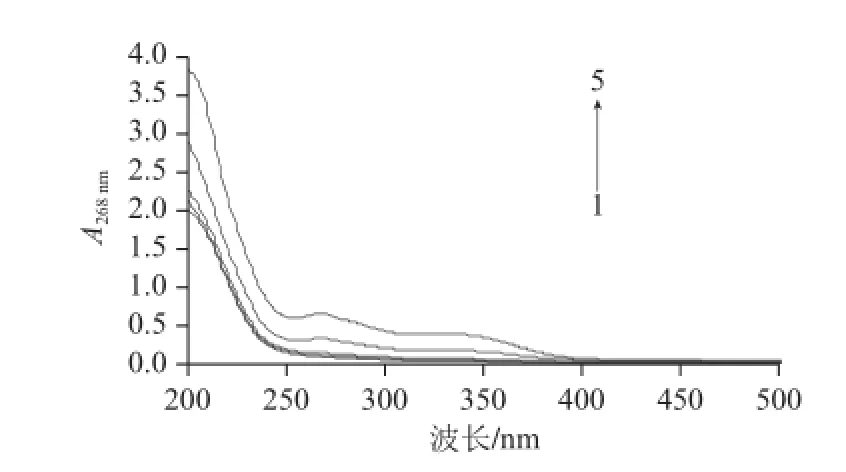
图 2 4种大孔树脂吸附样品液后上清液的吸收曲线Fig.2 Adsorption curves of fl avonoids onto 4 kinds of macroporous resins
如图2所示,吸收曲线1~5分别代表D101、AB-8、NKA-9、聚酰胺大孔树脂吸附样品液和0.1 mg/mL样品溶液。D101、AB-8、NKA-9大孔树脂对于八角叶黄酮溶液的吸附率都达到了80%,说明这3 种树脂对其有较好的吸附作用,而聚酰胺的吸附率只有50.01%。
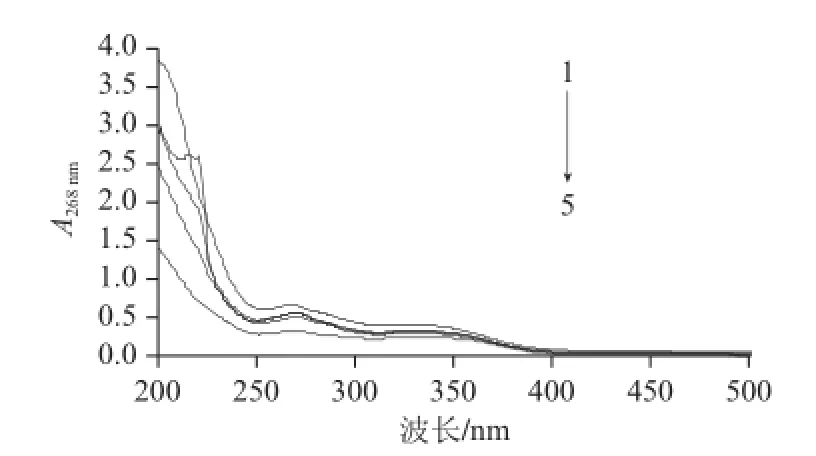
图 3 4种大孔树脂乙醇洗脱液的吸收曲线Fig.3 Desorption curves of fl avonoids from 4 kinds of macroporous resins with aqueous ethanol
如图3所示,吸收曲线1~5分别代表0.1 mg/mL样品溶液和D101、AB-8、NKA-9、聚酰胺树脂乙醇洗脱液,大孔树脂对于吸附上的八角叶黄酮都有很好的解吸率,解吸率都在95%以上,说明这4种树脂吸附黄酮后,都能很好的被解吸。
按公式(2)、(3)计算4 种大孔树脂的吸附率和解吸率,结果见表5。

表 5 4种大孔树脂的吸附率和解吸率Table 5 Adsorption and desorption rates of fl avonoids by 4 kinds of macroporous resins
黄酮类化合物有较多的酚羟基和糖苷链,有一定的极性和亲水性,生成氢键的能力较强,有利于吸附到极性以及弱极性的大孔树脂表面及孔内[24]。同时大孔树脂的吸附能力还和比表面积有关,在孔径相差不大的情况下,比表面积越大,吸附能力越强。因此,综合吸附率和解吸率等条件,选用D101吸附树脂纯化八角茴香叶黄酮。
2.5 D101吸附树脂静态吸附动力学曲线
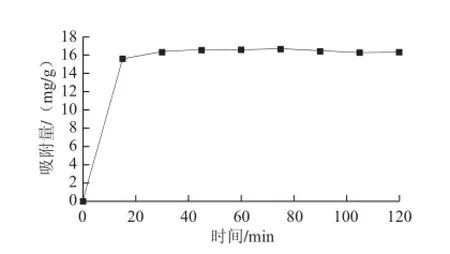
图 4 D101大孔树脂静态吸附动力学曲线Fig.4 Kinetic curve for static adsorption of D101 macroporous resin
由图4可知,D101是快速吸附型树脂,0~15 min内,黄酮的吸附量随时间延长快速增长。15~45 min内逐渐达到最大值,45~120 min内是树脂与溶液的平衡阶段。根据公式(4)计算可得D101对八角茴香叶黄酮的最大吸附量为16.67 mg/g。
2.6 大孔树脂和制备色谱纯化效果分析
根据1.3.7节方法,得到经制备色谱纯化后的八角茴香叶黄酮,得到的色谱图见图5,图中AB线代表B溶剂在流动相中的比例。
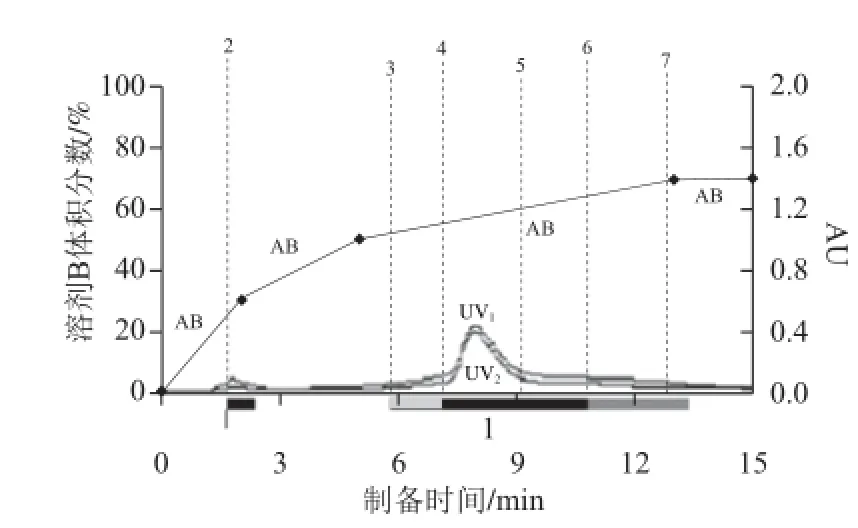
图 5 制备色谱纯化八角茴香叶黄酮(UV1=268 nm,UV2=328 nm)Fig.5 Purifi cation of fl avonoids from Illicium verum leaves by preparative chromatography (UV1= 268 nm, UV2= 328 nm)
由图5可以看出,两个检测波长条件下峰形是重合的,制备色谱将八角茴香叶黄酮分为4个组分:1.6~1.8 min为组分1,5.8~7.1 min为组分2,7.1~10.7 min为组分3,10.7~13.3 min为组分4。
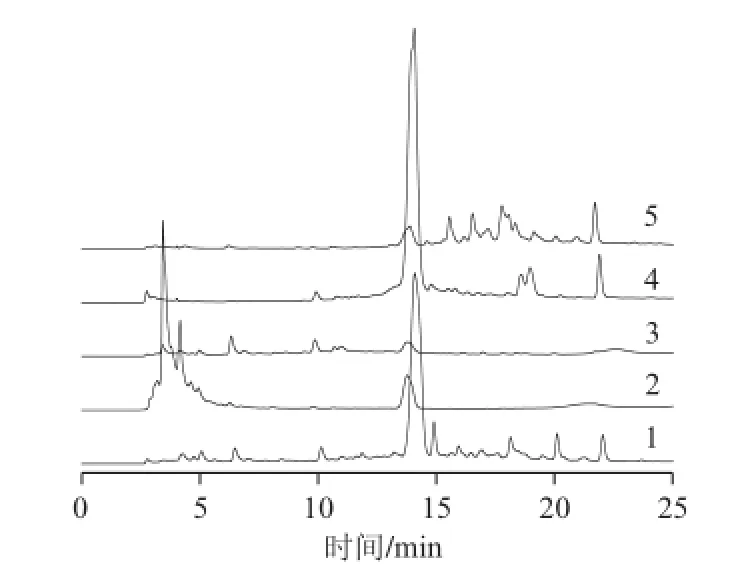
图 6 D101大孔树脂和制备色谱纯化八角茴香叶黄酮的HPLLCC图Fig.6 HPLC profi les of fl avonoids from Illicium verum leaves purifi ed by D101 resin and preparative chromatography
图6 色谱图1为经D101大孔树脂纯化后的1.0 mg/mL八角茴香叶总黄酮,图中色谱图2~5分别为组分1、2、3和4。经大孔树脂纯化得到的八角茴香叶黄酮的色谱图1与制备色谱分别得到的4 个组分的色谱图2~5能一一对应。色谱图2对应色谱图1的2.5~5 min和14 min的峰形,色谱图3对应色谱图1的前12 min的峰形,色谱图4对应色谱图1的14、18 min和22 min的峰形,色谱图5对应色谱图1的后14~23 min的峰形,并且在质量浓度都为1.0 mg/mL的情况下,组分1~4的响应值都比色谱图1高出许多,约为1.6倍。这说明制备色谱纯化八角茴香叶黄酮不仅不会丢失成份,而且还能对总黄酮进行粗分并且每一组分的纯度都得到了提高。D101大孔树脂纯化250 mg八角茴香叶黄酮,需要4 h,平均1 h只能纯化62.5 mg,从装柱到上样、洗脱、重新装柱等都必须人工操作和检测。制备色谱一次能上样150 mg,制备所需时间仅为15 min,加上清洗、接样共计25 min,平均1 h能纯化360 mg。由此,制备色谱比大孔树脂具有高效快速的优势[25]。
3 结 论
通过Plackett-Burman设计筛选关键因素,通过响应面分析法确定最优组合,得到了八角茴香叶黄酮提取的最佳条件。同时使用D101大孔树脂和制备色谱纯化了八角茴香叶黄酮,对比两种纯化方式,制备色谱不仅能够高效快速的纯化八角茴香叶黄酮,并且能对黄酮进行粗分得到4种组分,为其进一步的成分分析及生物活性的研究奠定了基础,为八角茴香叶黄酮的开发与应用提供了理论依据。
[1] 王琴, 蒋林, 温其标. 八角茴香的研究进展[J]. 中国调味品, 2005, 30(5): 18-22.
[2] 国家药典委员会. 中国药典[M]. 北京: 中国医药科技出版社, 2010: 4.
[3] 黄建梅, 杨春澍. 八角科植物化学成分和药理研究概况[J]. 中国药学杂志, 1998, 33(6): 3-9.
[4] 赵俊丽, 骆志成, 武三卯, 等. 八角茴香挥发油抗念珠菌活性的体外研究[J]. 中华皮肤科杂志, 2004, 37(8): 37-39.
[5] 曹雁平. 食品调味技术[M]. 北京: 中国轻工业出版社, 2002: 113.
[6] DE M, DE A K, SEN P, et al. Antimicrobial properties of star anise (Illicium verum Hook. f.)[J]. Hytotherapy Research, 2002, 16(1): 94-95.
[7] LEE S O, PARK I K, CHOI G J, et al. Fumigant activity of essential oils and components of Illicium verum and Schizonepeta tenuifolia against Botrytis cinerea and Colletotrichum gloeosporioides[J]. Journal of Microbiology and Biotechnology, 2007, 17(9): 1568-1572.
[8] AVULA B, WANG Y H, SMILLIE T J, et al. Determination of shikimic acid in fruits of Illicium species and v arious other plant samples by LC-UV and LC-ESI-MS[J]. Chromatographia, 2009, 69(3/4): 307-314.
[9] LIU Hongcheng, LI Qiwan, ZHANG Yin, et al. Analysis of (-)-shikimic acid in Chinese star anise by GC-MS with selected ion monitoring[J]. Chromatographia, 2009, 69(3/4): 339-344.
[10] CHANG J Y, ABD EI-RAZEK M H, CHEN Y H, et al. Phytoquinoids and secoprezizaane-type sesquiterpenes from Illicium arborescens[J]. Helvetica Chimica Acta, 2010, 93(1): 123-132.
[11] YOKOYAMA R, HUANG J M, YANG C S, et al. New secoprezizaane-type sesquiterpenes, jiadifenin with neurotrophic activity and 1,2-dehydroneomajucin from Illicium jiadifengpi[J]. The Journal of Natural Products, 2002, 65(4): 527-531.
[12] 陈培栋, 梁守珍. 八角栽培与茴油生产[M]. 北京: 中国林业出版社, 1985: 12-15.
[13] 杜正彩, 李学坚, 黄月细, 等. 八角枝叶提油废水中莽草酸的提取工艺优选[J]. 中国实验方剂学杂志, 2013, 19(9): 18-20.
[14] 莫丽玲, 肖词英, 黄锁义, 等. 八角叶总黄酮的提取及其捕获自由基作用研究[J]. 中国野生植物资源, 2011(1): 50-53.
[15] 鲍泥满, 董旭俊, 周乐. 八角枝叶的化学成分研究[J]. 西北农林科技大学学报: 自然科学版, 2012(9): 231-234.
[16] 易国富, 龙永勋, 陈全斌. 八角叶黄酮苷元及其含量的测定[J]. 轻工科技, 2013(7): 19-20.
[17] 郭景强. 微波辅助提取技术及其在中药提取中的应用[J]. 天津药学, 2010, 22(4): 63-64.
[18] 杨立琛, 李荣, 姜子涛. 大孔吸附树脂纯化花椒叶总黄酮的研究[J].中国调味品, 2012, 37(7): 30-35.
[19] 胡秀丽. 中药活性成分提取和分离的研究[D]. 长春: 吉林大学, 2008: 23-25.
[20] 胡静丽, 陈健初. 杨梅叶黄酮类化合物最佳提取工艺研究[J]. 食品科学, 2003, 24(1): 96-99.
[21] 陈伟, 刘青梅, 杨性民, 等. 微波技术在杜仲黄酮提取工艺中的应用研究[J]. 食品科学, 2006, 27(10): 285-288.
[22] 张宏康. 微波萃取技术在食品工业中的应用[J]. 粮油食品科技, 1999, 7(5): 30-32.
[23] 杨立琛, 李荣, 姜子涛. 花椒黄酮的微波提取及抗氧化活性研究[J].食品科技, 2012, 37(11): 214-218.
[24] 康家胜, 方菊, 魏凤玉, 等. 大孔树脂对竹叶总黄酮的吸附平衡和动力学[J]. 化工进展, 2010, 30(10): 2158-2162.
[25] 刘望才, 杨京芬, 朱家文, 等. 液相制备色谱的研究进展[J]. 中国医药工业杂志, 2006, 37(4): 271-274.
Microwave Extraction and Purifi cation of Flavonoids from Illicium verum Leaves
LIU Tao, LI Rong*, ZHANG Lujie, JIANG Zitao
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
The conditions for microwave-assisted extraction of fl avonoids from Illicium verum l eaves were optimized by the combined use of Plackett-Burman design and response surface methodology (RSM) as follows: ethanol concentration, 67%; ratio of solvent to solid, 26:1; extraction temperature, 75 ℃; initial microwave power, 500 W; and extraction time, 8 min. The yield of total fl avonoids was 6.97% under these conditions. The fl avonoids from I. verum leaves were purifi ed by D101 macroporous resin in comparison with preparative chromatography. The results indicated that preparative chromatography is not only an efficient and rapid method for the purification of flavonoids extract, but also can preliminarily separate fl avonoids.
Illicium verum leaves; response surface; macroporous resins; preparative chromatography
TS202.3
A
1002-6630(2015)02-0030-06
10.7506/spkx1002-6630-201502006
2014-05-22
天津市自然科学基金重点资助项目(12JCZDJC34100)
刘韬(198 9—),男,硕士研究生,研究方向为食品添加剂。E-mail:411698992@qq.com
*通信作者:李荣(1962—),女,教授,学士,研究方向为食品及添加剂分析。E-mail:lirong@tjcu.edu.cn
