肾阳虚、肾阴虚证大鼠模型的建立与稳定性观察
2015-12-08张子怡陈宝军张英杰王雯婷王艺茹苏友新
张子怡,陈宝军,张英杰,王雯婷,王艺茹,苏友新
(福建中医药大学,福建 福州 350122)
中医证候动物模型的建立与研究是连接中医基础和临床的枢纽,是深化对证候实质认识的重要方法之一,同时也是筛选有效中药、药物作用机制深入研究的关键手段之一。所以,寻找既符合中医学理论,又真实反映临床证候特征,且具有较好稳定性和重复性的动物模型以满足中医药研究的需求,是中医证候动物模型研究的重要任务[1]。大量外源性肾上腺皮质激素的补充可抑制体内促肾上腺皮质激素的释放,进而反馈使得内源性类固醇激素分泌减少,当停止外源肾上腺皮质激素补充时,会出现一系列与临床肾阳虚证候患者类似的症状、体征;而利用甲状腺素可提高动物的基础代谢率,引起全身性因代谢影响而出现与肾阴虚证候相似的表现。本实验在前人研究的基础上,选择较为经典且应用最多的肌注氢化可的松及灌胃甲状腺片的方法分别复制肾阳虚、肾阴虚证候大鼠模型,并在造模结束后继续观察3周,以获得既符合肾阳虚、肾阴虚证候特征,又具有较稳定表现的、简便可行的动物模型,为中医肾阳虚、肾阴虚证本质的研究提供可靠、稳定的证候动物模型。现将结果报告如下。
1 材料与方法
1.1 动物及分组 健康3月龄SPF级WISTAR大鼠 90 只,均为雄性,体质量(210±20)g,由上海斯莱克实验动物有限公司提供,动物许可证号:SCXK(沪)2012-0002,质量合格证编号:2007000548015。采用随机数字表法将大鼠分为3组,即正常组、肾阳虚组及肾阴虚组各30只。
1.2 试剂及药物 大鼠环磷酸腺苷(cAMP)及大鼠环磷酸鸟苷(cGMP)ELISA试剂盒(上海Westang Bio-tech有限公司);甲状腺片(山东省莱阳生物化学制药厂,国药准字:H37020075,产品批号:110805);氢化可的松注射液 (福州海王福药制药有限公司,国药准字:H35020193,产品批号:1209111)。
1.3 主要仪器 电子体温计(FT-A21CN型,深圳市贝利斯科技发展有限公司);酶联免疫检测仪(ELX808型,美国BIO-TEK);电子天平(YP202N型,上海精密科学仪器有限公司);离心机(64R型,美国BECKMAN公司)。
1.4 实验方法
1.4.1 甲状腺片混悬液的制备 将甲状腺片置研磨器中研磨成粉末,然后用无菌生理盐水溶解混匀,制成40 mg/mL的甲状腺片混悬液,4℃冰箱保存,使用前摇匀。
1.4.2 模型造模方法
1.4.2.1 肾阳虚证大鼠模型 臀部肌肉注射氢化可的松注射液(2.5 mg/100 g),每日 1 次,自由饮水、饮食,连续 15 d[2]。
1.4.2.2 肾阴虚证大鼠模型 灌胃甲状腺片混悬液(45 mg/100 g),每日 1 次,自由饮水、饮食,连续15 d[3]。
1.4.3 模型鉴定方法
1.4.3.1 大鼠血清cAMP、cGMP含量的检测 ①造模结束时首次检测:取正常组、肾阳虚组、肾阴虚组大鼠,吸入乙醚麻醉后,用左手拇指及食指轻轻压迫动物的颈部两侧,使眶后静脉丛充血、眼球充分外突,右手持毛细玻璃采血管进行眼眶后静脉丛采血 1~1.5 mL。 4℃冰箱放置 4 h后,2000 r/min离心10 min取上清,使用cAMP和cGMP ELISA试剂盒检测大鼠血清中cAMP、cGMP含量,具体步骤参考cAMP和cGMP ELISA试剂盒操作说明书。②造模结束后3周再次检测:取正常组、肾阳虚组、肾阴虚组大鼠,用10%水合氯醛以300 mg/kg的剂量腹腔注射麻醉大鼠,常规备皮,取腹部正中入路打开腹腔,抽取腹主动脉血液。血液标本处理及检测方法同“造模结束时首次检测”。
1.4.3.2 大鼠体重及体温的检测 于造模首日、造模结束时及造模结束3周后的上午9点,分别测定3组大鼠的体重、体温。① 体重检测:将大鼠逐一放在电子天平上测量体重并记录。② 体温检测:待大鼠排便完全后,左手固定大鼠,右手将电子体温计蘸上甘油后缓慢插入肛门,至电子体温计发出体温稳定提示音即可,读取体温并记录。
1.4.3.3 肾阳虚证大鼠模型 ① 一般状态[2,4]:与正常组大鼠比较,模型大鼠出现体重增长缓慢且低于肾阴虚组大鼠,体温下降,活动减少,反应迟钝,蜷缩弓背,畏寒怕冷,体毛枯疏并失去光泽等阳虚的表现。②环核苷酸系统的变化:与正常组大鼠比较,模型大鼠血清cGMP含量上升,cAMP含量下降,cAMP /cGMP 比值降低[4]。
1.4.3.4 肾阴虚证大鼠模型 ① 一般状态[5]:与正常组大鼠比较,模型大鼠出现躁动、易惊、怕人等表现,体重增长较正常组大鼠缓慢。② 环核苷酸系统的变化:与正常组大鼠比较,模型大鼠血清cAMP含量上升,cAMP /cGMP 比值升高[4]。
1.4.4 大鼠模型稳定性观察 造模结束后,正常饲养大鼠,继续观察3周,通过肉眼观察大鼠活动、反应及弓背情况,毛发、爪甲颜色变化等方面,并测量大鼠体重与体温(肛温),比较造模结束时和造模结束后3周所检测大鼠血清cAMP、cGMP的含量,判断肾阳虚、肾阴虚模型大鼠表现的稳定性。
1.4.5 统计学处理 采用SPSS 17.0软件进行统计学分析,所得数据用(±s)表示。组内比较采用配对t检验和秩和检验,组间比较采用单因素方差分析和LSD检验。P<0.05有显著性差异。
2 结 果
2.1 大鼠一般状态的观察与比较 造模后,与正常组大鼠比较,肾阳虚组大鼠出现爪甲与耳朵颜色变淡;肾阴虚组大鼠爪甲与耳朵颜色无明显变化,见图1。造模后,与正常组大鼠比较,肾阳虚组大鼠出现活动减少、反应迟钝、弓背蜷缩、喜扎堆等畏寒怕冷表现;肾阴虚组大鼠出现躁动、易惊、怕人等表现,见图2。

图1 3组大鼠爪甲与耳朵颜色变化情况比较
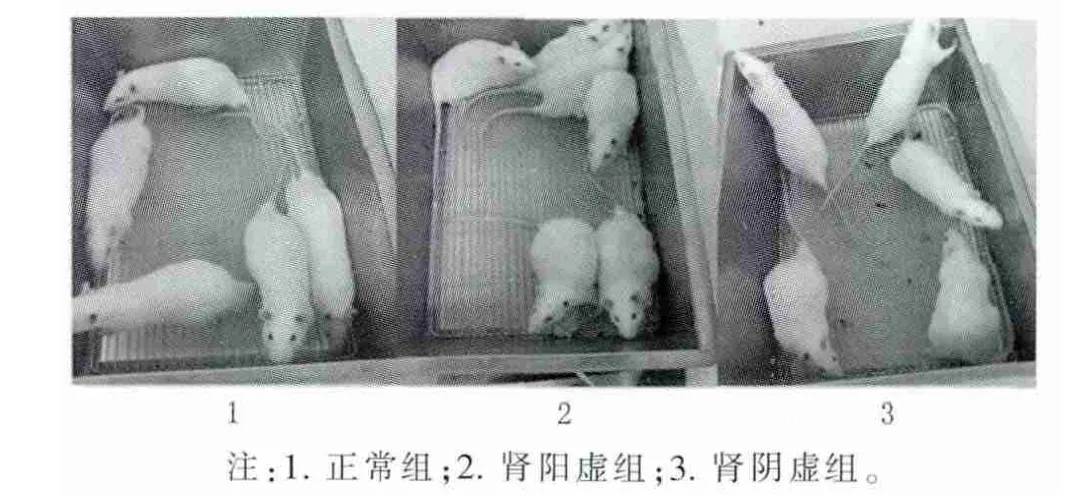
图2 3组大鼠活动及弓背等情况比较
2.2 3组大鼠体重比较 见表1。
表1 3组大鼠体重比较(±s)g

表1 3组大鼠体重比较(±s)g
注:与造模前比较,1) P<0.01;与造模结束时比较,2) P<0.01;与正常组比较,3) P<0.01;与肾阴虚组比较,4) P<0.05,5)P<0.01。
组别正常组肾阳虚组肾阴虚组n 302730造模前254.10±14.69253.93±15.50250.57±15.88造模结束时305.67±18.351)267.48±15.531)3)4)277.03±13.501)3)造模结束后3周371.90±18.561)2)290.63±14.591)2)3)5)312.26±20.751)2)3)
2.3 3组大鼠体温比较 见表2。
表2 3组大鼠体温(肛温)比较(±s) ℃

表2 3组大鼠体温(肛温)比较(±s) ℃
注:与正常组比较,1) P<0.01,2) P<0.05;与肾阴虚组比较,3) P<0.01;与造模前比较,4) P<0.01。
组别正常组肾阳虚组肾阴虚组n 302730造模前38.12±0.3038.11±0.3938.12±0.24造模结束时38.13±0.3337.17±0.371)3)4)38.33±0.252)4)造模结束后3周38.13±0.3437.33±0.311)3)4)38.34±0.232)4)
2.43组大鼠血清cAMP、cGMP含量比较 见表3。
3 讨 论
动物实验研究是当代医药学研究的重要方式。无论是基础研究还是应用研究,动物模型已经成为研究的一种重要工具[6]。借助于肾阳虚、肾阴虚证动物模型探讨肾虚证实质是一种可行的研究思路,是中医证候实质研究的重要手段之一。肾阳虚造模方法多样[7-9],主要包括有如氢化可的松、腺嘌呤、羟基脲及抗甲状腺等药物造模,切除睾丸、肾上腺及甲状腺等手术造模和根据中医病因“恐伤肾”、房劳伤肾等三大类造模方法。其中以氢化可的松造模法最为常见,模型在病理方面与肾阳虚证实质基本一致,其症状、体征也较符合肾阳虚证的临床表现。相较于手术模型,此法对于动物创伤小,不会造成不可逆性伤害,方便后续研究;与根据中医病因制作的模型比较,氢化可的松造模操作简便,可控性高,可重复性好。所以我们选取注射氢化可的松制作肾阳虚动物模型。肾阴虚造模方法包括有灌服甲状腺素,注射过量的促肾上腺皮质激素,采用手术结扎一侧实验动物肾动脉,服用大剂量热性中药如附子、肉桂等[10-11]。基于临床上甲状腺功能亢进患者日久多数出现肾阴虚证候,故灌服甲状腺素可通过升高外源性甲状腺素水平从而复制肾阴虚动物模型,且此造模方法已被广泛采用。注射过量促肾上腺皮质激素虽可使动物出现一系列阴虚症状,但突然停用又可出现阳虚表现;手术结扎肾动脉法则对动物会造成一定创伤,模型与预模拟的临床病理表现有一定差距;而服用热性中药造模法在实验研究中较少应用。因此我们选择灌服甲状腺素方法复制肾阴虚证动物模型[12]。
表3 3组大鼠 cAMP、cGMP 含量比较(±s)

表3 3组大鼠 cAMP、cGMP 含量比较(±s)
注:与正常组比较,1) P<0.01。
组别正常组肾阳虚组肾阴虚组n 302730 cAMP/(pmol/mL)36.14±5.0923.17±4.801)75.50±6.521)造模结束时cGMP/(pmol/mL)8.80±3.4626.56±3.171)8.86±3.25 cAMP/cGMP 4.69±1.700.88±0.201)9.69±3.431)造模结束后3周cAMP /(pmol/mL)36.95±3.8123.64±2.951)74.46±4.421)cGMP/(pmol/mL)8.06±0.9626.16±2.741)8.00±1.16 cAMP/cGMP 4.66±0.780.92±0.171)9.51±1.561)
目前关于肾阳虚、肾阴虚证动物模型的鉴定方法众多,还没有统一的标准。根据临床肾虚证患者的表现,研究中动物模型的症状与体征,如体温、体重、毛色、弓背、活动情况、采食量及饮水量等,常被作为肾阳虚、肾阴虚的判断指标之一[13],因为肾阳为人体阳气之根本,又被称为命门之火,是人体生命活动的原动力,具有蒸腾、推动、温煦及固摄等生理功能,能够促进机体新陈代谢,增强脏腑组织器官的功能活动,制约体内阴寒之气等,故当机体肾阳虚弱时往往表现出新陈代谢缓慢、组织器官功能减弱以及体内寒凉之象;肾阴为全身阴液之根本,具有滋润及制约阳热等生理功能,故当肾阴亏虚时往往表现出一派阴虚火旺之象。另外,有关指标的检测也是作为鉴定肾虚证模型的条件,其中cAMP、cGMP含量的检测及cAMP/cGMP比值的计算是目前最常用的肾阳虚、肾阴虚证动物模型可量化鉴定方法之一。王培源等[14]经过多年研究,结果显示测定血浆cAMP、cGMP含量及其比值,可以作为帮助判断肾阴虚、肾阳虚的一个客观指标。美国生物学家Goldberg在上世纪70年代初曾提出细胞功能调节的“阴阳学说”,认为cAMP与cGMP拮抗性作用与中医的“阴阳”相类似。因此,本实验采用观察模型动物的相关状态及检测cAMP、cGMP含量和计算cAMP/cGMP比值作为肾阳虚、肾阴虚证动物模型的鉴定方法是可行的。
本实验观察到肾阳虚组大鼠造模后出现活动减少,反应迟钝,体毛枯疏并失去光泽,爪甲与耳朵颜色变淡,弓背蜷缩,喜扎堆等畏寒怕冷表现,提示大鼠体内新陈代谢减慢、组织器官功能减弱且体内一派寒凉之象,其表现与临床肾阳虚证患者类似;肾阴虚组大鼠出现躁动、易惊、怕人等表现,提示大鼠的状态表现与临床肾阴虚证患者的阴虚火旺之象类似。与正常组大鼠比较,肾阳虚和肾阴虚组大鼠体重均低于正常组(P<0.01),肾阳虚组大鼠体温显著下降(P<0.01),肾阴虚组大鼠体温升高(P<0.05)。通过检测大鼠血清 cAMP、cGMP含量及cAMP/cGMP的比值计算结果显示,肾阳虚组大鼠cAMP含量下降 (P<0.01),cGMP含量显著升高及cAMP/cGMP 比值显著降低(P<0.01);肾阴虚组大鼠血清cAMP含量及cAMP/cGMP比值均显著升高(P<0.01)。上述肾阳虚、肾阴虚组大鼠的状态表现与血清cAMP、cGMP含量检测及cAMP/cGMP比值结果与苟小军等[2]的研究结果是相符的,提示本实验肾阳虚、肾阴虚证模型大鼠造模是成功的。造模结束后3周,发现肾阳虚与肾阴虚组大鼠在活动、反应、毛色及体温、体重等方面仍然具有较稳定的表现,且大鼠血清cAMP、cGMP含量及cAMP/cGMP的比值计算结果仍提示本实验动物模型为肾阳虚与肾阴虚证,说明肾阳虚、肾阴虚大鼠模型在造模后3周其证候表现依然稳定。总之,本实验所建立的肾阳虚证模型与肾阴虚证模型大鼠的症状、体征和血清cAMP、cGMP含量检测及cAMP/cGMP比值结果均符合肾阳虚、肾阴虚证模型的鉴定要求,造模结束后3周所记录下的大鼠的症状、体征和血清cAMP、cGMP含量检测及cAMP/cGMP比值结果均符合肾虚证模型的鉴定指标。
本实验结果表明,注射氢化可的松和灌服甲状腺素分别引起的大鼠相关症状、体征及环核苷酸系统的变化,分别与临床肾阳虚证、肾阴虚证的表现吻合,且造模结束后3周模型依旧保持稳定,提示此法建立的肾阳虚、肾阴虚证模型是确实可靠且相对稳定的,说明该方法是构建肾阳虚、肾阴虚证动物模型的理想方法。
[1]林志健,张冰,刘小青,等.中医证候动物模型评价研究[J].中华中医药杂志,2013,28(8):2217-2219.
[2]苟小军,韩宝侠,王朝廷,等.肾阳虚证造模方法考察[J].吉林中医药,2009,29(9):814-815.
[3]梁汝圣,徐宗佩.大鼠肾阴阳虚模型建立方法[J].吉林中医药,2008,28(9):685-687.
[4]杜江,李楠,王和鸣.肾虚模型造模方法及相关指标[J].中国组织工程研究与临床康复,2010,14(50):9433-9436.
[5]王培源,刘蓬,黄燕晓.肾阴虚豚鼠模型的建立及对内耳形态学影响的实验研究[J]. 辽宁中医药大学学报,2006,8(4):135-137.
[6]吕爱平.病证结合动物模型研究:从理论创新到技术挑战[J].中国中西医结合杂志,2013,33(1):6-7.
[7]周文江,姚菊芳,彭秀华,等.肾阳虚证大鼠模型的建立[J].实验动物与比较医学,2007,27(4):242-243.
[8]卢德赵,沃兴德,沃立科,等.甲状腺切除的肾阳虚大鼠肝线粒体蛋白质组的研究[J].中医药学报,2008,36(4):11-15.
[9]张丹,李哲,朱庆均,等.“劳倦过度、房室不节”肾阳虚小鼠模型的建立及评价[J].实验动物科学,2008,25(4):9-11.
[10]王萍,王喜军.肾阴虚证动物模型研究概况[J].中医药信息,2013,30(4):123-125.
[11]王丹,田付华.肾阴虚证研究概况[J].辽宁中医药大学学报,2008,10(4):33-35.
[12]付晓伶,方肇勤.阴虚证动物模型的造模方法及评析[J].上海中医药大学学报,2004,18(2):51-54.
[13]陈奇.中药药理研究方法学[M].2版.北京:人民卫生出版社,2006:1035-1037.
[14]王培源,刘蓬,黄燕晓.肾阴虚豚鼠模型的建立及对内耳形态学影响的实验研究[J]. 辽宁中医药大学学报,2006,8(4):135-137.
