内质网应激在高糖所致血管平滑肌细胞钙化中的作用与机制
2015-12-06李兴岳吴子君姜佳美郭润民
刘 畅,吴 斌,李兴岳,吴子君,姜佳美,游 琼,吴 铿,郭润民
广东医学院附属医院 心血管内科(湛江 524001)
糖尿病是全球常见的内分泌代谢障碍疾病,严重危害人类健康;心脑血管疾病是糖尿病患者最常见死因[1],糖尿病血管钙化是心脑血管疾病高发病率和病死率的独立危险因素[2],也是糖尿病常见的独立并发症之一。一直以来血管钙化(钙磷沉积)被认为是被动的退行性病理变化,经过多年来研究发现,血管钙化是伴有胚胎期骨骼发育特点的严密调控的主动过程,即血管壁细胞(主要是血管平滑肌细胞vascular smooth muscle cells,VSMCs)分化为成骨样细胞[2]。
近期研究[3-4]发现,糖尿病(体外高糖)状态下能引起血管钙化(VSMCs钙化),同时导致内质网(endoplasmic reticulum,ER)应激,并且高糖引起VSMCs钙化可能是类似于骨发育、血管壁细胞和细胞外基质共同作用的主动性病理过程[5-6]。但是,ER应激以及凋亡在高糖诱发VSMCs钙化中的作用机制尚不清楚。为此,本研究拟采用高糖处理大鼠VSMCs模拟机体糖尿病环境,探索ER应激在高糖所致VSMCs钙化中的作用与机制。
1 材料和方法
1.1 材料
D-葡萄糖、4-苯基丁酸(4-phenylbutyric acid,4-PBA)、Hoechst 33258购自美国 Sigma-Aldrich公司。碱性磷酸酶测定试剂盒购自南京建成科技公司,DMEM培养基、胎牛血清购自美国Gibco公司。抗GRP78、抗CHOP、抗Caspase-12、抗Runx2和抗GAPDH等抗体购自美国Cell Signaling Technology Inc。
1.2 方法
1.2.1 细胞培养与实验分组 大鼠VSMCs由中山大学实验动物中心提供,10%胎牛血清的DMEM培养基置于5%CO2、37℃的温箱中培养。实验分为6组:对照组、高糖组、β-甘油磷酸组、β-甘油磷酸+高糖组、4-PBA 预处理+高糖组(用500μmol/L 4-PBA作用VSMCs30min,撤去,用PBS洗两次,接着35mmol/L D-葡萄糖作用24h)和4-PBA 组(500μmol/L 4-PBA作用 VSMCs 30min)。
1.2.2 钙含量测定 上述各组VSMCs经不同处理后,PBS冲洗3次,每孔加入0.6mol/L 盐酸37℃脱钙1h,采用甲基百里香酚蓝比色法钙离子定量检测试剂盒测定上清液中钙含量,剩余细胞用PBS冲洗3次,加入细胞裂解液溶解30min后,使细胞充分裂解提取胞质蛋白,以上清液钙含量除以细胞蛋白含量即为钙含量。
1.2.3 碱性磷酸酶活性测定 将上述各组VSMCs经不同处理后接种于12孔培养板中,弃培养液,PBS冲洗细胞两次,加1mL 1%Triton X生理盐水,4℃放置24h。超声波处理20s,使细胞充分裂解,在倒置显微镜下观察到细胞破碎;以离心半径10cm,12 000r/m离心10min,碱性磷酸酶检测试剂盒(磷酸苯二钠法)测定上清液碱性磷酸酶活性,以上清液碱性磷酸酶的IU/g细胞蛋白表示碱性磷酸酶活性。
1.2.4 免疫印迹法测定蛋白表达 将VSMCs接种于60mm培养皿中,各组生长到80%时予不同处理后,使用冷PBS洗3次,加入裂解液后4℃静置0.5h,以离心半 径 10cm,12 000r/m 离 心10min,取上清液低温冰箱保存备用;用BCA法进行蛋白定量后,总蛋白经SDS-PAGE电泳,转印至PVDF膜上。5%脱脂奶粉封闭60min,然后加入适当比例一抗,4℃摇床过夜,TBST洗3次,5min/次。将PVDF膜用ECL发光液显色,暗室曝光到X线片上,扫描后Imag J灰度分析结果,重复5次。
1.3 统计学方法
采用SPSS 16.0软件进行统计分析,定量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,用SNK检验进行均数间的两两比较,检验水准α设定为0.05。
2 结果
2.1 高糖环境下VSMCs被诱导转分化为成骨样细胞
高糖处理VSMCs 3d或7d后,与对照组比较,β-甘油磷酸组、高糖组和高糖+β-甘油磷酸组碱性磷酸酶活性、钙含量以及骨分化标志蛋白Runx2表达均上调(图1),上述结果提示高糖能诱导VSMCs从收缩表型转分化为成骨样表型。
2.2 4-PBA能阻断高糖引起的VSMCs的ER应激和凋亡
与高糖+4-PBA组比较,4-PBA组ER应激标志蛋白GRP78和CHOP表达下降,同时ER途径凋亡标志蛋白Caspase-12表达均下降(图2),差异有统计学意义(P<0.05)。上述结果提示,高糖能引起VSMCs的ER应激和凋亡,ER应激和凋亡可能会介导VSMCs表型转化。
2.3 ER应激在高糖引起的VSMCs钙化中有重要作用
与高糖+4-PBA组比较,4-PBA组碱性磷酸酶活性下降、钙含量表达降低(图3),差异有统计学意义(P<0.05)。
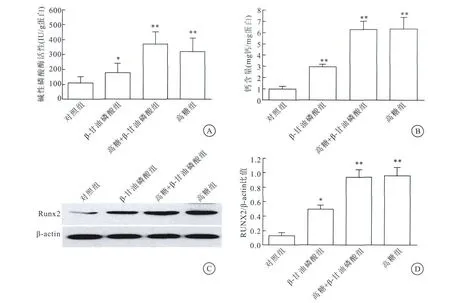
图1 高糖诱导VSMCs转分化为成骨样细胞
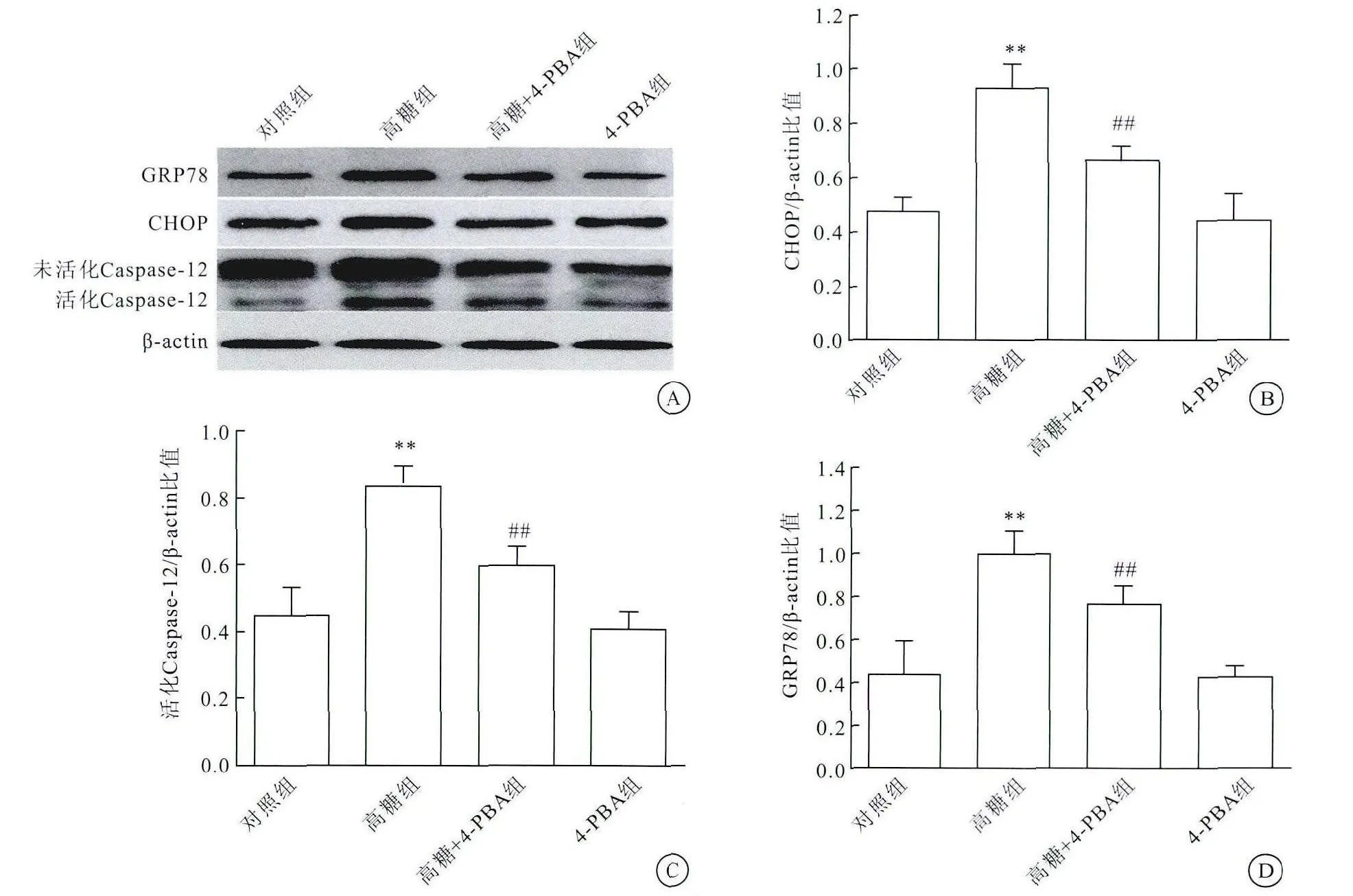
图2 4-PBA能阻断高糖引起的VSMCs的ER应激和凋亡
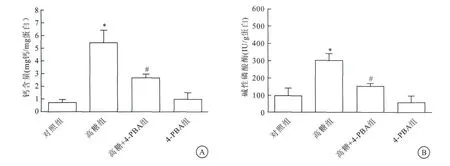
图3 4-PBA能抑制高糖诱导的VSMCs成骨样细胞转分化
3 讨论
糖尿病是对人类危害极大的代谢障碍疾病,糖尿病血管钙化作为糖尿病常见的独立并发症之一,是心血管疾病高发病率和高病死率的独立危险因素[1-2]。血管钙化是 VSMCs类似于骨发育向成骨样细胞转分化的主动过程[4-5]。
研究[7-8]发现,糖尿病(体外高糖)状态下能引起血管钙化(VSMCs钙化)和ER应激。为了探究ER应激以及凋亡在高糖下诱发VSMCs钙化中的作用机制,本研究利用高糖处理大鼠VSMCs模拟机体糖尿病状态,结果显示:高糖处理能诱导VSMCs的ER应激反应和凋亡,4-PBA能阻断VSMCs的钙化(血管钙化的重要过程),以上结果提示ER应激可能在 VSMCs的钙化中有重要作用[9-10],尤其是,4-PBA在抑制ER应激和凋亡的同时,也能阻断VSMCs向成骨样细胞的转分化。
综上所述,高糖处理VSMCs能引起ER应激和凋亡,也可诱导VSMCs转分化为成骨样细胞,引起VSMCs碱性磷酸酶活性增加、钙含量和骨分化标志表达上调;另一方面,4-PBA不仅能抑制高糖诱导的VSMCs的ER应激和凋亡,而且也能阻断VSMCs向成骨样细胞的转分化,也即证实了ER应激在高糖引起的VSMCs钙化中起着重要作用。
[1]陈天雷,毛慧娟,陈铖,等.Klotho蛋白对血管平滑肌细胞钙化的影响[J].中华肾脏病杂志,2015,31(6):434-439.
[2]金波,尹恒冲,汪凌清,等.平滑肌细胞成骨分化致血管钙化中MAPK信号通路基因的表达谱变化[J].中国组织工程研究,2013(20):3618-3625.
[3]宋艳,陆立鹤.程序性细胞死亡与血管钙化关系的研究进展[J].中国分子心脏病学杂志,2013,13(4):639-642.
[4]邵文.血管平滑肌细胞与血管钙化机制的研究进展[J].医学综述,2013,19(16):2898-2901.
[5]白亚玲,徐金升,钱玥彤,等.γ干扰素对高磷诱导大鼠血管平滑肌细胞钙化的影响研究[J].中国心血管杂志,2015(1):62-66.
[6]马琦,边云飞,白瑞,等.吡格列酮通过内质网应激致凋亡途径对大鼠血管平滑肌细胞钙化的影响[J].中国动脉硬化杂志,2014,22(4);351-356.
[7]邱翠婷,吕安林,李寰,等.钙磷诱导大鼠血管平滑肌细胞钙化的机制研究[J].中国循环杂志,2015,30(1);64-67.
[8]马琦,边云飞,白瑞,等.吡咯列酮通过内质网应激致凋亡途径促进大鼠血管平滑肌细胞钙化[J].中国医药指南,2015,13(7):13-16.
[9]袁妙兰,段新云,马育林.网膜素对成骨细胞向钙化血管平滑肌细胞分化的影响及其机理[J].中国骨质疏松杂志,2015,21(3):269-274.
[10]傅碧玲,邹世海,彭鑫,等.高磷、高钙诱导人血管平滑肌细胞钙化的研究[J].贵阳医学院学报,2015,40(6):603-607.
