psm-mec在临床分离表皮葡萄球菌中的分布和表达
2015-12-06杨永长肖代雯胡洪华黄文芳
杨永长,肖代雯,姜 伟,陈 亮,胡洪华,周 薇,黄文芳
四川省医学科学院·四川省人民医院 检验科(成都 610072)
表皮葡萄球菌(Staphylococcus epidermidis,S.epidermidis)是人体皮肤正常菌,也是引起院内感染常见致病菌。当S.epidermidis在医疗设施中形成生物被膜后,可引起慢性感染和导管相关性感染,难以治愈,已引起医学界广泛关注[1-6]。 但S.epidermidis生物被膜形成的分子机制尚不完全清楚。近年来,国外学者[7-9]研究发现,葡萄球菌染色体mec基因盒(staphyloccoccal cassette chromosome mec,SCCmec)伴随基因psm-mec能调节耐甲氧西林金黄色葡萄球菌(methicillin resistant Staphylococcus aureus,MRSA)生物被膜形成,在具有生物被膜形成能力的S.epidermidis标准菌株RP62A培养上清存在PSM-mec多肽。前期预实验结果显示携带psm-mec基因的耐甲氧西林表皮葡萄球菌(methicillin resistant Staphylococcus epidermidis,MRSE)具有生物被膜形成能力,提示psmmec基因可能与MRSE生物被膜相关,但缺乏psmmec在临床分离S.epidermidis中分布和表达的实验证据。本研究采用分子生物学技术探讨psm-mec在临床分离S.epidermidis中的分布和表达,为深入分析其功能提供理论依据。
1 材料与方法
1.1 菌株来源
165 株S.epidermidis来自2012年3月至2014年3月四川省人民医院住院患者分离的非重复菌株,所有菌株均采用全自动微生物鉴定系统鉴定,其中血液分离138株,痰液分离15株,中段尿液分离5株,伤口分泌物分离7株。S.epidermidis标准菌株ATCC12228为本实验室保存菌株。
1.2 试剂与仪器
细菌 DNA提取试剂(广州达安);2×Taq Master Mix、Ultra SYBR Mixture 、TRIzon 总RNA提取试剂、HiFi-HMMV逆转录试剂(北京康为世纪);100bp DNA Ladder(北京天根);LA Taq高保真DNA聚合酶、dNTPs、10×LA Taq BufferⅡ(TaKaRa);血平板(郑州安图生物);琼脂糖(Biowest);Tris碱(Novon);PCR扩增仪PTC-200、凝胶成像仪(Bio-Rad);荧光定量 PCR 仪7500(ABI);生物安全柜、细胞培养箱(Heal Force);电泳仪(Sanvant);紫外分光光度计、高速低温离心机(Eppendorf);esp,mecA,psm-mec,fudoh 和 p221片段扩增的引物由上海Invitrogen公司合成。
1.3 细菌培养与基因组DNA提取
接种单个菌落至3mL LB液体培养基,37℃220r/min培养过夜。取1mL菌液,离心收集细菌,弃上清。沉淀加入100μL DNA提取液,100℃10min,以10 000r/min离心 5min,离心半径9.5cm,上清即为S.epidermidis DNA,-20℃保存备用。
1.4 PCR扩增esp和mecA
根据文献[10],采用PCR扩增esp和mecA 进一步区分MRSE和甲氧西林敏感表皮葡萄球菌(methicillin susceptible Staphylococcus epidermidis,MSSE)。
1.5 扩增psm-mec、fudoh和p221基因片段
通过扩增psm-mec、fudoh和p221片段(图1)鉴定携带psm-mec MRSE菌株。psm-mec引物序列、反应体系和扩增条件参考前期研究方法进行[10]。fudoh基因位于SCCmec上,序列包含psmmec全长及其上下游区域,fudoh基因扩增引物序列F:5′-CAATTCACTTGTCTTAAACTTTGTAGA AAAAGAAG-3′,R:5′-TATTTTATTTTCCATA ATTGCCTACCCCATAAG -3′,产物大小为530bp。反应体系:2×Taq Master Mix 10μL,上、下游引物各1μL,DNA 2μL,ddH2O 6μL。反应条件:95℃预变性3min,95℃变性30s,48℃退火30s,72℃延伸30s,30个循环,最后72℃延伸5min。p221引 物 序 列 F:5′-CGGGATCCTTTTTCAAATTT TTGACATTTATGC-3′,R:5′-CGGAATTCTTA ACCGAAAGCCTGAATGCAAGTC-3′,产 物 大 小为237bp。反应体系:2×Taq Master Mix 15μL,上、下游引物各1μL,DNA 2μL,ddH2O 11μL。反应条件:95℃预变性3min,95℃变性30s,56℃退火30s,72℃延伸30s,30个循环,最后72℃延伸5min。产物经1%琼脂糖凝胶电泳后Bio-Rad凝胶成像仪检测,根据临床分离菌株psm-mec、fudoh和p221片段检测结果鉴定携带psm-mec MRSE。

图1 psm-mec和fudoh基因以及p221片段关系图
1.6 psm-mec基因及其上游序列分析
采用如上所述的方法扩增fudoh基因片段,阳性结果送Invitrogen公司测序,通过NCBI Blast比对软件进行序列分析。
1.7 psm-mec基因在临床分离MRSE中的表达
1.7.1 细菌总RNA的提取 单菌落接种LB液体培养基,37℃220r/min振荡培养至对数生长期,收集约1.5mL菌液于1.5mL Eppendorf管中,以9 700r/min离心2min,离心半径9.5cm,去上清。沉淀加入1mL TRIzon总RNA提取试剂,反复吹打几次,使细菌充分裂解,室温放置5min,使蛋白核酸复合物完全分离。溶液中加入200μL氯仿,剧烈振荡15s,室温放置2~3min。4℃,以10 630r/min离心15min,离心半径9.5cm,室温静置2~3min,此时液体分成3层(红色有机相,中间和上层无色水相,RNA主要在水相中)。小心吸取上层水相(切勿吸到中间层)加入新Eppendorf管中,加入等体积的冷冻异丙醇,将样品上下颠倒混匀,室温放置10min,4℃,以10 630r/min离心10min,离心半径9.5cm,去上清。加入1mL 75%乙醇溶液,涡旋混匀洗涤沉淀,4℃,以8 400r/min离心5min,离心半径9.5cm,去上清。将样品置于超净台中高风速吹干,大约30min。用经过预处理无RNase水溶解,总RNA进行分装,-80℃保存备用。
1.7.2 cDNA合成 以细菌总RNA为模板,采用HiFi逆转录试剂进行cDNA合成,反应体系为20μL:HiFi-MMLV(200U/μL)1μL,5×RT Buffer 4μL,dNTP Mix(2.5mmol/L)4μL,Primer Mix 2μL,RNA template 2μL,DTT(0.1mol/L)2μL,RNase-free water 5μL。42℃孵育50min,70℃孵育15min。反应结束后,以7 520r/min离心1min,离心半径9.5cm,置冰上冷却备用。
1.7.3 psm-mec 定量标准品制备 扩增含psmmec序列的p221序列,将其克隆至穿梭质粒pLI50,构建p221重组质粒,经过酶切证实为p221片段后大量制备质粒并保存质粒菌落。碱裂解法提取质粒,分光光度法测质粒含量,根据质粒含量和长度计算获得质粒拷贝数。用无RNase水稀释5个浓度梯度作为psm-mec定量的标准品。
1.7.4 实时荧光定量逆转录PCR 按照试剂盒说明书进行。定量PCR在Applied Biosystems Real-Time PCR System(ABI 7500)中进行。反应体系为20μL,2×Ultra SYBR Mixture 10μL,上、下游引物(1μmol/L)各0.5μL,cDNA 2μL,RNasefree water 7μL。定量PCR反应条件为95℃预变性10min,95℃变性30s,56℃退火30s,72℃延伸32s,共40个循环,同时设5个浓度梯度标准品、阴性和阳性对照。根据标准曲线对目的基因进行定量分析。
2 结果
2.1 临床分离S.epidermidis以MRSE为主
PCR扩增产物电泳结果显示,165株临床分离细菌均可扩增出esp基因片段,说明这些菌株均为S.epidermidis,与临床微生物学鉴定相符。mecA阳性138株,mecA阴性27株。提示MRSE占临床分离S.epidermidis的83.64%。
2.2 psm-mec仅分布于 MRSE中
165 株临床分离S.epidermidis中有29株可扩增出psm-mec、fudoh基因和p221片段,携带率为17.58%;进一步分析发现,所有psm-mec阳性标本均为MRSE,而27株 MSSE中未扩增出psm-mec基因,提示psm-mec基因仅存在于 MRSE中(图2和图3)。
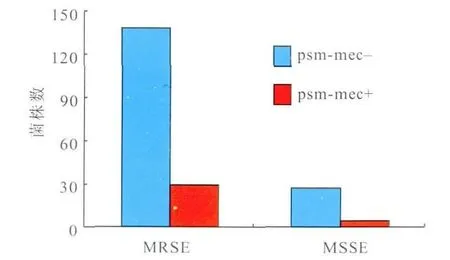
图2 psm-mec基因在临床分离S.epidermidis中的分布
2.3 psm-mec基因及其上游序列分析
29株psm-mec阳性MRSE均扩增出fudoh基因,测序结果经Blast比对显示,29株psm-mec基因编码序列与数据库完全匹配,表明所有菌株的psmmec基因编码序列无突变位点存在。而其中6株MRSE在psm-mec上游-12处发现单碱基突变(G>A)(表1)。

表1 临床分离MRSE菌株psm-mec基因突变分析
2.4 psm-mec在MRSE中的表达量检测
为了探讨psm-mec在MRSE中的表达,首先我们构建了含psm-mec的质粒p221,提取质粒后对其进行定量,并计算出其相应的拷贝数,然后将其进行系列梯度稀释,通过SYBR荧光染料法进行PCR扩增,获得扩增曲线,调节基线和阈值,得到标准曲线(图4)。5个浓度梯度获得标准曲线的相关系数为0.997,斜率为-3.27,截距为47.86,提示建立的SYBR荧光定量PCR可对psm-mec基因的表达进行定量分析。
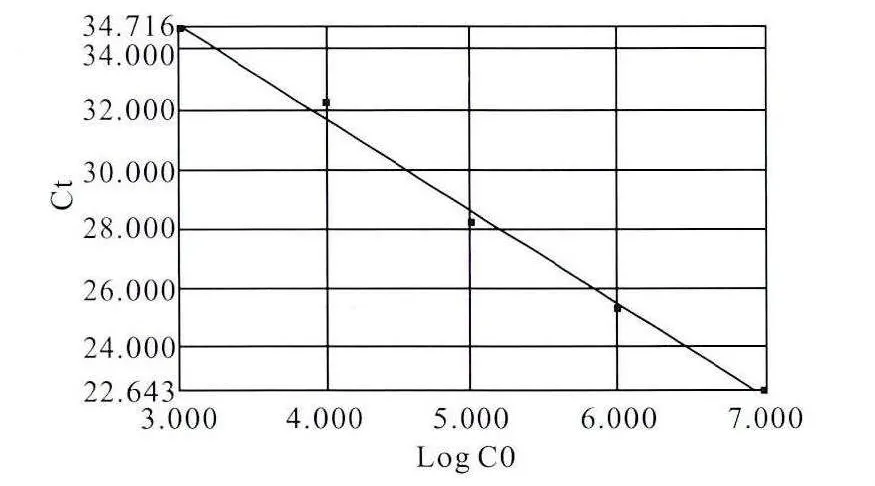
图4 定量PCR检测psm-mec表达量的标准曲线
提取20个psm-mec阳性MRSE的总RNA,通过逆转录获得cDNA,运用上述的SYBR荧光定量PCR方法对临床分离MRSE的psm-mec进行定量分析。通过分析发现,所有标本均有psm-mec表达,其表达量在103~107拷贝之间。进一步分析G>A点突变株与野生株之间psm-mec转录水平的差异,结果显示突变株和野生株之间psm-mec的表达无明显差异,提示G>A点突变不影响psm-mec基因转录(图5)。
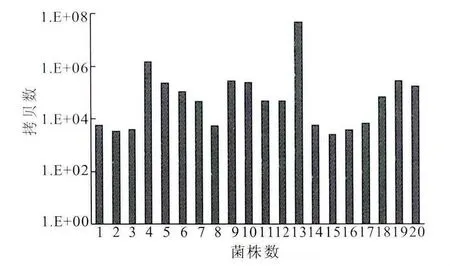
图5 临床分离psm-mec阳性MRSE菌株的psm-mec基因表达情况
3 讨论
定植人体皮肤表面的S.epidermidis是一种重要的院内感染条件致病菌,免疫抑制患者中大部分慢性感染和导管相关感染均由S.epidermidis引起[1]。在美国,22%ICU 患者的血流感染和13%人造瓣膜心内膜炎归咎于S.epidermidis,每年用于治疗S.epidermidis感染的费用高达20亿美元左右[2]。我国一项涉及15个城市、17家医院的调查显示,80%以上临床分离S.epidermidis为MRSE[3]。近年来,MRSE的检出率越来越高,已成为全球院内感染的重要病原菌[4-5]。
生物被膜形成是S.epidermidis的主要致病机制[6],其分子机制尚不完全清楚。研究[7]发现,可移动SCCmec上存在一种具有调节MRSA生物被膜的新基因psm-mec,该基因只存在院内感染MRSA中,而在社区获得性MRSA中尚未发现此基因。由于MRSA的SCCmec可能来源于MRSE,因此我们设想院内感染分离的临床MRSE菌株可能也携带psm-mec基因。本研究收集了165株临床分离S.epidermidis,通过微生物学和分子生物学区分MRSE和MSSE,由于fudoh基因和p221片段覆盖psm-mec序列全长及其上游区域[8],我们通过PCR扩增psm-mec、fudoh基因和p221片段证实165株临床分离S.epidermidis中,携带psm-mec基因的菌株为29株,在MRSE中占17.58%,高于MRSA中10%左右的携带率,提示psm-mec在临床分离MRSE中存在更为普遍,对其在生物被膜形成过程中作用的研究更有意义。统计分析发现,psmmec仅分布于MRSE中。
为了研究psm-mec表达,我们构建了含有psmmec基因的重组质粒p221,并通过计算和梯度稀释获得荧光定量PCR检测psm-mec标准品。提取携带psm-mec基因的MRSE细菌总RNA,逆转录后通过荧光定量PCR检测发现,所有临床分离的携带psm-mec基因的MRSE均表达此基因,说明这些携带菌株都表达psm-mec mRNA。
DNA序列分析显示,在psm-mec ORF区域无碱基突变,且与数据库序列完全一致,进一步证实psm-mec基因在 MRSE中的分布。同时少部分psm-mec存在-12G>A点突变,与 MRSA中psmmec的突变模式(-7T>C)不同[11]。在 MRSA中,psm-mec突变将导致毒力增加和生物被膜形成能力降低。我们推测在MRSA中psm-mec的突变可能抑制了其mRNA的表达,从而降低生物被膜形成能力。本研究通过荧光定量RT-PCR证实,-12G>A点突变不影响psm-mec基因转录。
综上所述,psm-mec仅分布和表达于部分临床分离MRSE中,psm-mec上游-12G>A点突变不影响psm-mec的表达,为探讨psm-mec与生物被膜之间的关系及分子机制提供了依据。
[1]Otto M.Staphylococcus epidermidis—the ‘accidental′pathogen[J].Nat Rev Microbiol,2009,7(8):555-567.
[2]Rogers KL,Fey PD, Rupp ME.Coagulase-negative staphylococcal infections[J].Infect Dis Clin North Am,2009,23(1):73-98.
[3]Xiao YH,Wang J,Li Y,et al.Bacterial resistance surveillance in China:a report from Mohnarin 2004-2005[J].Eur J Clin Microbiol Infect Dis,2008,27(8):697-708.
[4]Raad I,Hanna H,Maki D.Intravascular catheter-related infections:advances in diagnosis,prevention,and management[J].Lancet Infect Dis,2007,7(10):645-657.
[5]Xu Z,Shi L,Alam MJ,et al.Integron-bearing methicillin-resistant coagulase-negative staphylococci in South China,2001-2004[J].FEMS Microbiol Lett,2008,278(2):223-230.
[6]Otto M.Molecular basis of Staphylococcus epidermidis infections[J].Semin Immunopathol,2012,34(2):201-214.
[7]Queck SY,Khan BA,Wang R,et al.Mobile genetic elementencoded cytolysin connects virulence to methicillin resistance in MRSA[J].PLoS Pathog,2009,5(7):1000533.
[8]Kaito C,Saito Y,Nagano G,et al.Transcription and translation products of the cytolysin gene psm-mec on the mobile genetic element SCCmec regulate Staphylococcus aureus virulence[J].PLoS Pathog,2011,7(2):1001267.
[9]Aoyagi T,Kaito C,Sekimizu K,et al.Impact of psm-mec in the mobile genetic element on the clinical characteristics and outcome of SCCmec-II methicillin-resistant Staphylococcus aureus bacteraemia in Japan[J].Clin Microbiol Infect,2014,20(9):912-919.
[10]杨永长,陈亮,肖代雯,等.携带psm-mec基因的耐甲氧西林表皮葡萄球菌产细菌生物膜的能力研究[J].临床检验杂志,2014,32(9):700-702.
[11]Kaito C,Saito Y,Ikuo M,et al.Mobile genetic element SCCmec-encoded psm-mec RNA suppresses translation of agrA and attenuates MRSA virulence [J].PLoS Pathog,2013,9(4):1003269.
