14 335例妇科门诊就诊者人乳头状瘤病毒感染结果的报告
2015-12-02贺国丽蔡俊宏
贺国丽,蔡俊宏
(海南省人民医院,海口 570311)
人乳头瘤病毒(HPV)是宫颈病变与宫颈癌的主要病因,已知与宫颈癌相关的高危型HPV型别有14种,研究报道认为宫颈的HPV感染率和感染型别存在着地区差异。本文通过对14 335份宫颈细胞刷片标本的14种高危HPV亚型检测,初步了解本地区女性高危HPV感染率以及所感染高危亚型的分布情况,为本地区癌前病变和宫颈癌的筛查以及预防性和治疗性疫苗的应用提供资料和依据。
1 资料与方法
1.1 研究对象
收集2009~2012年我院妇科门诊就诊或体检者的宫颈刷片标本共14 335份,患者年龄17~78岁,平均(36.85 ±9.69)岁。
1.2 试剂与仪器
凯普HPVDNA提取试剂盒、DNA扩增试剂盒和HPV核酸分型检测试剂盒(潮州凯普生物化学有限公司)、PCR扩增仪、Hybrmiax医用核酸分子快速杂交仪。
1.3 标本采集
扩阴器暴露宫颈口后,用特制宫颈刷顺时针转5圈以上,将刷头折断放入已加有专用细胞保存液的取样管中,立即送检或4℃保存在48小时内检测。
1.4 分型检测
1.4.1 DNA模板的制备 样本制备过程按凯普公司的HPVDNA提取试剂盒使用说明进行。将样品管涡旋振荡混匀,取500μl宫颈细胞保存液,14 000 r/min离心5min,沉淀加400μl溶液Ⅰ于100℃水浴15min,再加入 400μl溶液Ⅱ,14 000r/min 离心5min,弃去上清,获取核酸沉淀,用60μl溶液Ⅲ溶解核酸沉淀后备用。
1.4.2 PCR扩增 使用凯普DNA扩增试剂盒扩增,反应体系及反应条件根据试剂盒说明书。每管23.25μl PCRmix和0.75μl Taq 酶配制扩增反应液,各加已提取的DNA样本模板1μl进行扩增。PCR反应条件为 95℃ 预变性 9min,95℃20s,55℃30s,72℃30s,共40 个循环,72℃延伸5min。
1.4.3 杂交并显色 按照Hybrmiax医用核酸分子快速杂交仪操作步骤进行杂交试验并显色。
1.4.4 结果判读 检测结果阳性为肉眼清晰可见的紫蓝色圆点,根据试剂盒提供的膜条HPV分型分布图判读结果。
1.5 统计方法
用Excel建立数据库并进行统计,χ2检验统计分析。
2 结果
2.1 高危HPV各亚型感染率
在14 335例标本中,高危HPV阳性4 496例,阳性率为31.36%。位居前三位的高危亚型为52、16、58,感染率分别为 22.75%、20.82%、15.01%,其 余 依 次 是 18(7.59%)、33(6.49%)、68(5.75%)、31(5.18%)、39(3.49%)、56(3.12%)、66(2.67%)、59(2.56%)、35 和 51 分别(1.75%)、45(1.07%)。因低危HPV阳性仅80例且型别分散,未纳入统计分析。
在HPV阳性者中,单一亚型感染者3 804例,占84.61%;2种亚型混合感染者 531例,占11.81%;3种亚型混合感染106例,占2.36%;4种亚型混合感染35例,占0.78%;5种亚型混合感染18例,占 0.40%;7种亚型混合感染 2例,占0.05%。各亚型感染情况见表1。

表1 14种高危HPV亚型感染分布及感染率
2.2 各年龄段女性宫颈高危HPV检出情况
在4 496例高危HPV阳性的受检者中,以<50岁居多为3 928例,占87.37%。在各年龄段中,<30岁 1 238例,阳性率为 33.92%;31~40岁1 389例,阳性率 26.71%;41~50 岁1 301 例,阳性率30.60%;51~60岁398例,阳性率46.88%;>60岁170例,阳性率44.39%。HPV感染率在<30岁与31~40 岁(χ2=53.10,P <0.005)、31~40 岁与41~50 岁(χ2=16.39,P <0.005)、41~50 岁与 51~60 岁(χ2=84.28,P <0.005)年龄段之间的差异有统计学意义。在51~60岁与>60岁年龄段的差异无统计学意义(χ2=0.62,P >0.25)。见表2。
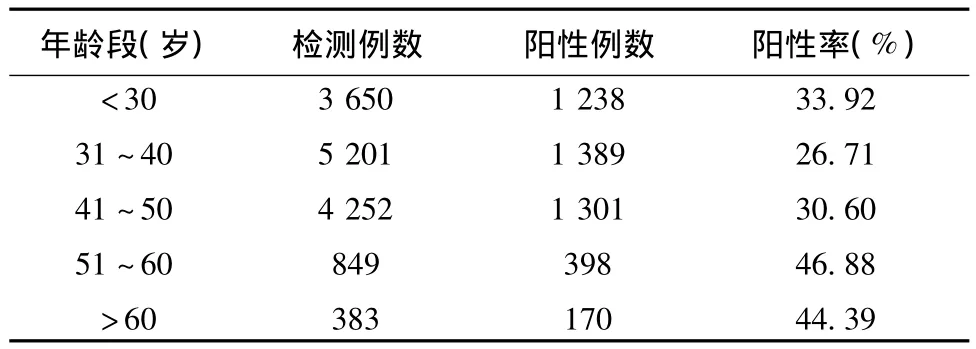
表2 不同年龄段高危HPV感染情况
2.3 HPV多重感染情况
在HPV多重感染中,以二种亚型的混合感染多见,阳性率在 <30岁与 31~40岁(χ2=1.31,P >0.25)、31~40 岁与41~50 岁(χ2=0.27,P >0.5)、41~50岁与 >50 岁(χ2=1.68,P >0.25)之间的差异均无统计学意义。HPV三种亚型及以上的多重感染中,阳性率在 <30岁与31~40岁(χ2=38.69,P < 0.005)、41~50 岁与 > 50 岁(χ2=89.60,P<0.005)的差异有统计学意义;在31~40岁与41~50岁年龄段的差异无统计学意义(χ2=0.89,P >0.5)。见表3。

表3 多重HPV感染情况
3 讨论
尽管HPV感染在女性人群中是非常普遍的,但是HPV的感染率有较大的地区性差异,报道的范围为 1.4%~25.6%[1]。国外一项对多个地区的157 879名细胞学正常女性的检测分析显示,全球的HPV感染率为10.4%,其中非洲为22.1%,中美洲为20.4%,南美洲为12.3%,北美洲为11.3%,亚洲为8.0%,欧洲为8.1%[2],分析认为形成这一差异的主要原因,应该是各地区间经济发展不平衡所导致的生活水平和条件不同造成的[3-4]。目前尚无全国性的宫颈HPV感染情况的权威性结果,但已有不少省市区发表了各自的HPV感染情况报告,如深圳市为 24.5%、湖南长沙 44.45%、潮州地区8.25%、西安长安区 23.56%、广西南宁 20.50%、重庆地区为37.3%、成都农村地区为21.98%,黔北地区23.76%、浙南地区 28.98%、陕西咸阳 18.70%,浙江台州地区对10 007例妇科门诊患者检测的HPV感染率为44.45%[3-11]。本文的门诊感染者中以高危亚型感染为主,且高危型HPV阳性率达31.36%,属于感染率比较高的地区,值得重视。因为这些受检者系门诊就诊者,不是接受普查的人群,是否存在偏差还待下一步研究证实。
研究结果显示,HPV亚型的分布与种族、年龄、地域等诸多因素有关联。全世界范围内共同的最常见感染亚型是16型,18型位居第二,45型在非洲、欧洲、北美洲位居第三,31型在南美洲位居第三,52、58型在亚洲常见[12]。我国浙江台州、深圳、黔北地区和湖南长沙、浙南地区报道的HPV高危亚型位居前三位的是 HPV16、52、58 和 16、58、52,南宁和潮州地区为52、16、58。本文位于前三位的亦分别为 52、16、58 亚型,分别占 22.75%、20.82%、15.01%,而西安报道的是 16、18、31,江苏常州地区是16、58、39。中国南方地区52、58亚型的感染率似乎较北方高[7],然而 HPV52、HPV58的感染率,是否在国内的其它地区也远超过HPVl8,还有待于相关的研究确定。造成这种优势亚型分布的差异可能与地理环境、社会生物因素或宿主的遗传免疫因素有关[4,7]。
HPV单一亚型感染是主要的感染模式,占60%以上,高于多种亚型感染。本文中单一高危亚型感染占84.61%,多重感染占15.39%,其中二个亚型混合感染占11.81%、三个亚型感染占2.36%、四个亚型感染占0.78%、五个亚型感染占0.40%、七个亚型感染占0.04%。检测结果表明HPV是以单一感染为主的,52、16、58、18、33、68、31 是本地区的常见亚型,而在多重感染中 16、58、52、18、33 仍然为最常见基因型,与国内报道的大部分情况相似。
二种亚型的混合感染率,在各年龄段之间没有差异。而三种及以上的多重感染率以<30岁和>50岁年龄段为高,可能是因为年轻女性的性生活活跃、存在流产、分娩事件的影响以及健康意识不强;而老年女性卵巢功能减退,免疫力下降,病毒清除能力减弱,健康意识弱化,导致这二个年龄段容易出现多型 HPV 的混合感染[4,6,8,11]。
预防和治疗HPV感染的理想方法是疫苗接种,而研制和应用HPV疫苗就需要了解各地区HPV型别的感染状况、感染的优势型别。虽然目前认为HPV52、58、33亚型与宫颈癌的相关性低于HPV16、18,但它们在我国所呈现的高感染率和普遍性应该予以足够的重视[3,6,7,10,11]。现在国际上使用的疫苗主要是二价疫苗(16/18)或四价疫苗(16/18/6/11),并没有包含我国高发的高危型52、58、33等,所以现有的HPV疫苗如要在我国推广使用尚有待于改进增加型别。HPV58和52是我国包括子宫颈癌高发区妇女中位居第一、第二或第三种的型别,因此这些型别在亚洲(尤其是中国高发区)人群中具有重要意义,包括58、52、33型的HPV疫苗才能为我国及相关国家妇女提供更高保护率。正如WHO专家提出,如果增加 HPV31,33,35,45,52 和 58 型,可以在预防世界70%的宫颈癌基础上增加约20%对宫颈癌的预防能力[6],因此应用于我国的HPV疫苗应该至少覆盖16、58、52亚型。
本文通过HPV分型检测方法对海南地区妇科门诊就诊者的高危型HPV感染情况进行了分析,结果显示HPV以单一型感染为主;感染率是31.36%;位居前几位亚型是 16、52、58、18、33、68、31 型;多重感染亚型可有七种之多;HPV感染与年龄有一定关系。明确HPV在特定地区及人群的感染率及型别分布差异,对HPV所致疾病的防治及宫颈癌疫苗研制应用具有重要的指导意义。
[1] 彭 雪,胡丽娜.HPV感染及危险因素的研究[J].实用妇产科杂志,2010,26(3):168-170.
[2] Sanjose S,Diaz M,Castellsague X,et al.Worldwide prevalence and genotype distribution of cervical human papillomavirus DNA in women with normal cytology:a meta-analysis[J].Lancet Infect Dis,2007,7(7):453-459.
[3] 王 艳,陈雅珍,丁友法,等.浙南地区4 034例宫颈人乳头瘤病毒感染状况分析[J].中华医院感染学杂志,2012,22(4):750-752.
[4] 吴春龙,郭 锋,齐娟飞.10 007例台州女性HPV感染状况及21种基因亚型分析[J].中国卫生检验杂志,2010,20(12):3461-3463.
[5] 李亚宁,马艳侠.某城区女性人乳头瘤病毒感染状况调查分析[J].国际检验医学杂志,2012,33(9):1066-1067.
[6] 聂妹芳,李登清,黄民主,等.11 461例妇科门诊患者HPV亚型感染状况的研究[J].中国现代医学杂志,2011,21(27):3434-3438.
[7] 罗招云,杨立业,翁妙珊,等.潮州地区人乳头瘤病毒型别分布特征分析[J].分子诊断与治疗杂志,2011,3(3):177-180.
[8] 吴夏枫,喻 晶,刘晓翌,等.1 000例妇女宫颈人乳头瘤病毒基因分型检测结果分析[J].中国实验诊断学,2013,17(5):865-867.
[9] 单玉珍,马向东,刘明晖,等.西安市长安区妇科就诊妇女高危型HPV感染及亚型分布调查研究[J].中国现代医药杂志,2012,14(4):38-41.
[10]肖 瑜,李 彦,周远忠,等.黔北地区5 925例妇女子宫颈人乳头瘤病毒的感染及其亚型分布[J].国际检验医学杂志,2013,34(7):894-896.
[11]白 华,黄 宁,刘继秀.南宁市妇女人乳头瘤病毒感染的流行病学调查[J].国际妇产科学杂志,2013,40(1):81-83.
[12] Lo KW,Wong YF,Chan MK,et al.Prevlence of human papillomavirus in cervical cancer:a multicenter study in China[J].Int J Cancer,2002,100(3):327-331.
