图像引导大分割调强放疗同步化疗治疗局部晚期非小细胞肺癌的临床研究*
2015-12-02吕家华王奇峰李厨荣宋宴琼
吕家华,李 涛,李 昉,王奇峰,刘 丽,李厨荣,宋宴琼
(四川省肿瘤医院放疗科,成都610041)
肺癌是世界范围内发病率和死亡率均居首位的恶性肿瘤,其中非小细胞肺癌约占80%[1]。同步放化疗是局部晚期NSCLC的主要治疗手段[2]。部分研究证实,大分割放疗治疗局部晚期NSCLC的疗效可能优于常规放疗[3]。放射性毒副反应是限制实施大分割治疗手段的主要因素。图像引导放疗(IGRT)[4]通过在线校位保证肿瘤受到高剂量照射同时周围正常组织得到最大限度的保护,为大分割放疗发挥优势、避免负面效应提供了技术上的革新。本研究旨在观察图像引导大分割放疗联合化疗治疗局部晚期NSCLC的疗效和毒副反应,评价其可行性、有效性和安全性。
1 资料与方法
1.1 一般资料
2011年06月至2013年04月我院放疗科收治的经病理学或细胞学确诊的局部晚期初治非小细胞肺癌44例。所有患者KPS评分≥70分。血常规,肝、肾功能及心脏功能基本正常;无放化疗禁忌症。年龄39~76岁,中位年龄61岁;其中男性35例,女性9例;腺癌22例,鳞癌20例,其他2例。根据TNM第七版分期(UICC2009版),IIIA期20例,IIIB期24例。周围型29例,中央型15例;病变位于左肺16例,位于右肺28例。
1.2 治疗方法
1.2.1 放射治疗 患者取仰卧位,双手交叉抱肘置于头顶,热塑胸腹部体膜固定体位。平静呼吸状态下行定位CT扫描,3mm每层,扫描范围从环状软骨水平至肝脏下缘,将CT图像传输到三维治疗计划系统(Oncentro Masterplan)。根据ICRU62号文件规定勾画靶区。大体肿瘤靶体积(GTV)范围包括肺内原发灶(肺窗下勾画,窗宽1600,窗位-600),同侧肺门及纵隔转移淋巴结(纵隔窗下勾画,窗宽400,窗位20)。淋巴结引流区采用阳性淋巴结累及区域照射。计划靶区(PTV)为GTV外扩8~10mm。危及器官(organ at risk,OAR)包括双肺、脊髓、气管、食管和心脏等。90%的等剂量线包绕PTV。正常器官限量:双肺 V05<63%,V20<30%,V30<20%;脊髓1cc<45Gy;心脏V30<40%,食管V50<50%。患者在治疗前先行锥形束CT(cone beam CT,CBCT)扫描,获取扫描图像,根据系统的匹配功能,将CBCT影像和计划CT影像及其靶中心进行配准,获得靶中心X、Y、Z 3个方向的误差,规定误差允许的范围为2mm。如果X、Y、Z任一方向误差大2mm,则及时纠正摆位误差。原发灶放疗总剂量60~72Gy,3~8Gy/次,1 次/天,3 次~5 次/周。生物等效剂量(BED)78~115.2Gy。
1.2.2 化疗 化疗方案采用以铂类为基础的两药联合化疗方案,与放疗同步进行。铂类药物剂量采用顺铂(DDP)25mg/m2,d1~3或奈达铂80mg/m2,d1。鳞癌患者铂类联合紫杉醇135~175mg/m2或多西他赛60~75mg/m2,d1,腺癌患者铂类联合培美曲赛500mg/m2,d1。化疗周期数为2、3、4个及以上周期的患者分别占45.5%、22.7%和31.8%。
1.3 近期疗效及毒副反应评价
1.3.1 近期疗效 近期疗效按照国际实体瘤疗效评价标准 (Response Evaluation Criteria in Solid Tumors,RECIST1.1)进行评价。治疗结束后1月根据治疗前后胸部CT肿瘤的变化情况进行客观疗效判定,有效者4周后再次检查确认,有效率(RR)以(CR+PR)计算。
1.3.2 毒副反应评价 毒副反应评价标准采用美国放射治疗肿瘤协会(Radiation Therapy Oncology Group,RTOG)急性放射损伤分级标准和常用药物毒性标准CTCAEv3.0(Common Terminology Criteria for Adverse Events version 3.0),血液学毒性评估时间为放化疗期间,食管和肺毒性放射性毒性反应在治疗过程中及结束后根据患者病情变化随时评价。
1.4 随访
随访根据住院及门诊复查记录,辅以电话随访,详细记录患者肿瘤变化及毒副反应情况。
1.5 统计学分析
采用SPSS19.0统计软件建立数据库并进行分析,有效率及毒副反应发生率采用直接法。生存分析采用Kaplan-Meier法。
2 结果
2.1 近期疗效
44例患者,完全缓解(CR)7例(15.9%),部分缓解 (PR)29 例 (65.9%),稳 定 (NC)6 例(13.6%),进展(PD)2 例(4.5%),总有效率(RR)81.8%。
2.2 远期疗效
中位随访时间21个月(7~38月),1、2年总生存率(OS)和中位生存时间(MST)分别为79.5%、51.3%和25个月(见图1)。1、2年局部控制率分别为86.4%、59.1%。1、2 年无疾病进展生存(PFS)和中位无进展生存时间(MPFS)分别为61.2%、38.7%和18个月(见图2)。

图1 44例非小细胞肺癌患者生存曲线

图2 44例非小细胞肺癌患者无疾病进展生存曲线
2.3 毒副反应
全组患者3级以上白细胞、血红蛋白、血小板计数减少率分别为 38.6%、6.8%、13.6%。3 级以上恶心呕吐发生率为13.6%。3级以上急性放射性肺炎、放射性食道炎发生率分别为6.8%和9.1%(见表1)。
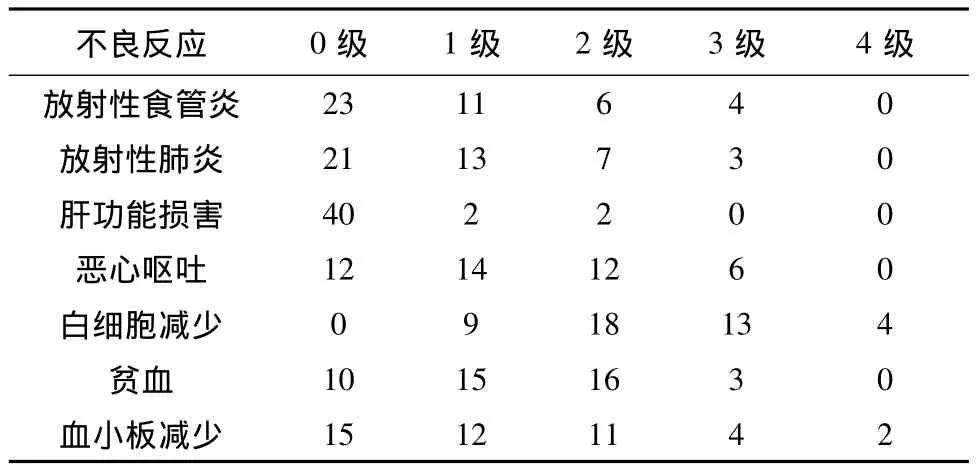
表1 44例非小细胞肺癌图像引导放化疗不良反应(例)
3 讨论
对于不能手术的局部晚期NSCLC,同步放化疗是标准治疗方案[2]。肺癌放射治疗失败的主要原因包括局部未控、局部复发和远处转移[5],而远处转移与局部未控或复发密切相关。因此,提高肿瘤局控率是改善局部晚期NSCLC患者生存状况的重要手段。既往研究表明,肿瘤局部放疗剂量越高,局部控制率越好[6]。RTOG 0617试验[7]纳入了464例行同步放化疗的3期NSCLC患者,根据放疗剂量分为60Gy组和74Gy组。研究结果显示,高剂量组(74Gy)患者总生存(OS)反而较低剂量组(60Gy)下降,且毒副反应更大。该研究说明通过常规分割放疗提高照射剂量并不能增加非小细胞肺癌的治疗疗效,原因可能与剂量的提高导致治疗时间延长,且增加了毒副反应有关。
大分割放疗通过增加分割剂量减少放疗次数,可以提高肿瘤的生物等效剂量(BED),同时还能缩短放疗总时间,避免肺癌治疗期间的加速再增殖及亚致死损伤修复。近年有较多研究开始关注大分割放疗治疗局部晚期非小细胞肺癌并且取得了较好的治疗疗效。Bearz[8]等采用大分割放疗联合化疗治疗37例3期非小细胞肺癌,放疗剂量60Gy/25f(2.4Gy/f)。全组患者有效率(ORR)31/37(84%),中位无进展生存(MPFS)20月,中位生存时间(MST)24月。Lin[9]等采用大分割放疗治疗13例不可手术3期非小细胞肺癌,分割剂量3Gy/f,剂量逐渐递增到66 Gy,69 Gy,72 Gy。患者中位无进展生存(PFS)12月,1年PFS为49.4%。
本研究对44例局部晚期非小细胞肺癌采用大分割方式治疗。分割剂量3~8Gy/次,1次/天,3~5次/周。全组患者有效率(CR+PR)81.8%,高于文献报道常规分割三维适形放疗联合化疗的近期疗效[10]。全组患者 1、2年局部控制率分别为86.4%、59.1%,1、2 年总生存率(OS)和中位生存时间(MST)分别为79.5%、51.3%和25个月,均优于既往文献报道常规放疗的结果[11],说明非小细胞肺癌采用大分割放疗可以提高治疗的近期疗效和长期生存。本研究结果,也优于目前国内外文献报道其他大分割放疗治疗疗效[12],可能与本研究患者单次分割剂量较大,中位放疗剂量较高有关。
放疗毒副反应如放射性肺炎、放射性食管炎是非小细胞肺癌放疗的主要限制,特别是大分割、高剂量放疗可能会导致更严重的毒副反应,因此需要更先进的放射治疗技术。为尽可能减少放射性损伤的发生,本研究采用了图像引导放疗技术,即每次大分割放疗前均行CBCT扫描验证纠正摆位误差,在前后、左右、头脚三个方向上将摆位误差控制在2 mm以内,最大程度上来降低正常组织受照射的体积。全组患者3级及以上放射性肺炎、放射性食道炎发生率分别为6.8%和9.1%,低于文献报道中晚期非小细胞肺癌同步放化疗放射性肺炎、放射性食道炎发生率[13-14],也低于文献报道大分割放疗的副反应[15],这可能得益于本研究所有患者均采用图像引导技术放疗,减少了放疗对正常组织的照射和放射性损伤。
本研究在大分割放疗的同时,行铂类为基础的双药联合化疗,骨髓抑制是最主要化疗相关毒副反应,其中3级及以上的白细胞、血红蛋白、血小板计数下降率分别为 38.6%、6.8%、13.6%,经治疗后均恢复正常,未明显影响患者的放化疗的进行。
综上所述,在图像引导下对局部晚期非小细胞肺癌采用大分割调强放疗,同步双药联合化疗,可取得较好的近期疗效及1、2年生存率,其放化疗不良反应可耐受。本研究仅为单中心、单臂研究,尚不能完全证明局部晚期非小细胞肺癌行大分割调强放疗相对于常规分割放疗的优势。因此,我们计划进一步设计并开展前瞻性、多中心、随机对照研究。
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2] Curran WJ,Paulus R,Langer CJ,et al.Sequential vs.concurrent chemoradiation for stage III non-small cell lung cancer:randomized phase III trial RTOG 9410[J].J Natl Cancer Inst,2011,103(19):1452-1460.
[3] Kepka L,Tyc-Szczepaniak D,Bujko K.Dose-per-fraction escalation of accelerated hypofractionated three-dimensional conformal radiotherapy in locally advanced non-small cell lung cancer[J].J Thorac Oncol,2009,4(7):853-861.
[4] 于金明,袁双虎.图像引导放射治疗研究及其发展[J].中华肿瘤杂志,2006,28(2):81-83.
[5] Nguyen NP,Bishop M,Borok TJ,et al.Pattern of failure following chemoradiation for locally advanced non-small cell lung cancer:potential role for stereotactic body radiotherapy[J].Anticancer Res,2010,30(3):953-961.
[6] Kong FM,Ten HR,Schipper MJ,et al.High-dose radiation improved local tumor control and overall survival in patients with inoperable/unresectable non-small-cell lung cancer:long-term results of a radiation dose escalation study[J].Int J Radiat Oncol Biol Phys,2005,63(2):324-333.
[7] Kong FM,Ten HR,Schipper MJ,et al.An intergroup randomized phase III comparison of standard-dose(60Gy)vs high-dose(74Gy)chemoradiotherapy(CRT)+/-cetuximab(cetux)for stage III non-small cell lung cancer(NSCLC):results on cetux from RTOG 0617[J].Clin Adv Hematol Oncol,2014,12(1 Suppl 1):2-4.
[8] Bearz A,Minatel E,Rumeileh IA,et al.Concurrent chemoradiotherapy with tomotherapy in locally advanced non-small cell lung cancer:a phase I,docetaxel dose-escalation study,with hypofractionated radiation regimen[J].BMC Cancer,2013,13:513.
[9] Lin Q,Liu YE,Ren XC,et al.Dose escalation of accelerated hypofractionated three-dimensional conformal radiotherapy(at 3 Gy/fraction)with concurrent vinorelbine and carboplatin chemotherapy in unresectable stage III non-small-cell lung cancer:a phase I trial[J].Radiat Oncol,2013,8(1):201.
[10] Nakamura M,Koizumi T,Hayasaka M,et al.Cisplatin and weekly docetaxel with concurrent thoracic radiotherapy for locally advanced stage III non-small-cell lung cancer[J].Cancer Chemother Pharmacol,2009,63(6):1091-1096.
[11] Govaert SL,Troost EG,Schuurbiers OC,et al.Treatment outcome and toxicity of intensity-modulated(chemo)radiotherapy in stage III non-small cell lung cancer patients[J].Radiat Oncol,2012,7(7):150.
[12] Kaster TS,Yaremko B,Palma DA,et al.Radical-intent hypofractionated radiotherapy for locally advanced non-small-cell lung cancer:a systematic review of the literature[J].Clin Lung Cancer,2015,16(2):71-79.
[13] Palma DA,Senan S,Oberije C,et al.Predicting esophagitis after chemoradiation therapy for non-small cell lung cancer:an individual patient data meta-analysis[J].Int J Radiat Oncol Biol Phys,2013,87(4):690-696.
[14] Palma DA,Senan S,Tsujino K,et al.Predicting radiation pneumonitis after chemoradiation therapy for lung cancer:an international individual patient data meta-analysis[J].Int J Radiat Oncol Biol Phys,2013,85(2):444-450.
[15] Koning CC,Wouterse SJ,Daams JG,et al.Toxicity of concurrent radiochemotherapy for locally advanced non-small-cell lung cancer:a systematic review of the literature[J].Clin Lung Cancer,2013,14(5):481-487.
