胰腺癌精确放疗靶区研究进展
2015-12-02综述常冬姝夏廷毅审校
董 猛 综述,常冬姝,夏廷毅 审校
(中国人民解放军空军总医院肿瘤放疗科,北京100142)
胰腺癌的发病率逐年上升,恶性程度高,是预后极差的恶性肿瘤之一[1]。手术切除是胰腺癌的主要治疗方式,但胰腺特殊的解剖位置、复杂的毗邻关系,以及癌组织局部浸润、转移早,导致胰腺癌较早出现直接侵犯邻近结构及器官。由于缺乏有效的早期诊断方式,手术切除率极低,只有10%~15%左右的病人在明确诊断时得到根治性切除,但手术后5年存活率也仅为5%~20%[2],且术后通常会局部复发[3-5]。近年随着放射治疗仪器设备和技术的发展,尤其是CT模拟定位机、三维治疗计划系统、三维适形放疗(three-dimensional conformal radiotherapy,3DCRT)、体部立体定向放疗(stereotactic body radiation therapy,SBRT)、调强放疗(intensitymodulated radiation therapy,IMRT)和图像引导放疗(imaging guide radiation therapy,IGRT)相继应用于临床,标志着现代放射治疗跨入“精确定位、精确计划、精确治疗”为特征的时代,这一系列技术的应用在不增加正常组织剂量的同时逐步提高靶区剂量,从而提高肿瘤的局控率,改善患者生活质量[6-12]。胰腺癌的放射治疗主要适应于局部晚期胰腺癌和拒绝进行手术或因医学原因不能耐受手术治疗的可切除局限期胰腺癌患者,但由于胰腺癌特殊的生物学特性、低血供,以及靶区勾画范围和剂量分割模式的不一致,导致放疗后肿瘤局部复发率仍较高,放疗引起的胃、十二指肠等毒副反应仍较重。因此,胰腺癌精确放射治疗的实现至关重要。
整个放射治疗过程中放疗靶区范围的确定无疑是精确放疗的关键环节之一,包括可见病灶、显微病灶及必要的边界外放。本文旨在综述胰腺癌放疗靶区的相关研究进展。
1 大体肿瘤体积的确定
根据国际辐射单位和测量委员会(international commission on radiation units and measurements,ICRU)62号报告:大体肿瘤体积(gross tumor volume,GTV)为临床检查或影像学检查所能确定的肿瘤范围。
1.1 成像技术对胰腺癌GTV确定的影响
1.1.1 CT/MRI对胰腺癌 GTV确定的影响 CT影像定位很少发生图像畸变造成图像的失真,同时可以通过CT值转换为电子密度进行放射治疗剂量计算,因此以CT图像为基础制定的放疗计划在临床实践中已经得到广泛应用,但是单纯通过CT图像来确定胰腺癌的GTV同样存在诸多问题:①最佳的CT增强扫描条件、扫描层厚,以及适宜的窗宽、窗位;②CT图像上显现的GTV与病理学大体标本的GTV的关系;③胰腺癌转移淋巴结的确定;④胰腺癌累及血管的评判。合适的扫描时相是获取高质量胰腺双期增强扫描图像的关键因素之一,注射对比剂后扫描太早胰腺强化不充分,太晚则胰腺强化程度会下降,其结果均不利于胰腺肿瘤的显影。虽然扫描时相受多种因素的影响(CT扫描仪及其扫描参数、患者个体差异、对比剂注射速度等),有研究表明胰腺期多选在注射对比剂后30~55s进行扫描;门静脉期多选在注射对比剂后60~90s进行扫描[13]。杨晔等[14]的研究表明经静脉快速注入对比剂100ml,速率为 2.8~3.0ml/s,胰腺期选择在35~38s,门静脉期则选择在65~75s进行扫描。李丽等[15]采用高压注射器对27例患者经静脉以3.0ml/s的速率注入对比剂100ml,其结果显示胰腺期选择在30~40s,门静脉期选择在60~100s进行扫描。鉴于扫描时相的选择受个体差异影响显著,上述结果的可靠性还需大量的研究证实。关于胰腺癌GTV确定时选择什么样的窗宽、窗位最为适宜且最接近病理学大体标本的GTV,牛佳牧等[16]的研究结果认为正常胰腺在平扫时CT值为(51±4)Hu、胰腺期为(119±17)Hu、门静脉期为(99±16)Hu,肿瘤组织在平扫时CT值为(46±3)Hu、胰腺期为(51±18)Hu、门静脉期为(61±12)Hu,其密度差异在胰腺期肿瘤-胰腺为(66±28)Hu、门静脉期为(37±24)Hu。杨晔等[14]通过研究认为胰腺期肿瘤-胰腺密度差异为(65±12)Hu、门静脉期为(45±11)Hu。
CT图像显示的GTV与病理学所见的GTV范围的相互关系,吴江[17]等对33例手术切除的胰腺癌患者(男24例,女9例,年龄 38~79岁,平均64.6岁)的研究表明术前CT所测量病灶大小与手术病理测量结果一致性良好(P<0.05)。然而Arvold[18]等的研究表明CT图像显示的肿瘤大小与病理学所见的肿瘤大小并不一致,本研究回顾性评估了97例手术切除的胰腺癌患者,其中87例可用于术前CT肿瘤大小与新鲜病理标本肿瘤大小的比较,结果73例(84%)患者病理学测量的肿瘤直径大于CT,CT测量大小中位值为25mm,病理学测量大小中位值为34mm,病理与CT差值的中位值为7mm(范围,-15~43mm,P <0.0001),由此可见 CT显著低估了胰腺癌病灶大小。Arvold的研究还对数据进行线性回归分析得出病理学肿瘤大小的推算公式:病理最大直径=16mm+[0.75 × CT最大直径(mm)]。
胰腺癌GTV的范围包括原发肿瘤和转移淋巴结,其原发肿瘤的确定主要依据定位增强CT扫描图像,相对于MRI图像来说CT图像对软组织的观察不具优势,MRI能把肿瘤从周边软组织和血管中区别出来,能较好地区分肿瘤与受侵临近组织的交界面。因此,为了互补CT和MRI在影像学上各自的优缺点,有学者提倡运用CT和MRI图像融合技术来确定肿瘤靶区和正常组织器官,其对肿瘤放疗靶区范围、正常组织及危险器官轮廓的确定具有重要的临床意义。关于胰腺癌转移淋巴结的界定争议也较大,CT具有较高的密度分辨力,能发现淋巴结增大、增多、融合、中心坏死、边界模糊等表现,因而广泛运用于转移淋巴结的诊断。测量淋巴结的大小是目前普遍认同的方法,最大短轴直径≥10mm是采用最多的诊断标准[19],但单纯以淋巴结直径为标准,难以同时保证诊断的敏感性和特异性,若以15mm为标准,虽然CT诊断的特异性达99.2%,但敏感性却仅为23%,如果以8mm作为诊断标准,虽提高了 CT诊断的敏感性(54.6%),但特异性(86.2%)却明显下降[20]。薛华丹等[21]针对 17例胰腺肿瘤患者术前CT图像按照外形特征及淋巴结位置,共有41枚淋巴结可与病理结果对应,其中16枚(39.0%)转移阳性,短轴直径与非转移组淋巴结比较无统计意义(P=0.27)。分别以淋巴结短轴直径大于3mm、10mm及淋巴结长短轴直径比小于2为淋巴结转移阳性诊断标准,敏感性分别为93.8%、18.8%及50%,特异度分别为40%、88%及72%,阳性预测值分别为38.5%、50%及53.3%,阴性预测值分别为50%、62.9%及69.2%,准确度分别为 39%、61%及 63.4%,其结果与 Roche等[22]报道的相似。综合文献报道转移淋巴结有如下CT特征:①横轴面最大短轴径≥10mm;②蚕蚀状、囊状、边缘欠清晰;③部分或全部融合或呈串珠状排列,对血管产生压迫和肿块状增大;④密度较低、周边高密度中心低密度;⑤易出现坏死、增强扫描可均匀可不均匀。目前CT影像还难以发现正常大小淋巴结中存在的转移病灶,这也是CT的不足之处。
1.1.2 PET-CT功能成像对胰腺癌GTV确定的影响 定位CT只能反映组织解剖信息,而PET/CT集解剖影像与生物功能成像于一体,在胰腺癌诊断和精确放疗中扮演越来越重要的角色。有文献报道,PET/CT图像融合运用于放疗计划时可以降低不同放疗医师确定GTV的差异,使靶区确定更加精确。另外,对CT不能发现的淋巴结转移或远处转移PET/CT具有重要的补救诊断功能,从而避免GTV的漏照。Topkan等[23]对胰腺癌靶区确定的研究表明,采用PET/CT融合图像勾画GTV体积较CT图像增加 29.7%,PET/CT-GTV大于 CT-GTV(104.5 ±32.6cm3vs 92.5 ±32.3 cm3,P=0.009)。而吕晓彦等[24]对13例晚期胰腺癌患者采用PET/CT检查并定位,分别勾画CT-GTV和PET/CT-GTV,结果13例患者的CT-GTV和PET/CT-GTV均不同,其中5例患者PET/CT-GTV较CT-GTV平均减少10.9cm3(25.7%),CT-GTV 平均为 42.4cm3,PET/CT-GTV平均为31.5cm3(P=0.0045);另8例患者PET/CT-GTV较CT-GTV 平均增加27.4cm3(45.3%),CT-GTV平均为 60.4cm3,PET/CT-GTV平均为87.8cm3(P=0.0000)。关于 PET/CT 应用于非小细胞肺癌、食管癌、淋巴瘤靶区确定的报道越来越多,这些研究成果也得到了国际原子能机构的认可,同时鼓励将PET/CT运用到其他类型肿瘤放疗靶区的研究[25]。PET/CT运用于胰腺癌的靶区确定,最大的意义在于补充CT图像无法发现的癌组织侵犯及淋巴结转移灶。
1.2 靶区勾画者主观差异性对GTV勾画的影响
靶区勾画在实际临床操作过程中,受诸多人为因素影响,而GTV的勾画在不同放疗医师之间差异最大[26]。Yamazaki等[27]对 2 例拟行放疗的胰头体癌患者的CT图像传输到8个治疗计划系统,分别由不同勾画者在不同设备上独立勾画GTV,结果胰头病灶与胰体病灶的平均体积分别为34.8cm3(13.5~122cm3)和 73.4cm3(46.3~152cm3),GTVmax∶GTVmin=9∶3。不同学科医师之间对GTV靶区勾画是否存在差异性,莎莎等[28]对放疗科医生与影像科医生勾画靶区的结果进行差异性分析,结果影像科医生勾画的GTV较放疗科医生小,影像科医生勾画GTV的精度及准确性较放疗科医生高(P<0.05或P<0.01)。因此,总括目前的相关文献报道,对控制或减小GTV勾画差异性建议如下:①不断提高靶区勾画者影像学知识及诊断技能水平;②引进更先进的影像学检查设备和手段,提高影响诊断依据的准确性;③多模态影像图像融合技术在放疗中的应用;④必要时采用多名医生共同参与靶区勾画。
2 临床靶区的勾画
根据ICRU 62号报告临床靶区(clinical target volume,CTV)是一个临床解剖概念,为GTV加一定的外扩范围以包括临床上可疑的但未被证实的累及结构。由于尚未找到一种科学、合理、可靠的研究方法,目前国内外对胰腺癌CTV的实际侵犯范围还没有相关文献报道,所以不同地区、不同国家、不同医学中心之间对胰腺癌CTV的勾画带有一定的盲目性和范围不一致性,甚至很多放疗中心直接在GTV的基础上外加一定边界得到PTV的范围而回避了CTV的勾画。上文提到Arvold[18]等的研究在对数据进行线性回归分析得出病理学肿瘤大小的推算方程的同时,通过进一步数据转换和统计学处理,认为CTV的外扩边界:CTV边界=19mm-1/8 CT大小(mm);CTV边界 =19mm-1/20EUS大小(mm)。Arvold的研究认为CTV的外扩范围与肿瘤大小有关,但是对CTV范围与胰腺癌不同病理类型、不同分化程度是否存在差异性并未做分层分析,且CTV外扩边界公式经过多次数据迭加推算得到,其可信度值得进一步研究证实。
3 计划靶区外扩范围
根据ICRU 62号报告计划靶区(planning target volume,PTV)定义为CTV外放一定边界以包括由于摆位误差和内靶体积(internal target volunme,ITV)等因素引起的CTV位置相对射野的变化。其中ITV是影响PTV的主要因素。PTV外扩范围的确定能减少正常胰腺组织、胃、十二指肠重叠照射的体积,为进一步提高靶区照射剂量提供条件,同时能有效降低胃、十二指肠放疗后不良反应事件发生的概率。随着现代放疗设备、定位、摆位技术的不断完善,摆位误差得到很好的控制,基本接近临床可以接受的范围。但胰腺癌ITV受呼吸运动、心脏大血管搏动、胃肠蠕动等诸多因素的影响,国内外对胰腺癌ITV的研究报道文献较少。归纳总结近年对胰腺器官运动(ITV)的研究成果如表1。
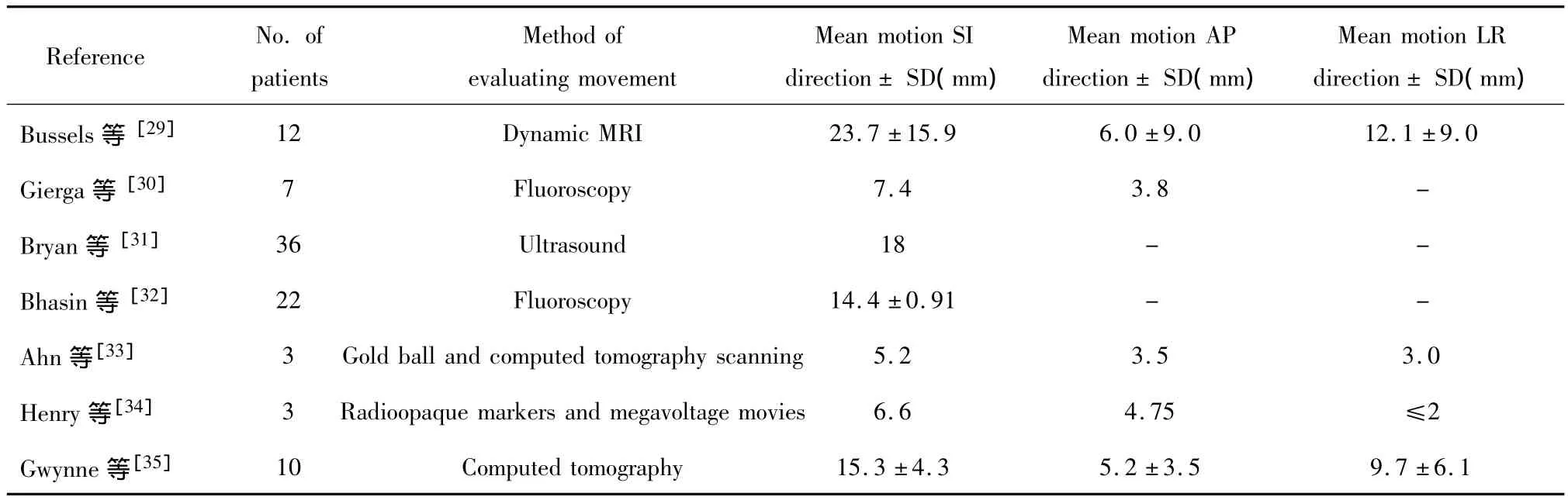
表1 不同医学影像学技术对胰腺癌ITV的测量结果Table 1.The measured results of internal target volume(ITV)of pancreatic cancer use different medical imaging technology
由于不同个体胰腺ITV受肿瘤部位、年龄、性别、体型、肺功能等多种因素的影响,因此Gwynne[35]等人的研究表明胰腺癌患者在放射治疗计划之前均应行ITV测量,再结合本单位制定的摆位误差标准,以制定一个相对合理且个体化的PTV外放边界标准。随着4D-CT在放射治疗计划定位技术中的逐步应用,实现个体化确定PTV的外扩范围将成为可能。
4 展望
以CT-MRI、CT-PET为代表的多模态影像及其图像融合技术的临床应用,使胰腺癌靶区范围的确定更为精确,但传统CT/MRI成像技术提供的胰腺肿瘤解剖学靶区仍然是放疗计划设计的基础。以PET/CT为基础的分子功能影像技术为胰腺癌患者提供了可靠的肿瘤分期依据,弥补了CT/MRI图像无法发现的癌组织侵犯及淋巴结转移灶,一定程度上避免了GTV的漏照。胰腺癌临床靶区CTV是目前最受争议的问题,不同的病理类型、分化程度、肿瘤大小与CTV是怎样的关系还有待临床实验证实。PTV虽然有不少文献报道,但动态MRI、超声、X线透视、CT/4D-CT对胰腺癌ITV的测量结果差异较大,随着4D-CT定位、电子射野影像装置(EPID)、图像引导下放射治疗系统(IGRT)在肿瘤放射治疗中的应用,个体化的PTV外扩将成为放射治疗的新方向。而随着功能影像学的兴起,如核磁共振波普(MR spectroscopy,MRS)、PET/CT、PET/MRI的应用,胰腺癌靶区勾画已进入生物靶区(biological target volume,BTV)时代,实现个体化的生物适形调强精确放疗必将成为未来研究的热点。
[1] Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009[J].CA Cancer J Clin ,2009,59(2):225-249.
[2] Stojadinovic A,Brooks A,Hoos A,et al.An evidence-based approach to the surgical management of resectable pancreatic adenocarcinoma[J].J Am Coll Surg,2003,196(6):954-964.
[3] Griffin JF,Smalley SR,Jewell W,et al.Patterns of failure after curative resection of pancreatic carcinoma[J].Cancer ,1990,66(1):56-61.
[4] Hattangadi J,Hong TS,Yeap BY,et al.Results and patterns of failure in patients treated with adjuvant combined chemoradiation therapy for resected pancreatic adenocarcinoma[J].Cancer ,2009,115(16):3640-3650.
[5] Van den Broeck A,Sergeant G,Ectors N,et al.Patterns of recurrence after curative resection of pancreatic ductal adenocarcinoma[J].Eur J Surg Oncol,2009,35(6):600-604.
[6] Ben-Josef E,Shields AF,Vaishampayan U,et al.Intensitymodulated radiotherapy(IMRT)and concurrent capecitabine for pancreatic cancer[J].Int J Radiat Oncol Biol Phys ,2004,59(2):454-459.
[7] Okusaka T,Ito Y,Ueno H,et al.Phase II study of radiotherapy combined with gemcitabine for locally advanced pancreatic cancer[J].Br J Cancer,2004,91(3):673-677.
[8] Shinchi H,Takao S,Noma H,et al.Length and quality of survival after external-beam radiotherapy with concurrent continuous 5-fluorouracil infusion for locally unresectable pancreatic cancer[J].Int J Radiat Oncol Biol Phys,2002,53(1):146-150.
[9] Crane CH,Wolff RA,Abbruzzese JL,et al.Combining gemcitabine with radiation in pancreatic cancer:understanding important variables influencing the therapeutic index[J].Semin Oncol,2001,28(1):25-33.
[10]夏廷毅,孙庆选,于 涌,等.体部γ刀治疗52例胰腺癌的疗效分析[J].中华肝胆外科杂志,2006,12(2):86-88.
[11] Ander T,Balosso J,Louvet C,et al.Combined radiation therapy and chemotherapy as palliative treatment for resected pancreatic adenocarcinoma:result of feasibility study[J].Int J Radiot Oncol Biol Phys,2000,46(4):903-911.
[12]吴伟章,李宏奇,王颖杰,等.胰腺癌伽玛刀和加速器治疗计划剂量学比较[J].中国医学物理学杂志,2010,27(4):1984-1987.
[13]杨 醅,倪之玺.螺旋CT在胰腺癌检查中的价值[J].医学影像学杂志,2003,13(6):377-379.
[14]杨 晔,贾红云,温大勇.多层螺旋CT双期扫描对胰腺癌的诊断价值及术前评估[J].宁夏医学杂志,2007,29(5):396-398.
[15]李 丽,肖云龙,简 吴.螺旋CT双期扫描在胰腺癌的诊断价值分析[J].井冈山医专学报,2005,12(3):10-11.
[16]牛佳牧,初京捷.螺旋CT在胰腺癌诊断中的应用[J].北京大学学报(自然科学版),2004,5(5):446-447.
[17]吴 江,朱 虹,王中秋,等.胰腺癌CT表现与手术病理及D2-40表达的相关性研究[J].医学影像学杂志,2012,22(1):97-105.
[18] Arvold ND,Niemierko A,Mamon HJ,et al.Pancreatic cancer tumor size on CT scan versus pathologic specimen:implications for radiation treatment planning [J].Int J Radiat Oncol Biol Phys,2011,80(5):1383-1390.
[19] Dorfm an RE,Alpern MB,Gross BH,et al.Upper abdominal lymph nodes:criteria for normal size with CT [J].Radiology,1991,180(2):319-322.
[20] Ishikawa O,Ohigashi H,Sasaki Y,et al.Practical grouping of positive lymph nodes in pancreatic head cancer treated by an extended pancreatectomy[J].Surgery,1997,121(3):244-249.
[21]薛华丹,刘 炜,金征宇,等.多层螺旋CT对胰腺癌转移淋巴结的诊断能力初步分析[J].医学影像学杂志,2008,18(12):1399-1402.
[22] Roche CJ,Hughes ML,Garvey CJ,et al.CT and pathologic assessment of prospective nodal staging in patients with ductal adenocarcinoma of the head of the pancreas[J].Am Journal Roen,2003,180(3):475-480.
[23] Topkan E,Yavuz AA,Aydin M,et al.Comparison of CT and PET-CT based planning of radiation therapy in locally advanced pancreatic carcinoma[J].J Exp Clin Cancer Res,2008,23(27):41-47.
[24]吕晓彦,汪延明,田 军,等.PEC-CT在三维适形放射治疗晚期胰腺癌中的作用[J].现代肿瘤学杂志,2011,19(8):1610-1614.
[25] MacManus M,Nestle U,Rosenzweig KE,et al.Use of PET and PET/CT for radiation therapy planning:IAEA expert report 2006-2007 [J].Radiother Oncol,2009,91(1):85-94.
[26] Grills IS,Yah D,Black QC,et al.Clinical implications of defining the gross tumor volume with combination of CT and 18FDG-positron emission tomography in non-small-cell-lung cancer[J].Int J Radiat Oncol Biol Phys,2007,67(3):709-719.
[27] Yamazaki H,Nishiyama K,Tanaka E,et al.Dummy run for a phaseⅡmulti-institute trial of chemoradiotherapy for unresectable pancreatic cancer:inter-observer variance in contour delineation[J].Anticancer Res,2007,27(4C):2965-2971.
[28]莎 莎,赵 臻,茅卫东,等.放射治疗中不同学科医生勾画靶区的差异性分析[J].实用临床医药杂志,2011,15(24):60-62.
[29] Bussels B,Goethals L,Feron M,et al.Respiration-induced movement of the upper abdominal organs:a pitfall for the three dimensional conformal radiation treatment of pancreatic cancer[J].Radiother Oncol,2003,68(1):69-74.
[30] Gierga DP,Chen GT,Kung JH,et al.Quantification of respiration induced abdominal tumour motion and its impact on IMRT dose distributions[J].Int J Radiat Oncol Biol Phys ,2004,58(5):1584-1595.
[31] Bryan PJ,Custar S,Haaga JR,et al.Respiratory movement of the pancreas:an ultrasonic study[J].J Ultrasound Med,1984,3(2):317-320.
[32] Bhasin DK,Rana SS,Jahagirdar S,et al.Does the pancreas move with respiration?[J].J Gastroenterol Hepatol ,2006,21(9):1424-1427.
[33] Ahn YC,Shimizu S,Shirato H,et al.Application of real-time tumour tracking and gated radiotherapy system for unresectable pancreatic cancer[J].Yonsei Med J ,2004,45(3):584-590.
[34] Henry A,Ryder W,Moore C,et al.Chemoradiotherapy for locally advanced pancreatic cancer:a radiotherapy dose escalation and organ motion study[J].Clin Oncol,2008,20(7):541-547.
[35] Gwynne S,wills L,Joseph G,et al.Respiratory movement of upper abdominal organs and its effect on radiotherapy planning in pancreatic cancer[J].Clin Oncol,2009,21(9):713-719.
