喜树碱对HaCaT细胞低氧诱导因子1α表达的影响
2015-12-01张梁宇王翔陆亚琪朱晓杨陈扬
张梁宇 王翔 陆亚琪 朱晓杨 陈扬
喜树碱对HaCaT细胞低氧诱导因子1α表达的影响
张梁宇 王翔 陆亚琪 朱晓杨 陈扬
目的 观察喜树碱对低氧(2%O2)培养下HaCaT细胞低氧诱导因子1α(HIF-1α)表达的影响,探讨外用喜树碱治疗银屑病可能的作用机制。方法 将HaCaT细胞分为实验组和溶媒组(对照组),实验组为喜树碱+DMEM培养液,终浓度分别为12.5、25、50、100、200 nmol/L;溶媒组为含二甲基亚砜(DMSO)的DMEM培养液。不同浓度的喜树碱作用于HaCaT细胞12、24、48、72 h,CCK8法检测细胞增殖;用以上浓度处理低氧诱导12 h的HaCaT细胞,Western印迹检测细胞HIF-1α蛋白的表达。将HaCaT细胞分为常氧组和低氧组,每组内再分喜树碱干预组(100 nmol/L)和非干预组(溶媒对照组),培养12 h后实时荧光定量PCR检测HIF-1α mRNA的相对表达。统计分析采用SPSS16.0软件进行Levene′s test、单因素方差分析、Dunnett-t检验和析因分析。结果 不同浓度喜树碱作用12、24、48、72 h后对HaCaT细胞的增殖有抑制作用,呈浓度和时间依赖关系;200 nmol/L喜树碱作用12 h,100、200 nmol/L喜树碱作用24 h细胞增殖抑制率分别为(17.66±6.46)%、(33.11±4.63)%、(56.31± 1.69)%,与同时段溶媒对照组间差异有统计学意义(均P< 0.05)。低氧诱导 12 h,25、50、100、200 nmol/L喜树碱处理后 HIF-1α蛋白表达分别为0.348±0.065、0.261±0.112、0.115±0.043、0.045±0.024,与溶媒组(1.445±0.329)比较,差异有统计学意义(均P<0.05)。喜树碱干预(100 nmol/L)与非干预的HIF-1α mRNA表达(△Ct值)分别为:常氧组-5.575±0.29、-5.451±0.21;低氧组-6.543±0.57、-6.203±0.31;低氧较常氧条件下HaCaT细胞HIF-1α mRNA的表达下调,差异有统计学意义(F=29.856,P<0.05);喜树碱干预和非干预组间HaCaT细胞HIF-1α mRNA的表达在常氧和低氧条件下差异无统计学意义(F=1.667,P>0.05)。结论 100 nmol/L喜树碱可抑制HaCaT细胞HIF-1α蛋白表达,对HIF-1α mRNA的表达水平无明显影响。
银屑病;喜树碱;缺氧诱导因子1;细胞低氧;HaCaT细胞
喜树碱是从我国特有的山茱萸珙桐科植物喜树树皮、树叶、树枝及果实中提取的一种生物碱,可靶向选择性抑制DNA拓扑异构酶I(topoisomerase,Topo I),阻碍DNA链的闭合,导致细胞DNA单链断裂、细胞死亡[1]。研究表明,喜树碱可抑制人HaCaT细胞端粒酶活性,抑制其增殖、诱导凋亡[2],并在低氧模拟下能显著抑制HeLa和HEK293细胞系低氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)的表达[3]。本研究旨在观察喜树碱对低氧诱导HaCaT细胞HIF-1α表达的影响,探讨外用喜树碱治疗银屑病的可能作用机制。
资料与方法
一、材料及主要试剂
喜树碱(含量>95%)为日本东京化成工业公司产品,4℃保存。HaCaT细胞系来源于第二军医大学长海医院中心实验室。二甲基亚砜(DMSO,美国Sigma-Aldrich公司),胰酶(以色列Bioind公司)、DMEM培养基(美国Coring公司),胎牛血清(德国PAN-Biotech GmbH公司),CCK8试剂盒(日本同仁化学公司),兔抗人HIF-1α单克隆抗体(美国Abcam公司)。PCR引物由上海生工生物工程技术服务有限公司合成。
二、方法
1.细胞培养及低氧处理:HaCaT细胞用含10%FBS的DMEM培养基,在37℃、5%CO2的孵箱中培养,取对数生长期的细胞用于各项实验。预先设定低氧培养箱气体浓度为 2%O2、5%CO2、93%N2;氧浓度稳定为2%时,迅速将HaCaT细胞放入培养箱,待氧浓度重新稳定于2%后,培养12 h。
2.药物处理及分组:喜树碱以DMSO溶解后,-20℃避光保存,喜树碱储备浓度为5 g/L。使用时用DMEM培养液稀释成工作浓度,DMSO的终浓度≤0.1%。将HaCaT细胞分为实验组和溶媒组(对照组),实验组加喜树碱 +含 10%FBS的DMEM培养液,即喜树碱的终浓度分别为12.5、25、50、100、200 nmol/L;溶媒组为含 DMSO 的 DMEM 培养液(体积比为0.02∶100)。
3.CCK8检测细胞增殖抑制率:将对数生长期的HaCaT细胞(1×104/ml)接种于96孔板,每孔100 μl在 37 ℃、5%CO2的孵育箱中培养 24 h;去上清液,实验组每孔加入含一定浓度(12.5、25、50、100、200 nmol/L)喜树碱的 DMEM 培养基 100 μl,每一浓度设6个复孔,对照组加入含0.02 μl DMSO的DMEM培养液100 μl,空白组不加细胞,只加培养基。分别培养 12、24、48、72 h 后,每孔加入含 10 μl CCK8 溶液的无血清培养基 100 μl,37 ℃、5%CO2下孵育1 h,在酶标仪450 nm波长下测量各孔吸光值,细胞增殖抑制率=[1-(加药组各浓度平均吸光度值-空白组平均吸光度值)/(对照组平均吸收值-空白组平均吸光度值)]×100%。
4.Western印迹检测HIF-1α蛋白的表达:将对数生长期的HaCaT细胞(2×105/ml)接种于6孔板中,每孔2 ml,24 h后,弃上清液,实验组加入含有不同浓度(12.5、25、50、100、200 nmol/L)的喜树碱2 ml,对照组以等体积溶媒代替药物,同时放入低氧(2%O2)诱导箱中分别诱导12 h后,收集各组细胞,提取总蛋白。用BCA法定量试剂盒检测蛋白浓度:上样200 μg蛋白,10%SDS-PAGE电泳,转膜,5%的脱脂奶粉封闭2 h,加入兔抗人HIF-1α单克隆抗体(1∶1 000),4℃孵育过夜,TBST漂洗 3次,加入辣根过氧化物酶标记的二抗(1∶2 000)室温下结合2 h,洗膜5次后显色,凝胶成像仪显影。
5.实时定量RT-PCR检测HIF-1α mRNA的表达:实验分为常氧组和低氧组,每组内再分喜树碱干预组(100 nmol/L)和非干预组(溶媒对照组),处理时间均为12 h。收集各组细胞,采用Trizol一步法,常规方法提取RNA,按RT-PCR反转录试剂盒说明书要求进行反转录并建立PCR反应体系。各组均取1 μl cDNA作为PCR反应模板,加入SYBR Premix Ex TaqTM Ⅱ(2×)10 μl及上、下游引物(浓度 5 μmol/L)各 1 μl,最后加无 DNsae-RNsae 水至总体积20 μl。PCR 反应条件:95℃预变性30 s,95℃变性15 s,60℃退火15 s,72℃延伸15 s,共 40个循环,于每个循环延伸段采集荧光信号。以β肌动蛋白为内参照,计算目的基因的相对定量△Ct及依此进行统计学分析。引物序列:HIF-1α上游引物5′-CCAGTTACGTTCCTTCGATCAGT-3′,下游引物 5′-TTTGAGGACTTGCGCTTTCA-3′。β肌动蛋白上游引物 5′-AGCCTCGCCTTTGCCGATCC-3′,下游引物5′-ACCATCACGCCCTGGTGCCT-3′。
6.统计学处理:实验重复3次,取均数。用SPSS16.0统计软件分析。计量资料以±s表示,用Levene检验方差齐性,方差不齐,进行对数转换;采用单因素方差分析进行组间比较。组内各实验组与溶媒组比较采用Dunnett-t检验。HIF-1α mRNA的表达采用析因设计的方差分析;P<0.05为差异有统计学意义。
结 果
一、喜树碱对HaCaT细胞增殖抑制作用
与溶媒组比较,12.5、25、50、100、200 nmol/L 喜树碱作用 12、24、48、72 h对 HaCaT 细胞均有抑制作用,且与时间、浓度呈依赖关系。随着药物浓度的增加和作用时间的延长,喜树碱对HaCaT细胞的生长抑制率逐渐增高,见表1。
与溶媒组相比,200 nmol/L喜树碱作用12 h后就开始对HaCaT细胞的增殖有明显的抑制作用,一直到72 h该抑制作用仍很明显(P<0.05);100 nmol/L喜树碱作用24 h后开始产生明显的抑制作用,并且持续到72 h时,抑制作用仍然明显(P< 0.05);50 nmol/L 喜树碱作用 48、72 h时对HaCaT细胞的增殖均有明显的抑制作用(P<0.05);25 nmol/L喜树碱作用72 h后才产生明显的抑制作用,差异有统计学意义(均P<0.05)。喜树碱处理HaCaT细胞 24、48、72 h的半数抑制浓度(IC50)分别是 125.58、41.91、23.95 nmol/L。
二、喜树碱对低氧诱导HaCaT细胞HIF-1α蛋白表达影响
表1 不同浓度喜树碱在不同时间对HaCaT细胞增殖抑制率(%,±s)
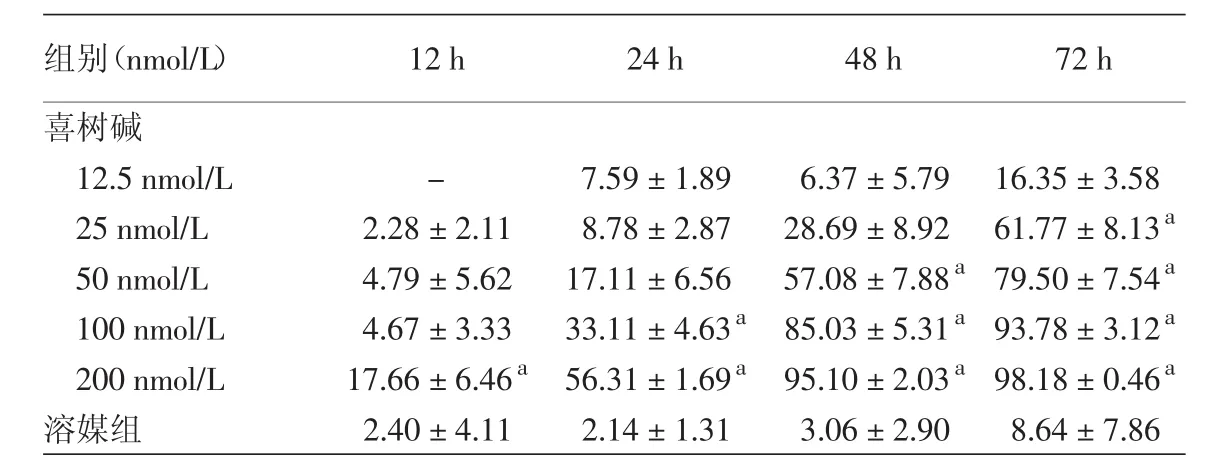
表1 不同浓度喜树碱在不同时间对HaCaT细胞增殖抑制率(%,±s)
注:n=3。a:与同时段溶媒组比较,P<0.05
组别(nmol/L) 12 h 24 h 48 h 72 h喜树碱12.5 nmol/L - 7.59±1.89 6.37±5.79 16.35±3.58 25 nmol/L 2.28±2.11 8.78±2.87 28.69±8.92 61.77±8.13a 50 nmol/L 4.79±5.62 17.11±6.56 57.08±7.88a79.50±7.54a 100 nmol/L 4.67±3.33 33.11±4.63a 85.03±5.31a93.78±3.12a 200 nmol/L 17.66±6.46a 56.31±1.69a 95.10±2.03a98.18±0.46a溶媒组 2.40±4.11 2.14±1.31 3.06±2.90 8.64±7.86
如图 1所示,不同浓度喜树碱(12.5、25、50、100、200 nmol/L)作用于低氧诱导(2%O2)的 HaCaT细胞12 h,HIF-1α蛋白的表达随喜树碱浓度的升高而下调,并在100、200 nmol/L喜树碱浓度下被明显抑制。经单因素方差分析,各浓度喜树碱对低氧诱导HaCaT细胞HIF-1α蛋白表达有差异(数据经对数转换后Levene检验显示方差齐性,P=0.126;F=31.527,P< 0.05)。组间多重比较显示,25、50、100、200 nmol/L喜树碱处理后HIF-1α表达(分别为0.348 ± 0.065、0.261 ± 0.112、0.115 ± 0.043、0.045 ±0.024)与溶媒组(1.445±0.329)比较,差异有统计学意义(均P<0.05)。
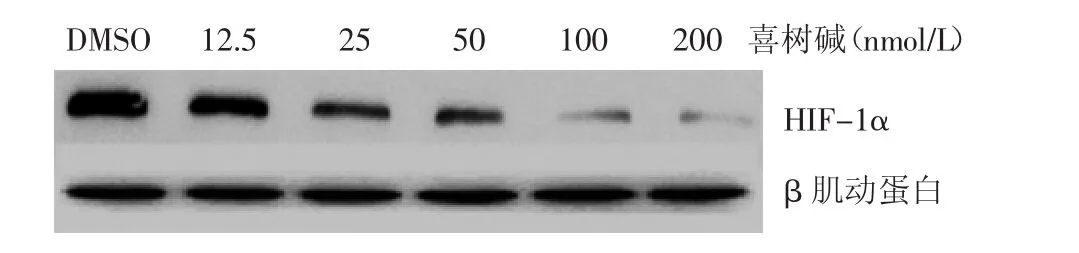
图1 不同浓度喜树碱对低氧(2%O2)诱导12 h HaCaT细胞HIF-1α蛋白的表达
三、喜树碱对低氧诱导HaCaT细胞HIF-1α mRNA表达影响
100 nmol/L喜树碱对常氧和低氧条件下HaCaT细胞作用12 h后HIF-1α mRNA的表达水平与相应的对照组比较,差异无统计学意义(F=1.667,P>0.05)。但低氧组与常氧组比较HIF-1α mRNA的表达量相对降低,差异有统计学意义(F=29.856,P<0.05)。见表 2。
讨 论
HIF-1是一种氧依赖转录活因子,是细胞在缺氧条件下产生的转录活性核蛋白,由α亚基和β亚基组成异源二聚体,其活性形式为HIF-1α。寻常性斑块型银屑病皮损角质形成细胞过度增殖,可造成局部微环境缺氧。研究表明,银屑病皮损组织中HIF-1α的表达相对于特应性皮炎、脂溢性皮炎或正常皮肤组织均明显增加[4-5],并可调控与银屑病皮损真皮乳头层血管增生相关的多种靶基因表达,如,血管内皮生长因子、环氧合酶2、诱导型一氧化氮合成酶、基质金属蛋白酶 2[6-8]。HIF-1α与葡萄糖转运蛋白1(GLUT-1)表达呈正相关,并可能参与银屑病角质形成细胞过度增殖角化不全[9]。因此本研究以低氧诱导的HaCaT细胞为模型,观察喜树碱对HIF-1α表达的影响。
本实验中,25、50、100、200 nmol/L 喜树碱均能抑制HaCaT细胞的增殖活性,随着药物浓度升高和作用时间延长,呈浓度和时间依赖关系。200、100、50、25 nmol/L 喜树碱分别于作用 12、24、48、72 h后开始对 HaCaT 细胞的增殖有明显的抑制作用,并且持续到72 h时(P<0.05),而喜树碱作用 HaCaT 细胞 24、48、72 h 的半数抑制浓度(IC50)分别是 125.58、41.91、23.95 nmol/L。用 12.5、25、50、100、200 nmol/L 喜树碱处理低氧诱导12 h的HaCaT细胞,随着喜树碱浓度增加,对HIF-1α蛋白表达抑制作用也增强(图1),除12.5 nmol/L喜树碱外,其余4个浓度喜树碱对细胞HIF-1α蛋白表达与对照组间比较,差异有统计学意义(均P<0.05)。以上结果均提示低浓度喜树碱可抑制HaCaT细胞增殖,抑制HIF-1α蛋白表达的药物浓度较增殖抑制浓度低。
表2 喜树碱对不同氧压条件处理的HaCaT细胞HIF-1α mRNA相对表达量的影响(±s)
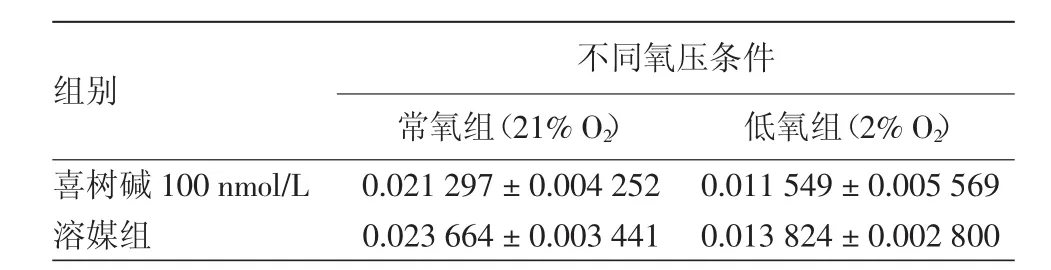
表2 喜树碱对不同氧压条件处理的HaCaT细胞HIF-1α mRNA相对表达量的影响(±s)
注:n=3
组别 不同氧压条件常氧组(21%O2) 低氧组(2%O2)喜树碱100 nmol/L 0.021 297±0.004 252 0.011 549±0.005 569溶媒组 0.023 664±0.003 441 0.013 824±0.002 800
本实验低氧诱导12 h的HaCaT细胞HIF-1α mRNA表达较常氧组降低(P<0.05),该现象可能与细胞急性缺氧有关,尚需对多个时间点进一步观察。Bosco等[10]观察到低氧诱导 16 h,人外周血单核细胞HIF-1α mRNA表达下降,认为可能存在负反馈调节机制。100 nmol/L浓度喜树碱作用低氧诱导的HaCaT细胞12h,细胞中HIF-1α蛋白表达被明显抑制,分别观察同一浓度和时间点喜树碱对常氧或低氧状态下HaCaT细胞HIF-1αmRNA表达的影响,发现HIF-1α mRNA在喜树碱干预前后的表达差异无统计学意义(P> 0.05)。Bertozzi等[3]以 0.5 μmol/L 喜树碱作用于去铁胺低氧模拟下的HeLa和HEK293细胞系,两种细胞系HIF-1α蛋白水平均被明显抑制,HeLa细胞系HIF-1α mRNA表达无明显变化,进一步实验发现抑制miR-17-5p、miR-155表达后,能影响喜树碱对HIF-1α蛋白表达的抑制,提示喜树碱是在转录后水平调节HIF-1α的表达。本研究结果表明,喜树碱对HaCaT细胞HIF-1α mRNA表达的调控也可能是转录后水平。
临床上,0.03%喜树碱软膏被推荐治疗慢性斑块型银屑病,疗效与0.02%丙酸氯倍他索霜相似[11],其药理机制尚不清楚。文献[12]报道咪喹莫特诱导的银屑病鼠模型,氯倍他索可通过抑制IL-23/IL-17A炎症反应轴对小鼠皮损有治疗作用,但喜树碱对该炎症轴无明显抑制作用,不能有效治疗小鼠银屑病样皮损表皮增殖。喜树碱有较强的细胞毒性,对HaCaT细胞HIF-1α蛋白表达有明显抑制,喜树碱对慢性斑块状银屑病的治疗作用是否与调控HIF-1α蛋白有关,有待进一步研究。
[1]谭慧心.拓扑异构酶I抑制剂研究进展[J].中国药理学通报,2009,25(4):436-441.
[2]Liu X,Lin J,Bao Y,et al.Camptothecin-mediated apoptosis and antiproliferation effect is accompanied by down-regulation of telomerase activity in HaCaT cells[J].J Dermatol Sci,2006,42(3):262-264.
[3]Bertozzi D,Marinello J,Manzo SG,et al.The natural inhibitor of DNA topoisomerase I,camptothecin,modulates HIF-1α activity by changing miR expression patterns in human cancer cells[J].Mol Cancer Ther,2014,13(1):239-248.
[4]Rosenberger C,Solovan C,Rosenberger AD,et al.Upregulation of hypoxia-inducible factors in normal and psoriatic skin[J].J Invest Dermatol,2007,127(10):2445-2452.
[5]Ioannou M,Sourli F,Mylonis I,et al.Increased HIF-1 alpha immunostaining in psoriasis compared to psoriasiform dermatitides[J].J Cutan Pathol,2009,36(12):1255-1261.
[6]Liang WC,Wu X,Peale FV,et al.Cross-species vascular endothelial growth factor(VEGF)-blocking antibodies completely inhibit the growth of human tumor xenografts and measure the contribution of stromal VEGF[J].J Biol Chem,2006,281(2):951-961.
[7]Simonetti O,Lucarini G,Goteri G,et al.VEGF is likely a key factor in the link between inflammation and angiogenesis in psoriasis:results of an immunohistochemical study[J].Int J Immunopathol Pharmacol,2006,19(4):751-760.
[8]Nofal A,Al-Makhzangy I,Attwa E,et al.Vascular endothelial growth factor in psoriasis:an indicator of disease severity and control[J].J Eur Acad Dermatol Venereol,2009,23(7):803-806.
[9]杨井,陶娟,陆捷洁,等.缺氧诱导因子1α和葡萄糖转运蛋白1在银屑病皮损中的表达[J].中华皮肤科杂志,2009,42(3):154-156.
[10]Bosco MC,Puppo M,Santangelo C,et al.Hypoxia modifies the transcriptome of primary human monocytes:modulation of novel immune-related genes and identification of CC-chemokine ligand 20 as a new hypoxia-inducible gene[J].J Immunol,2006,177(3):1941-1955.
[11]中国医师协会皮肤科医师分会中西医皮肤科亚专业委员会.中成药治疗寻常性银屑病专家共识(2014)[J].中华皮肤科杂志,2014,47(3):215-216.
[12]Sun J,Dou W,Zhao Y,et al.A comparison of the effects of topical treatment of calcipotriol,camptothecin,clobetasol and tazarotene on an imiquimod-induced psoriasis-like mouse model[J].Immunopharmacol Immunotoxicol,2014,36(1):17-24.
2014-12-17)
(本文编辑:吴晓初)
Effects of camptothecin on the expression of hypoxia-inducible factor-1α in HaCaT cells
Zhang Liangyu,Wang Xiang,Lu Yaqi,Zhu Xiaoyang,Chen Yang.Department of Dermatology,98th Hospital of PLA;98 Clinical Medical College Affiliated to Anhui Medical University,Huzhou 313000,Zhejiang,China
Chen Yang,Email:98cy@163.com
ObjectiveTo estimate the effects of camptothecin (CPT)on the expression of hypoxia-inducible factor-1α (HIF-1α)in HaCaT cells under hypoxic conditions (2%O2),and to explore the potential therapeutic mechanism of topical CPT for psoriasis.MethodsSome HaCaT cells were classified into 6 groups:5 test groups cultured in Dulbecco′s modified Eagle′s medium(DMEM)with the presence of CPT at 12.5,25,50,100 and 200 nmol/L respectively,and 1 control group cultured in DMEM with the presence of dimethyl sulfoxide(DMSO).All the 6 groups of cells were cultured under normoxic conditions for 12,24,48 or 72 hours or under hypoxic conditions for 12 hours.Cell counting kit-8 (CCK-8)assay was conducted to estimate the proliferation of HaCaT cells after the normoxic culture,and Western blot to quantify the protein expression of HIF-1α after the hypoxic culture.Some HaCaT cells were classified into a normoxia group(21%O2)and a hypoxia group(2%O2),and each group was divided into a CPT(100 nmol/L)-treated subgroup and a non-intervention subgroup(treated with the vehicle).After 12-hour culture,real-time fluorescencebased quantitative PCR was performed to measure the mRNA expression of HIF-1α.Statistical analysis was carried out by using Levene′.s test,one-way analysis of variance,Dunnett-ttest and factorial analysis with the SPSS16.0 software.ResultsAfter treatment with CPT at 12.5-200 nmol/L for 12-72 hours,the proliferation of HaCaT cells was inhibited in a concentration-and time-dependent manner.More concretely,the cell proliferation rates were inhibited by 17.66%±6.46%,33.11%±4.63%and 56.31%±1.69%respectively in HaCaT cells after 12-hour treatment with 200 nmol/L CPT as well as 24-hour treatment with 100 and 200 nmol/L CPT compared with the control group at the corresponding time points(allP<0.05).The protein expression level of HIF-1α was significantly decreased in HaCaT cells after 12-hour treatment with CPT at 12.5,25,50,100 and 200 nmol/L under hypoxic conditions compared with the control group(0.348±0.065,0.261±0.112,0.115±0.043,0.045±0.024 vs.1.445±0.329,allP<0.05).The mRNA expression level of HIF-1α(expressed as△Ct)in the CPT-treated subgroup and non-intervention subgroup was-5.575 ± 0.29 and-5.451±0.21 respectively in the normoxia group,significantly higher than that in the hypoxia group(-6.543±0.57 and-6.203±0.31 respectively,F=29.856,P<0.05),while there was no significant difference between the CPT-treated and non-intervention subgroups(F=1.667,P>0.05).ConclusionsCPT at 100 nmol/L could inhibit the expression of HIF-1α protein,but had no obvious effect on that of HIF-1α mRNA.
Psoriasis;Camptothecin;Hypoxia-inducible factor 1;Cell hypoxia;HaCaT cells
10.3760/cma.j.issn.0412-4030.2015.06.010
南京军区医学科技创新项目(12Z03);全军医学科技青年培育项目(13QNP045)
313000浙江湖州,安徽医科大学解放军九八临床学院,解放军第九八医院皮肤科
陈扬,Email:98cy@163.com
