糖尿病大鼠运动神经纤维损害的MUNE检测
2015-11-24田丽程焱张哲成刘娜朱炬
田丽,程焱△,张哲成,刘娜,朱炬
糖尿病大鼠运动神经纤维损害的MUNE检测
田丽1,程焱1△,张哲成2,刘娜2,朱炬2
目的通过运动单位数目估计(MUNE)技术对糖尿病大鼠运动神经纤维功能状况进行评价,探讨MUNE对糖尿病周围神经病(DPN)的早期诊断价值。方法链脲佐菌素诱导糖尿病大鼠模型(DM组),在造模后第4、8、12周对DM组及对照组(正常SD大鼠)进行腓肠肌MUNE及坐骨神经常规运动神经传导速度(MCV)及波幅(CMAP)检测,电镜观察坐骨神经的超微结构。结果造模后第4周,DM组腓肠肌MUNE低于对照组(275.88±87.87 vs 369.71±75.64,P<0.05),而坐骨神经MCV及CMAP较对照组差异无统计学意义;电镜观察显示DM组坐骨神经大部分神经纤维尚正常,少量轴索萎缩,神经髓鞘板层分离。第8周,与对照组相比,DM组腓肠肌MUNE降低(357.49±72.68 vs 221.26±92.41,P<0.01),而MCV、CMAP仍较对照组差异无统计学意义;电镜观察显示尚有较正常神经纤维,髓鞘局灶性板层松散、分离,轴索萎缩,轴索膜与髓鞘内层分离,出现大的间隙。第12周,DM组腓肠肌MUNE(127.87±19.80 vs 366.85±51.25)、坐骨神经MCV[(35.06±4.33)m/s vs(50.47±6.07)m/s]、CMAP[(2.91±1.37)mV vs(5.98±2.14)mV]低于对照组(P<0.01);电镜显示神经髓鞘折曲,轴索受挤压等受损严重。结论MUNE较常规运动神经传导检测易于早期发现DPN轴索功能异常。
糖尿病神经病变;运动神经元;神经传导;坐骨神经;显微镜检查,电子,透射;运动单位数目估计
近年关于糖尿病周围神经病(diabetic peripheral neuropathy,DPN)的研究多集中于DPN的发病机制,以及疼痛、麻木等感觉障碍的治疗方面,对运动神经纤维损害的关注较少。运动单位数目估计(motor unit number estimation,MUNE)检测对运动单位的评价不受神经再生补偿的影响,因此,在临床以及传统的电诊断参数正常情况下,MUNE可能发现运动神经纤维轴索的早期损害[1-2]。本研究通过电镜观察糖尿病大鼠坐骨神经超微结构的改变,以此为客观依据,探讨MUNE对糖尿病运动神经纤维损害的早期诊断价值。
1 材料与方法
1.1 材料清洁级Sprague-Dawley(SD)雄性大鼠,体质量为180~220 g,购自北京大学医学部动物中心。链脲佐菌素(美国Sigma公司),Medtronic Keypoint 4.NET肌电诱发电位仪(美敦力),HITACHI-7500透射电镜(日立)。
1.2 方法
1.2.1 糖尿病大鼠模型的建立及分组采用随机数字表法将健康雄性SD大鼠37只分为2组,对照组19只、DM组18只。链脲佐菌素以0.1 mol/L,pH 4.2的无菌柠檬酸-柠檬酸钠缓冲液配制成浓度为2%的溶液,DM组按照60 mg/kg体质量一次性腹腔注射链脲佐菌素制备糖尿病模型。给药l周后测定大鼠尾静脉血糖,血糖大于16.7 mmol/L判定为糖尿病造模成功。对照组大鼠仅给予腹腔注射等体积的柠檬酸-柠檬酸钠缓冲液。
于第4周末两组各处死1只大鼠取坐骨神经电镜观察,各取8只行右下肢神经电生理检测;为避免重复测量对实验结果造成影响,在第8周末对其进行左下肢神经电生理检测后处死,并各取1只大鼠坐骨神经电镜观察;于第12周末取各组内剩余大鼠(对照组10只,DM组9只)进行右下肢神经电生理检测,并各送检1只大鼠坐骨神经电镜观察。
1.2.2 神经电生理检测检测项目包括腓肠肌MUNE、坐骨神经常规运动传导速度(motor nerve conduction velocity,MCV)、复合肌肉动作电位(compound motor active potential,CMAP)波幅。将大鼠用10%水合氯醛350 mg/kg体质量腹腔注射麻醉后,俯卧固定于平板上。应用肌电诱发电位仪进行神经电生理检测。环境温度约22~25℃。
常规运动神经传导检测方法:采用单极针经皮插入作为刺激电极;第一刺激点阴极置于坐骨切迹,阳极旁开5 mm;第二刺激点阴极置于同侧内踝后方,阳极旁开5 mm,用方形波(5~15 mA)刺激神经。另将一对单极针电极作为记录电极,阴极插入同侧足底骨间肌,阳极插入同侧足底皮下。接地电极置于尾部皮下。分别测量潜伏期和CMAP波幅,MCV(m/s)=两刺激部位之间的距离/两刺激部位的潜伏期差。仪器设置:带通2~100 kHz,扫描速度5 ms/D,灵敏度5 mV/D,刺激脉冲时限0.2 ms。见图1A。
MUNE检测方法:刺激电极及记录电极均为单极针电极,刺激电极阴极放置于坐骨切迹,阳极旁开5 mm。记录电极阴极插入腓肠肌,阳极置于内踝后方皮下。地线置于刺激电极和记录电极之间皮下。以超强刺激诱发最大波幅M波,再以阈刺激强度获最小M波,逐渐增大刺激强度并记录10个阶梯递增的M波。肌电诱发电位仪(Keypoint 5.06)软件输出MUNE。仪器设置:带通20 Hz~10 kHz,扫描速度5 ms/D,灵敏度5 mV/D,刺激脉冲时限0.1 ms,见图1B。
Fig.1The electrophysiological test of rats图1 大鼠神经电生理检测
1.2.3 坐骨神经电镜观察标本经2.5%戊二醛固定液、1%四氧化锇后固定,上升梯度乙醇脱水,环氧丙烷过渡,Epon812环氧树脂包埋,经半薄切片定位后,超薄切片,醋酸铀及柠檬酸铅双重染色,HITACHI-7500透射电镜观察。
1.3 统计学方法采用SPSS 17.0统计软件包进行分析,计量资料用均数±标准差表示,组间比较采用2组独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 造模后第4周2组大鼠血糖、神经电生理、电镜检测结果的比较DM组大鼠血糖高于对照组(P<0.01),右侧腓肠肌MUNE明显低于对照组(P<0.05),右侧坐骨神经CMAP、MCV与对照组比较差异无统计学意义,见表1。
对照组大鼠坐骨神经轴索、髓鞘形态正常,内可见微管微丝排列有序,可见线粒体,见图2A;DM组
大鼠可见轻微损伤,大部分神经纤维尚正常,少量轴索萎缩、线粒体结构欠清晰,部分神经髓鞘局灶板层分离,见图2B、C。
Tab.1Comparison of the blood glucose and electrophysiological parameters at the 4th week of modeling between two groups表1 造模后4周大鼠血糖、神经电生理检测结果的比较(n=8,)
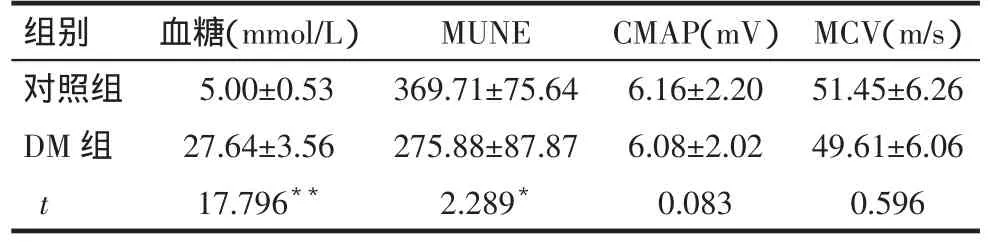
Tab.1Comparison of the blood glucose and electrophysiological parameters at the 4th week of modeling between two groups表1 造模后4周大鼠血糖、神经电生理检测结果的比较(n=8,)
*P<0.05,**P<0.01,表2、3同
组别对照组D M组t血糖(m m o l / L)5 . 0 0 ± 0 . 5 3 2 7 . 6 4 ± 3 . 5 6 1 7 . 7 9 6**M U N E 3 6 9 . 7 1 ± 7 5 . 6 4 2 7 5 . 8 8 ± 8 7 . 8 7 2 . 2 8 9*C M A P(m V)6 . 1 6 ± 2 . 2 0 6 . 0 8 ± 2 . 0 2 0 . 0 8 3 M C V(m / s)5 1 . 4 5 ± 6 . 2 6 4 9 . 6 1 ± 6 . 0 6 0 . 5 9 6
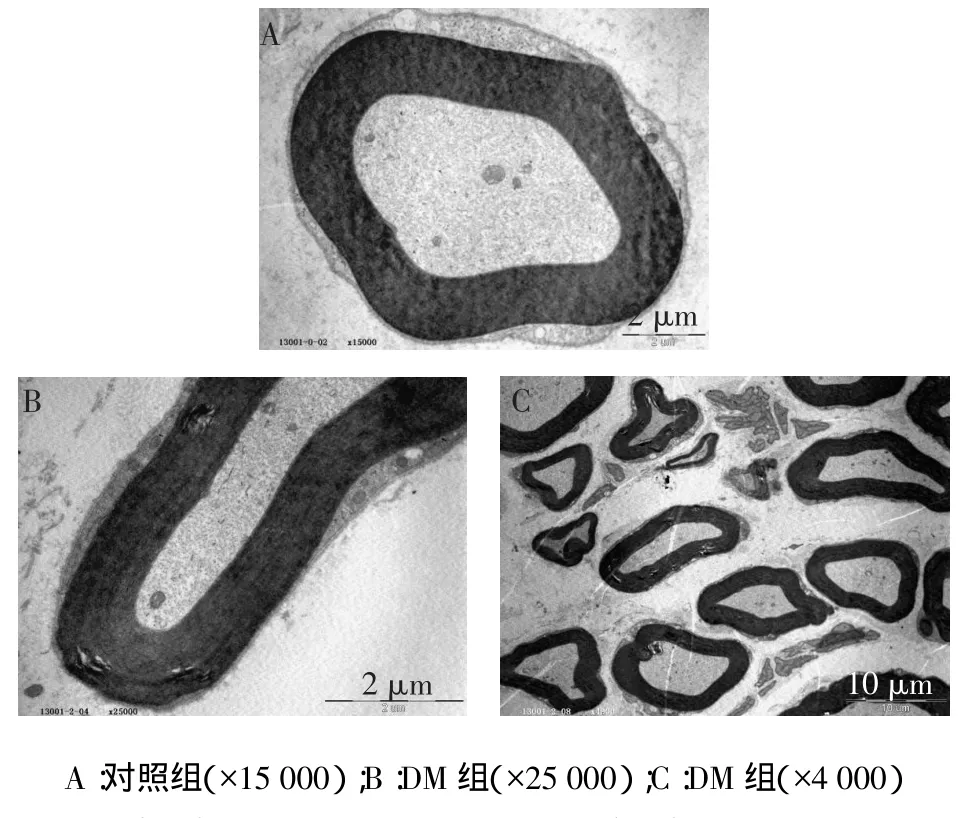
Fig.2The ultrastructure of sciatic nerve under electron microscope at 4th week of modeling图2 造模后4周坐骨神经超微结构(电镜)
2.2 造模后第8周2组大鼠血糖、神经电生理、电镜检测结果的比较DM组大鼠血糖高于对照组(P<0.01),左侧腓肠肌MUNE明显低于对照组(P<0.01),左侧坐骨神经CMAP、MCV与对照组比较差异无统计学意义,见表2。
Tab.2Comparison of the blood glucose and electrophysiological parameters at the 8th week of modeling between two groups表2 造模后8周大鼠血糖、神经电生理检测结果的比较(n=8,)

Tab.2Comparison of the blood glucose and electrophysiological parameters at the 8th week of modeling between two groups表2 造模后8周大鼠血糖、神经电生理检测结果的比较(n=8,)
组别对照组D M组t血糖(m m o l / L)5 . 0 1 ± 0 . 5 8 2 2 . 2 5 ± 4 . 1 3 1 1 . 6 9 3**M U N E 3 5 7 . 4 9 ± 7 2 . 6 8 2 2 1 . 2 6 ± 9 2 . 4 1 3 . 2 7 7**C M A P(m V)6 . 1 1 ± 1 . 8 2 5 . 6 0 ± 1 . 5 5 0 . 6 0 6 M C V(m / s)5 1 . 0 3 ± 5 . 1 1 4 6 . 1 9 ± 6 . 3 6 1 . 6 7 8
对照组大鼠坐骨神经组织结构正常,见图3A;DM组大鼠坐骨神经尚有较正常神经纤维,但存在较多髓鞘局灶性板层松散、分离,轴索萎缩,轴索膜与髓鞘内层分离,出现大的间隙。髓鞘板层分为内外两部分,外侧部分有熔融灶,亦有髓鞘完全熔融,板层结构不清,微丝微管受损,见图3B、C。
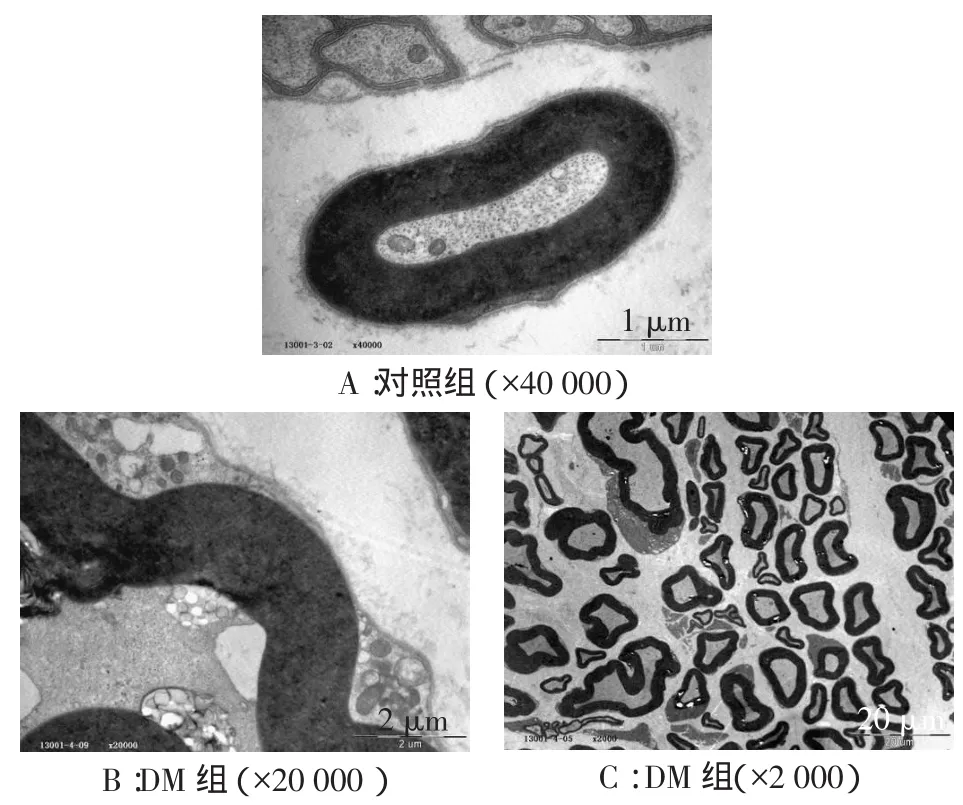
Fig.3The ultrastructure of sciatic nerve under electron microscope at 8th week of modeling图3 造模后8周坐骨神经超微结构(电镜)
2.3 造模后第12周2组大鼠神经电生理、血糖、电镜检测结果的比较DM组大鼠血糖高于对照组(P<0.01),右侧腓肠肌MUNE、坐骨神经CMAP、MCV均较对照组明显减低(P<0.01),见表3。
Tab.3Comparison of the blood glucose and electrophysiological parameters at the 12th week of modeling between two groups表3 造模后12周大鼠血糖、神经电生理检测结果的比较
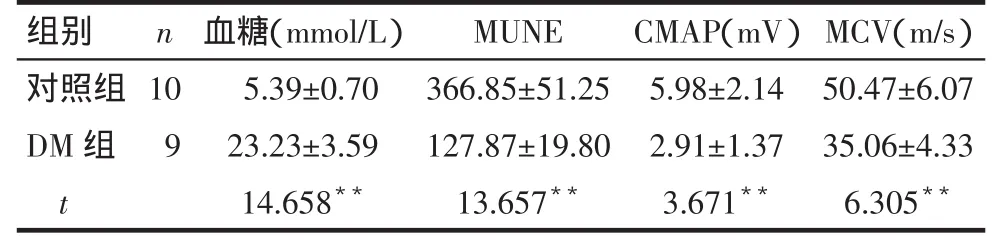
Tab.3Comparison of the blood glucose and electrophysiological parameters at the 12th week of modeling between two groups表3 造模后12周大鼠血糖、神经电生理检测结果的比较
组别对照组D M组t n 1 0 9血糖(m m o l / L)5 . 3 9 ± 0 . 7 0 2 3 . 2 3 ± 3 . 5 9 1 4 . 6 5 8**M U N E 3 6 6 . 8 5 ± 5 1 . 2 5 1 2 7 . 8 7 ± 1 9 . 8 0 1 3 . 6 5 7**C M A P(m V)5 . 9 8 ± 2 . 1 4 2 . 9 1 ± 1 . 3 7 3 . 6 7 1**M C V(m / s)5 0 . 4 7 ± 6 . 0 7 3 5 . 0 6 ± 4 . 3 3 6 . 3 0 5**
对照组大鼠坐骨神经组织结构正常,见图4A;DM组大鼠坐骨神经受损严重,直径大的神经较直径小的严重。髓鞘折曲,轴索受挤压。同一有髓神经纤维髓鞘壁厚薄不同,髓鞘板层松散,蓬松变厚,有折叠、熔融,见图4B、C。
3 讨论
DPN可累及周围神经的感觉及运动纤维,运动神经纤维的损害可以导致患者行动缓慢、步态不稳以及频繁的跌倒,并增加了足溃疡及截肢的风险[3]。MUNE是一项能早期定量发现运动单位异常的神经电生理技术[4],Paramanathan等[5]研究发现累及运动轴索变性的疾病常存在运动单位数目的减少,且出现在运动神经传导异常之前,提示MUNE可能较常规电生理更易发现运动神经轴索变性。
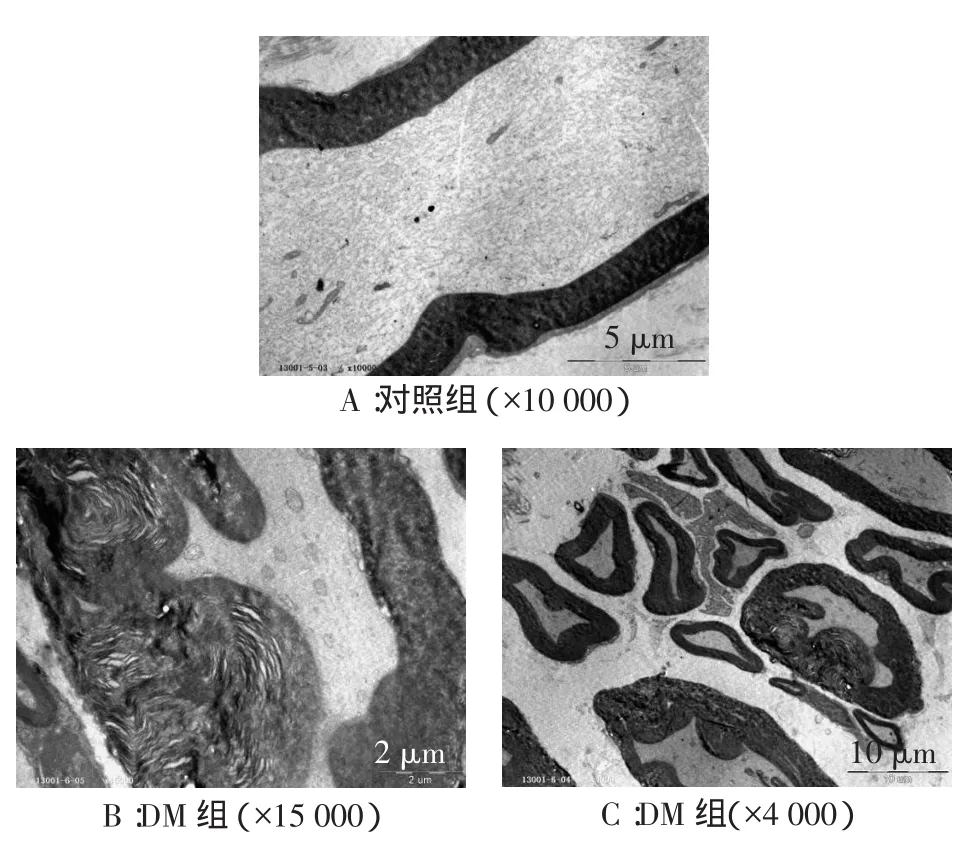
Fig.4The ultrastructure of sciatic nerve under electron microscope at 12th week of modeling图4 造模后12周坐骨神经超微结构(电镜)
传统的神经电生理检测方法(包括运动神经传导、针极肌电图等)对于评价疾病的进展程度及轻度的轴索损害敏感性不佳,这是由于侧支芽生的存在掩盖了轻度的神经损伤[6]。MCV反映的是最快神经纤维的传导速度,只有在大量神经纤维损害时才出现MCV的下降[7],因此MCV敏感度较低;CMAP波幅反映的是所测神经纤维的数量和同步兴奋的程度,运动神经轴突损害和功能障碍时,神经纤维同步化兴奋的程度降低,CMAP波幅下降。
Souayah等[1]利用环状电极对鼠下肢肌肉运动单位数目进行估计,发现高血糖后2周即可出现MUNE的下降,并观察到神经纤维损害及末端侧支芽生,提示MUNE检测可在糖尿病的早期阶段发现运动神经纤维异常,而高血糖后6周,MUNE继续下降,MCV及CMAP仍为正常,但该研究未继续观察至运动神经损害严重(MCV及CMAP下降)。本研究利用单极针电极对糖尿病大鼠腓肠肌MUNE及坐骨神经MCV及CMAP进行检测,发现高血糖后4周MUNE较对照组明显下降,且电镜观察到坐骨神经轴索、髓鞘超微结构的损害,与Souayah等[1]的研究结果一致。本研究进一步观察至第12周糖尿病大鼠坐骨神经结构严重损害时,MCV、CMAP较对照组出现下降。Albrecht等[8]报道CMAP波幅下降时,运动单位已经丢失80%~90%。本研究结果显示在第12周运动神经传导检测(MCV、CMAP)异常时,DM组大鼠MUNE较对照组下降65%,提示与常规运动神经传导检测相比,MUNE可早期发现运动神经轴索损害。
在DPN等慢性神经病变的发展过程中,轴突损害的同时伴随着侧支芽生再生,病变运动单位中的肌纤维因接受正常神经纤维的再生支配,从而残存运动单位所支配范围增加,在一定程度上弥补了轴突丧失对CMAP波幅的影响,因此DPN早期总的运动单位数目减少,但CMAP波幅可以正常[2],随着疾病的进展,由于失神经支配的速度超过侧支芽生的速度,不仅运动单位减少,也导致MCV下降、CMAP波幅减低、肌肉萎缩和肌肉无力[6]。因此一旦出现MCV、CMAP异常,往往病变已经较重。
综上,本研究发现MUNE较常规运动神经传导检测易于早期发现DPN大鼠运动轴索功能异常,为利用MUNE技术早期发现糖尿病患者周围神经病变提供了实验依据。
[1]Souayah N,Potian JG,Garcia CC,et al.Motor unit number estimate as a predictor of motor dysfunction in an animal model of type 1 diabetes[J].Am J Physiol Endocrinol Metab,2009,297(3):E602-608. doi:10.1152/ajpendo.00245.2009.
[2]Gooch CL,Doherty TJ,Chan KM,et al.Motor unit number estimation:a technology and literature review[J].Muscle Nerve,2014,50(6):884-893.doi:10.1002/mus.24442.
[3]Andersen H.Motor dysfunction in diabetes[J].Diabetes Metab Res Rev,2012,28(Suppl 1):89-92.doi:10.1002/dmrr.2257.
[4]Zheng LN,Zhang ZC,Liu N,et al.Early evaluation of electrical diagnostics of motor nerve damage in carpal tunnel syndrome[J].Tianjin Med J,2013,41(7):709-711.[郑丽娜,张哲成,刘娜,等.腕管综合征运动纤维损害的早期电诊断评价[J].天津医药,2013,41(7): 709-711].doi:10.3969/j.issn.0253-9896.2013.07.026.
[5]Paramanathan S,Tankisi H,Andersen H,et al.Axonal loss in patients with inflammatory demyelinating polyneuropathy as determined by motor unit number estimation and MUNIX[J].Clin Neurophysiol,2015,pii:S1388-2457(15)00320-X.doi:10.1016/j. clinph.2015.05.004.
[6]Ives CT,Doherty TJ.Intra-rater reliability of motor unit number estimation and quantitative motor unit analysis in subjects with amyotrophic lateral sclerosis[J].Clin Neurophysiol,2014,125(1):170-178.doi:10.1016/j.clinph.2013.04.345.
[7]Caliandro P,Stalberg E,La Torre G,et al.Sensitivity of conventional motor nerve conduction examination in detecting patchy demyelination:a simulated model[J].Clin Neurophysiol,2007,118(7): 1577-1585.
[8]Albrecht E,Kuntzer T.Number of Edb motor units estimated using an adapted multiple point stimulation method:normal values and longitudinal studies in ALS and peripheral neuropathies[J].Clin Neurophysiol,2004,115(3):557-563.
(2015-04-16收稿 2015-06-25修回)
(本文编辑 李国琪)
The detection of motor nerve injury by MUNE in an animal model of diabetes
TIAN Li1,CHENG Yan1△,ZHANG Zhecheng2,LIU Na2,ZHU Ju2
1 Department of Neurology,Tianjin Medical University General Hospital,Tianjin 300052,China;2 Department of Neurology,Tianjin Third Central Hospital△
ObjectiveTo investigate motor nerve function status in rats with diabetes mellitus by motor unit number estimation(MUNE),and discuss it′s early diagnostic value in diabetic peripheral neuropathy(DPN).MethodsDiabetic rat model(DM group)was induced by streptozotocin.The MUNE of gastrocnemius muscle and motor nerve conduction(MCV,CMAP)of the sciatic nerve were measured at the 4th,8th and 12thweek after onset of hyperglycemia in the DM group and the control group(normal SD rats).The ultrastructure of sciatic nerve was observed by electron microscope.ResultsAt the 4th week,MUNE of gastrocnemius muscle was significantly decreased in DM group compared to that of the control group(275.88±87.87 vs 369.71±75.64,P<0.05).There were no significant differences in MCV and CMAP of sciatic nerve between two groups.The electron microscopy observation showed that most nerve fibers were normal;a small amount of axonal atrophy,and myelin lamellar structure was separated in DM group.At the 8th week,compared with the control group,MUNE were reduced in gastrocnemius muscle in DM group(357.49±72.68 vs 221.26±92.41,P<0.01).There were no significant differences in MCV and CMAP of the sciatic nerve between DM group and control group.The electron microscope observation showed that part of nerve fibers were normal,the myelin focal plate layer was loose and separated,axonal atrophy,the axonal membrane and myelin sheath inner layer was separated with big gap.At the 12th week,MUNE of gastrocnemius muscle(127.87±19.80 vs 366.85±51.25),sciatic nerve MCV[(35.06±4.43)m/s vs(50.47±6.07)m/s]and CMAP[(2.91±1.37)mV vs(5.98±2.14)mV]were significantly decreased in DM group than those of control group(P<0.01).The electron microscopy observation showed severely damaged myelin flex and axonal squeeze.ConclusionMUNE is much earlier in detecting early motor nerve dysfunction in DM than conventional motor nerve conduction test.
diabetic neuropathies;motor neurons;neural conduction;sciatic nerve;microscopy,electron,transmission;motor unit number estimation
R741.044
A
10.11958/j.issn.0253-9896.2015.12.012
天津市卫生局科技基金资助项目(2012KY04);天津市卫生行业重点攻关项目(14KJ110)
1天津医科大学总医院神经内科(邮编300052);2天津市第三中心医院神经内科
田丽(1982),女,主治医师,博士在读,主要从事神经电生理研究
△通讯作者E-mail:cylfl@sohu.com
