肝细胞癌组织HBXIP和GRIM-19表达及意义的探讨
2015-11-24孙纪三张建军高伟杨涛郭庆军马楠王洪海蒋文涛
孙纪三,张建军,高伟,杨涛,郭庆军,马楠,王洪海,蒋文涛
肝细胞癌组织HBXIP和GRIM-19表达及意义的探讨
孙纪三,张建军,高伟,杨涛,郭庆军,马楠,王洪海,蒋文涛△
目的探讨乙肝病毒X蛋白结合蛋白HBXIP和细胞凋亡调节因子GRIM-19在肝细胞癌组织中的表达及意义。方法收集42例肝细胞癌组织和28例正常肝脏组织,采用免疫组织化学法检测两种组织中HBXIP和GRIM-19的表达。结果在肝细胞癌组织和正常肝脏组织中,HBXIP阳性表达率分别为80.95%(34/42)和42.86%(12/28);而GRIM-19阳性表达率分别为40.48%(17/42)和75.00%(21/28),差异有统计学意义(P<0.01)。肝细胞癌组织中HBXIP的阳性表达率在低、未分化和Ⅲ~Ⅳ期的表达水平高于高、中分化和Ⅰ~Ⅱ期组织;而GRIM-19的阳性表达率与之相反,且无门脉癌栓组织中GRIM-19的阳性表达率高于有门脉癌栓组织。HBXIP与GRIM-19表达呈负相关(rs=-0.400,P<0.01)。结论HBXIP和GRIM-19的异常表达可能与肝细胞癌的发生及浸润转移有密切关系。
癌,肝细胞;肿瘤转移;免疫组织化学;乙肝病毒X蛋白结合蛋白;GRIM-19
长期的乙型肝炎病毒(hepatitis B virus,HBV)感染容易导致原发性肝细胞癌(hepatocellular carcinoma,HCC)的发生[1]。研究表明,乙型肝炎病毒X蛋白(HBx)可诱导细胞凋亡,参与肝癌的发生与发展[2]。乙型肝炎病毒X蛋白结合蛋白(hepatitis B virus X-interactingprotein,HBXIP)是由91个氨基酸组成的蛋白,具有重要的生物活性[3];HBXIP可与HBx的C端特异性结合,降低HBx的活性[4];而细胞凋亡调节基因19(genes associated with retinoid interferon induced mortality 19,GRIM-19)是一种调亡基因,受维甲酸和干扰素的共同诱导[5]。但HBXIP和GRIM-19在HCC中的表达、分布及两者在HCC发生发展中的作用尚鲜见报道。本文采用免疫组织化学法检测人肝细胞癌组织中HBXIP和GRIM-19蛋白的表达,以探讨HBXIP和GRIM-19在肝细胞癌组织中的表达与肿瘤的生成、发展及转移的关系。
1 材料与方法
1.1 标本来源收集2011年1月—2013年9月天津市第一中心医院接受HCC手术治疗患者术后存档的石蜡标本42例,年龄31~73岁,平均(50.7±17.5)岁,均经我院病理科确诊,且病史资料完整,术前均未行放疗、化疗及生物剂治疗。组织学分级按2003年国际抗癌联盟(UICC)和美国肿瘤联合会(AJCC)联合制定的TNM分期法,高、中分化29例,低、未分化13例;TNM分期按2010年美国癌症研究联合会癌症分期手册第7版标准,Ⅰ~Ⅱ期15例,Ⅲ~Ⅳ期27例;有门静脉血栓14例,无门静脉血栓28例。所有患者均有完整临床资料。另取同时期正常肝脏存档石蜡标本28例。
1.2 主要试剂HBXIP鼠抗人抗体和GRIM-19鼠抗人抗体均为美国Sigma公司产品,工作浓度均为1∶200;SP-0023免疫组化试剂盒(美国ZYMED公司);DAB显色试剂盒(北京鼎国昌盛生物技术有限公司)。其他试剂均为分析纯。
1.3 方法收集病理科登记的HCC患者及肝脏正常的患者的临床资料与存档肝脏石蜡标本,统计HCC病因、甲胎蛋白(AFP)水平、肿瘤大小、门静脉癌栓情况、组织分型、TMN分期等临床病理学参数。每例蜡块4µm厚连续切片3张,其中1张进行HE染色,另2张进行免疫组化染色。石蜡切片常规脱蜡至水化,微波抗原修复15 min,3%H2O2室温孵育。加封闭血清,滴加一抗,4℃过夜,滴加生物素标记二抗,37℃孵育30 min,DAB显色。苏木素复染2 min,盐酸乙醇分化,梯度乙醇脱水,二甲苯透明,中性树胶封片。以PBS代替一抗作为阴性对照。
1.4 结果判定选用试剂盒中的阳性片作为阳性对照,PBS取代一抗作为阴性对照。HBXIP、GRIM-19表达于细胞质,染色呈棕黄色视为阳性。每张切片随机读取5个高倍视野(×200),每个视野计数100个细胞,采用半定量积分法依据染色强度和阳性细胞百分率判断染色结果[6-7]。所有切片均由2位病理科医师在双盲情况下独立观察判断,对判断不一致的病例,共同进行观察后得出一致结论。
1.5 统计学方法应用SPSS 19.0统计软件进行统计学分析。计数资料采用例表示,样本率的比较采用χ2检验,相关性分析采用Spearman等级相关,以P<0.05为差异有统计学意义。
2 结果
2.12 组肝脏组织中HBXIP的表达与分布HBXIP染色主要定位于细胞质,在癌细胞中可见大量棕黄色染色,在正常肝细胞中呈弱阳性表达,见图1。肝癌组织HBXIP的阳性表达率高于正常肝组织(P<0.01),见表1。

Fig.1The expression of HBXIP in normal liver tissues and in hepatocellular carcinoma(IHC,×200)图1 HBXIP在正常肝脏组织和肝细胞癌组织中的表达(IHC,×200)

Tab.1The expression of HBXIP in normal liver tissues and in hepatocellular carcinoma表1 HBXIP在正常肝脏组织和肝细胞癌组织中的表达
2.22 组肝脏组织中GRIM-19的表达与分布GRIM-19染色主要定位于细胞质,见图2。在肝细胞癌组织的阳性表达率低于正常肝组织(P<0.01),见表2。

Fig.2The expression of GRIM-19 in normal liver tissues and in hepatocellular carcinoma(IHC,×200)图2 GRIM-19在正常肝脏组织和肝细胞癌组织中的表达(IHC,×200)
2.3 HBXIP和GRIM-19在不同临床特征下阳性表达率比较HBXIP在低、未分化肝癌中的阳性率明
显高于高、中分化者,Ⅲ~Ⅳ期肝癌组织中HBXIP的阳性表达率高于Ⅰ~Ⅱ期;而HBXIP在HCC病因、门静脉栓塞情况、AFP水平、肿瘤大小等方面的阳性表达率差异无统计学意义(P>0.05),见表3。GRIM-19在高、中分化肝癌中的阳性率高于低、未分化者;Ⅰ~Ⅱ期肝癌组织中HBXIP的阳性表达率率高于Ⅲ~Ⅳ期;无门静脉栓塞者的阳性率高于有门静脉栓塞者;而在HCC病因、AFP水平、肿瘤大小等方面阳性表达率差异无统计学意义(P>0.05),见表3。

Tab.2The expression of GRIM-19 in normal liver tissues and in hepatocellular carcinoma表2 GRIM-19在正常肝脏组织和肝细胞癌组织中的表达
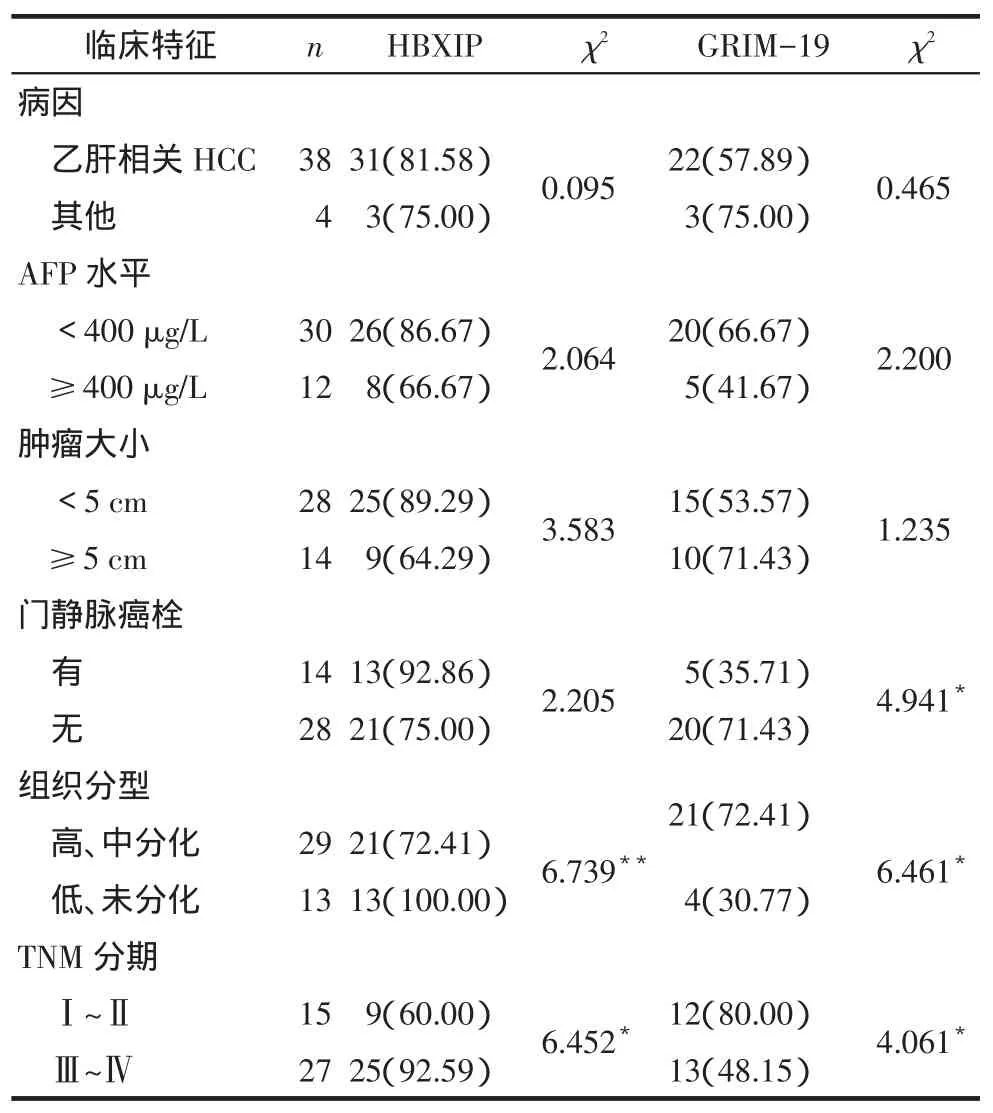
Tab.3Correlation between expressions of HBXIP and GRIM-19 with pathological features in hepatocellular carcinoma表3 肝细胞癌中HBXIP与GRIM-19阳性表达与临床病理参数的关系例(%)
2.4 HBXIP和GRIM-19在肝细胞癌中表达的关系HBXIP和GRIM-19两种蛋白在肝细胞癌中的阳性表达呈负相关(P<0.01),见表4。

Tab.4Relationship of HBXIP and GRIM-19 expression in hepatocellular carcinoma表4 HBXIP和GRIM-19在肝细胞癌中表达的关系(例)
3 讨论
3.1 HBXIP在肿瘤中的作用HBXIP基因定位于人染色体1p13.3,其表达的蛋白首次于肝癌细胞株HepG2中被发现,为乙肝病毒编码的蛋白HBx的相互作用的因子。研究发现,HBXIP为具有多功能的调节蛋白,可通过不同的分子途径发挥调控作用[8]。HBXIP可与凋亡抑制因子survivin形成复合物,同时结合pro-caspase-9,使survivin通过细胞色素C介导的凋亡途径抑制细胞凋亡,从而使得HBXIP对肝癌细胞的增殖具有促进作用,因此推测HBXIP与肝细胞癌的发生与发展有密切关联[9]。为了进一步阐明其分子机制,王凤泽等[4]通过基因共转染将核因子(NF)-κB报告基因质粒pNF-κB-Luc和HBXIP真核表达载体pcDNA3-hbxip导入人肝癌H7402细胞系中,进行荧光素酶活性分析,研究显示HBXIP可增加细胞核内NF-κB蛋白水平,进而发挥NF-κB促转录调控的作用。因此,HBXIP可通过调控NF-κB信号途径而促进肝癌细胞增殖;同时有研究发现HBXIP在乳腺癌细胞中过表达[10],HBXIP通过转录因子Spl激活Skp2的启动子活性[11],上调S期激酶相关蛋白(Skp2)、乳腺肿瘤自身抗原(LMO4)的表达,而HBXIP通过上调Skp2、LMO4可促进乳腺癌癌细胞的迁移[12]。
3.2 GRIM-19蛋白在肿瘤中的作用GRIM-19是GRIM家族一员,其定位于19p13.2,它包含着一个开放读码框,其编码的蛋白质含有144个氨基酸残基。GRIM-19主要定位于胞质中的线粒体内膜上,在受到外界刺激后表达量增多,并能从线粒体中释放而进入细胞核。GRIM-19被认为是一种调亡基因,受维甲酸和干扰素的共同诱导[13];同时GRIM-19为线粒体中烟酰胺腺嘌呤二核苷酸(NADH)脱氢酶Ⅰ复合物的亚单位,在线粒体Ⅰ型呼吸过程中起着至关重要的作用。多项研究表明,GRIM-19参与细胞的增殖、凋亡的调控过程[14],其表达降低或位点突变可以导致细胞的异常增殖和恶性转化[15],在肿瘤的发生与发展过程中发挥重要作用[5,16]。
3.3 HBXIP与GRIM-19蛋白在肝细胞癌组织和正常肝脏组织中的表达本研究显示,HBXIP在正常肝组织表达水平较低,而在肝细胞癌组织中呈过量表达,两组相比具有明显的差异性;而GRIM-19在肝细胞癌组织中的表达水平相对正常肝组织明显减少。通过统计肝细胞癌中HBXIP和GRIM-19表达与临床病理学特征的关系,发现肝细胞癌细胞分化程度越高,HBXIP阳性表达率越低;Ⅰ~Ⅱ期肝癌组织中HBXIP的表达水平比Ⅲ~Ⅳ期低;有门静脉癌栓肝癌组织中的阳性率与无门静脉栓塞者无差异;而GRIM-19在低、未分化、Ⅲ~Ⅳ期、有门静脉栓塞肝癌组表达均降低,且2种蛋白在AFP水平、肿瘤大小等方面的表达无差异。本研究提示HBXIP、GRIM-19在肝细胞癌组织中的异常表达可能与肝癌细胞发生、进展,以及肿瘤向周围组织的侵袭、迁移之间有着高度的关联性,从而为癌细胞转移的研究提供理论依据。此外,本研究显示2种蛋白在肝细胞癌中的表达呈负相关,因此推测HBXIP蛋白表达增加和GRIM-19表达减少在肝细胞癌发生发展、侵袭转移过程中存在拮抗作用。
[1]Cai QY,Ren GL,Zhang WY,et al.Inhibitory effect of miR-155 on expression of hepatitis B virus and its mechanism[J].Med J Chin PLA,2015,40(11):902-905.[蔡启茵,任广立,张卫云,等.miR-155对HBV蛋白表达的抑制作用及机制[J].解放军医学杂志,2015,40(11):902-905].doi:10.11855/j.issn.0577-7402.2015. 11.09.
[2]Kordestani R,Mirshafiee H,Hosseini SM,et al.Effect of hepatitis B virus X gene on the expression level of p53 gene using hep G2 cell line[J].Avicenna J Med Biotechnol,2014,6(1):3-9.
[3]Liu F,You X,Wang Y,et al.The oncoprotein HBXIP enhances angiogenesis and growth of breast cancer through modulating FGF8 andVEGF[J].Carcinogenesis,2014,35(5):1144-1153.doi: 10.1093/carcin/bgu021.
[4]Wang FZ,Sha L,Qiao L,et al.Promotion of transcriptional activity of NF-κB mediated by HBXIP in Hepatoma Cells[J].Progress in Biochemistry and Biohysics,2007,34(11):1197-1201.[王凤泽,沙丽,乔玲,等.乙肝病毒X蛋白结合蛋白(HBXIP)增强肝癌细胞NF-κB转录活性的实验研究[J].生物化学与生物物理进展,2007,34(11):1197-1201].
[5]Zhou Y,Ling B.Functions of GRIM-19 and its association with tumors[J].J Med Mol Biol,2008,5(3):262-264.[周颖,凌斌.GRIM-19的功能及与肿瘤的相关性[J].医学分子生物学杂志,2008,5(3):262-264].
[6]Zhao JL,Li SP,Wang FF,et al.Approach on expression and clinical significance of KISS-1 and E-cadherin in hepatocellular carcinoma[J].Chin J Cancer Prev Treat,2013,20(13):995-997.[赵建龙,李世朋,王朏朏,等.肝细胞癌组织KISS-1和E-cadherin表达临床意义的探讨[J].中华肿瘤防治杂志,2013,20(13):995-997].
[7]Wang YF,Lin Z,Lu Q,et al.The expressions of musashi-2 and CD133 protein in colonic adenocarcinoma[J].Tianjin Med J,2013,41(12):1153-1155.[王娅菲,林中,卢青,等.Musashi-2、CD133在结肠腺癌中的表达[J].天津医药,2013,41(12):1153-1155].
[8]Marusawa H,Matsuzawa S,Welsh K,et al.HBXIP functions as a cofactor of survivin in apoptosis suppression[J].EMBO J,2003,22(11): 2729-2740.
[9]Wang FZ,Sha L,Zhang WY,et al.Involvement of hepatitis B X-interacting protein(HBXIP)in proliferation regulation of cells[J].Acta Pharmacol Sin,2007,28(3):431-438.
[10]Liu Q,Bai X,Li H,et al.The oncoprotein HBXIP upregulates Lin28B via activating TF II D to promote proliferation of breast cancer cells[J].Int J Cancer,2013,133(6):1310-1322.doi:10.1002/ ijc.28154.
[11]Xu F,You X,Liu F,et al.The oncoprotein HBXIP up-regulates Skp2 via activating transcription factor E2F1 to promote proliferation of breast cancer cells[J].Cancer Lett,2013,333(1):124-132. doi:10.1016/j.canlet.2013.01.029.
[12]Yue L,Li L,Liu F,et al.The oncoprotein HBXIP activates transcriptional coregulatory protein LMO4 via Sp1 to promote proliferation of breast cancer cells[J].Carcinogenesis,2013,34(4):927-935. doi:10.1093/carcin/bgs399.
[13]Angell JE,Lindner DJ,Shapiro PS,et al.Identification of GRIM-19,a novel cell death-regulatory gene induced by the interferon-beta and retinoic acid combination,using a genetic approach[J].J Biol Chem,2000,275(43):33416-33426.
[14]Zhou Y,Wei Y,Li M,et al.Effects of expression of GRIM-19 on proliferation of cervical cancer cell line HeLa[J].Tumor,2009(10):940-943.[周颖,卫莹,李敏,等.GRIM-19表达对子宫颈癌HeLa细胞增殖的影响[J].肿瘤,2009(10):940-943].
[15]Zhou AM,Zhao JJ,Ye J,et al.Expression and clinical significance of GRIM-19 in non-smalI celllung cancer[J].Chinese Journal of Cancer,2009,28(4):431-435.[周爱民,赵继京,叶静,等.GRIM-19蛋白在非小细胞肺癌组织中的表达及其临床意义[J].癌症,2009,28(4):431-435].
[16]Cheng Y,Zhou Y,Wei Y,et al.Study of effect sofexpression of GRIM-19 on invasion and apoptosis of cervical cancercell xenograft tumor[J].Chin J Lab Diagn,2010,14(5):733-735.[程勇,周颖,卫莹,等.GRIM-19的表达对人子宫颈癌细胞移植瘤细胞侵袭、凋亡的影响研究[J].中国实验诊断学,2010,14(5):733-735].
(2015-05-08收稿 2015-08-08修回)
(本文编辑 李鹏)
Expressions of HBXIP and GRIM-19 in hepatocellular carcinoma and their clinic significance
SUN Jisan,ZHANG Jianjun,GAO Wei,YANG Tao,GUO Qingjun,MA Nan,WANG Honghai,JIANG Wentao△
Tianjin First Central Hospital of Oriental OrganTransplant Center,Tianjin 300192,China△
ObjectiveTo investigate the expressions of HBXIP and GRIM-19 in hepatocellular carcinoma tissues and their clinic significance.MethodsHepatocellular carcinoma tissue(n=42)and normal liver tissue(n=28)were collected from Tianjin First Central Hospital,immunohistochemistry was used to detect the expressions of HBXIP and GRIM-19 in these two groups.ResultsRate of cells with positive expressions of HBXIP in hepatocellular carcinoma and normal liver tissues were 80.95%(34/42)and 42.86%(12/28)respectively;Rate of cells with positive expression of GRIM-19 in hepatocellular carcinoma tissues and normal liver tissues was 40.48%(17/42)and 75.00%(21/28)respectively,and the difference between these two groups was statistically significant(P<0.05);The expression of HBXIP was higher but the expression of GRIM-19 was lower in poor differentiated and stageⅢ-IV cells than those in well and moderate differentiated cells and in stage I-II,cells.What′s more,the expression of GRIM-19 is higher in tissue without portal thrombosis than that in tissue with portal thrombosis.The expression of HBXIP was negatively correlated with GRIM-19 expression(rS=-0.400,P<0.01). ConclusionThe abnormal expressions of HBXIP and GRIM-19 may play important roles in the process of development and metastasis of hepatocellular carcinoma.
carcinoma,hepatocellular;neoplasm metastasis;immunohistochemistry;HBXIP;GRIM-19
R735.7
A
10.11958/j.issn.0253-9896.2015.12.006
天津市科技计划项目(10ZCGYSF00500)
天津市第一中心医院东方器官移植中心(邮编300192)
孙纪三(1980),男,主治医师,硕士,主要从事肝脏移植方面研究
△通讯作者E-mail:jiang-wentao@medmail.com.cn
