ZHX3基因沉默对BMSCs中成骨相关因子表达的影响
2015-11-24张苗苗包翠芬王艳闵鹤鸣秦书俭
张苗苗,包翠芬,王艳,闵鹤鸣,秦书俭△
ZHX3基因沉默对BMSCs中成骨相关因子表达的影响
张苗苗1,包翠芬2,王艳3,闵鹤鸣4,秦书俭1△
目的探讨锌指蛋白和同源框3(ZHX3)基因沉默对骨髓间充质干细胞(BMSCs)中smad3、smad4、RUNX2表达的影响。方法构建ZHX3低表达慢病毒载体并转染大鼠BMSCs(ZHX3沉默组),同时设空载病毒转染BMSCs(载体对照组)及不做任何处理的BMSCs(空白对照组)。荧光显微镜下测定细胞转染率并采用免疫印迹技术鉴定转染是否成功;采用免疫荧光化学和免疫印迹技术定性定量检测ZHX3沉默时smad3、smad4、RUNX2表达情况。结果(1)复苏培养的细胞具有BMSCs表型。(2)转染后,ZHX3沉默组和载体对照组均表达绿色荧光,空白对照组不表达荧光,且沉默组ZHX3基因表达显著低于载体对照组。(3)免疫荧光结果显示,smad3、smad4的阳性表达位于细胞核和细胞质,RUNX2的阳性表达主要定位于细胞核。3组细胞均可见阳性表达细胞,且空白对照组与载体对照组之间荧光强度未见显著差异,但ZHX3基因沉默组的荧光强度显著低于2个对照组。(4)免疫印迹检测smad3、smad4、RUNX2的条带于空白对照组和载体对照组中无显著差异,但均显著高于ZHX3沉默组(P<0.05)。结论ZHX3基因沉默后BMSCs体外成骨能力延迟,可能通过下调smad3、smad4、RUNX2来发挥作用。
DNA结合蛋白质类;锌指;基因,同源盒;转录因子;基因沉默;间质干细胞;smad3;smad4;RUNX2;转录抑制因子-锌指蛋白和同源框3
植骨材料不足是临床骨缺损修复中所面临的主要问题之一[1]。采用组织工程骨移植是解决植骨材料不足问题的主要方法之一。而植骨种子细胞是该研究的核心内容。目前种子细胞最主要的来源为骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs),而BMSCs向成骨细胞的诱导分化是成骨的关键因素。研究显示,诱导分化的关键步骤可能取决于早期调控的转录因子,其中锌指蛋白和同源框3(zinc fingers and homeoboxes 3,ZHX3)是近年来发现的成骨分化早期标志物,属ZHX蛋白家族成员之一,含有2个锌指结构和5个同源结构域[2-3]。研究显示,与晚期出现的标志物相比,ZHX3能够更早、更快地识别干细胞的成骨潜能[3]。最近实验证明,ZHX3基因过表达可促进BMSCs体外成骨能力[4]。转化生长因子(TGF)-β/smad通路是BMSCs向成骨细胞诱导分化的主要信号通路之一,而smad3、smad4、RUNX2是该通路中的主要调控因子[5]。ZHX3作为成骨分化早期的标志物,是否通过调控上述通路发挥促进成骨分化作用,有待于深入地探讨。
1 材料与方法
1.1 材料ZHX3低表达慢病毒及阴性对照病毒(上海吉凯基因有限公司);smad3、smad4、RUNX2抗体(Abcam公司);TRITC标记的荧光二抗(北京中杉公司);0.25%Trypsin-0.04%EDTA、SD大鼠BMSCs及干细胞培养基、OriCellTM间质干细胞成骨诱导培养基试剂盒(广州赛业公司)。
1.2 SD大鼠BMSCs的复苏培养与传代液氮中取出冻存的BMSCs迅速放入37℃水浴中快速晃动,直至冻存悬液完全融解。将其移入含完全培养基的离心管中,250×g离心5 min,去上清液,向细胞沉淀物加入2~3 mL完全培养基,吹打均匀后,将细胞按(2~4)×104个活细胞/cm2的密度接种到培养瓶中。37℃、5%CO2、80%相对湿度的培养箱中培养。隔日换液。当细胞达80%~90%的汇合度,采用胰酶进行消化和传代。相差显微镜观察细胞形态及生长情况。
1.3 BMSCs一般状态的观察及检测细胞按0.5×104个/mL的密度接种于24孔培养板,每天每组细胞各选取3孔,连续测7 d,酶标仪490 nm波长上测定光密度(OD)值,绘制生长曲线[6]。
1.4 慢病毒转染BMSCs的效率测定及转染鉴定设置3个不同梯度(10、50和100µL)的病毒添加孔及1个空白对照孔,以确定转染的最佳感染复数(multiplicity of infection,MOI)。96 h后,荧光倒置显微镜下观察细胞的转染效果,计算转染率,转染率=绿色萤光蛋白(GFP)表达细胞/细胞总数× 100%[7-8]。选择转染率在80%以上的孔,此时的滴度为病毒最佳感染滴度。实验分为空白对照组、载体对照组和ZHX3沉默组。转染后观察细胞状态,24 h后更换新鲜培养基。慢病毒转染之后Western blot检测ZHX3蛋白的表达情况,以鉴定是否转染成功。
1.5 BMSCs的诱导分化取第3代大鼠BMSCs以2×104cells/cm2的细胞密度接种在事先包被0.1%明胶的6孔板中。当细胞融合度达到60%~70%时,小心地将孔内完全培养基吸走,向6孔板中加入2 mL成骨诱导分化培养基,继续培养[9]。
1.6 免疫荧光法检测smad3、smad4、RUNX2蛋白表达当病毒转染细胞达80%~90%的汇合度,胰酶消化,计数重悬细胞于完全培养基中,先在每个孔里滴少量完全培养基,使玻片与培养皿靠培养基的张力粘合到一起,然后放玻片,按照4×104/孔细胞密度种到6孔培养板。24 h细胞贴壁后,弃去完全培养基,加入成骨诱导培养基,24 h后弃去成骨诱导培养基,取出爬片采用免疫荧光检测smad3、smad4、RUNX2表达情况。爬片弃废液,PBS冲洗3次,每次3 min,4%多聚甲醛室温固定30 min,PBS漂洗,0.5%Triton X-100孵育30 min,PBS冲洗,5%BSA室温封闭30 min后,PBS冲洗。一抗湿盒孵育4℃过夜,PBS清洗,荧光标记的二抗工作液孵育(湿盒)37℃30 min(注意避光),PBS冲洗,Hoechest33258染液复染细胞核,PBS冲洗,荧光显微镜下观察smad3、smad4、RUNX2表达情况。
1.7 免疫印迹法检测smad3、smad4、RUNX2蛋白表达收集3组细胞,倒掉培养液,3 mL 4℃预冷的PBS洗涤细胞3次。用刮棒将细胞刮于培养瓶的一侧,然后用枪将细胞液移至1.5 mL离心管中,整个操作尽量在冰上进行。在4℃下2 000 r/min离心5 min,加400µL含PMSF的裂解液,冰上裂解30 min,后静置30 min,4℃、12 000 r/min离心20 min,留取上清液。用BCA法测定蛋白含量,并制样,-20℃冰箱保存。灌胶与上样、电泳、转膜后加入一抗,4℃孵育过夜,TBST缓冲液洗脱3次,每次5 min;二抗室温孵育1 h,TBST缓冲液洗脱3次,每次5 min;ECL发光法显色;扫描电泳条带,用凝胶图像处理系统分析目标带的分子质量和OD值。采用β-actin作为内参。根据目的条带与内参照条带OD的比值表示待测蛋白含量。
1.8 统计学方法应用SPSS 17.0统计软件。计量资料采用均数±标准差表示,多组间比较采用方差分析,组间多重比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs的培养细胞于复苏24 h后贴壁,呈长梭形,排列紧密,整体排列更趋于规律性,呈漩涡状,见图1A。传代后细胞呈成纤维细胞样形态,以长梭形为主,细胞形态、大小均一,细胞呈典型的BMSCs样,见图1B。
2.2 BMSCs一般状态观察及检测3组BMSCs细胞传代培养后生长状态良好,培养1 d处于潜伏期,空白对照组2 d后进入对数增殖期,6~7 d后进入平台期。载体对照组和ZHX3沉默组传代后3 d进入对数增殖期,时间集中在3~5 d,6 d后进入平台期,见图2。
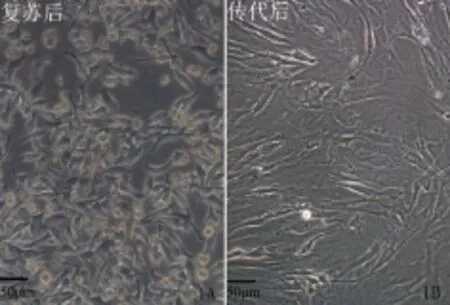
Fig.1The recovery and subculture of BMSCs图1 BMSCs复苏和传代培养(×200)
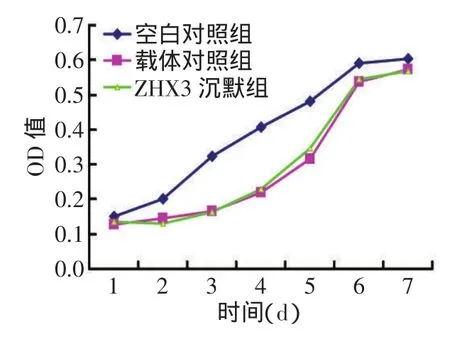
Fig.2Growth curves of BMSCsin three groups图2 各组BMSCs生长曲线
2.3 慢病毒转染BMSCs和转染效率的测定及鉴定荧光显微镜下载体对照组和ZHX3沉默组均观察到带有较强绿色荧光的BMSCs,而空白对照组则未见到特异性荧光影像,见图3。病毒转染率:结果显示MOI为10、50、100时,转染率分别为(43.90± 3.60)%、(92.43±4.33)%、(93.40±2.80)%,转染效率随着滴度的增加而增加,差异有统计学意义(F= 182.286,P<0.05),而MOI 50和MOI 100时转染率增加差异幅度不大,故选择MOI 50为细胞最佳感染条件。免疫印迹结果显示,3组均可见ZHX3阳性表达条带,但ZHX3沉默组的表达条带(50.63%± 4.13%)明显弱于空白对照组(75.83%±4.80%)和载体对照组(71.69%±5.51%),差异有统计学意义(F= 23.334,P<0.05),提示ZHX3低表达的BMSCs转染成功,见图4。
2.4 免疫荧光检测smad3、smad4、RUNX2的表达情况荧光显微镜下可见,smad3、smad4的阳性表达位于细胞核和细胞质,可见明显的红色荧光,3组细胞均可见阳性表达细胞,且空白对照组与载体对照组之间荧光强度未见显著差异,但ZHX3沉默组的荧光强度显著低于2个对照组。荧光显微镜下可见,RUNX2的阳性表达主要定位于细胞核,可见明显的绿色荧光。3组细胞均可见阳性表达细胞,且空白对照组与载体对照组之间荧光强度未见显著差异,但ZHX3沉默组的荧光强度显著低于2个对照组,见图5。
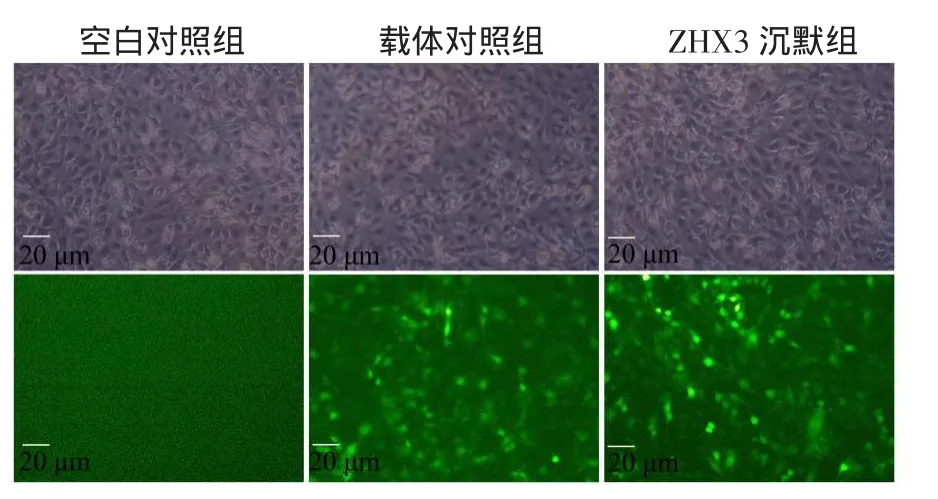
Fig.3Virus transfection of BMSCs in three groups图3 各组细胞病毒转染情况

Fig.4The expression of ZHX3 protein in three groups图4 各组细胞ZHX3蛋白表达情况

Fig.5Expressions of smad3,smad4 and RUNX2 in three groups of cells(immunofluorescence staining,×400)图5 各组细胞smad3、smad4、RUNX2的蛋白表达(免疫荧光染色,×400)
2.5 免疫印迹检测smad3、smad4、RUNX2蛋白表达smad3、smad4、RUNX2的条带于空白对照组和载体对照组中差异无统计学意义(P>0.05),但均显著高于ZHX3沉默组(P<0.05),见图6、表1。
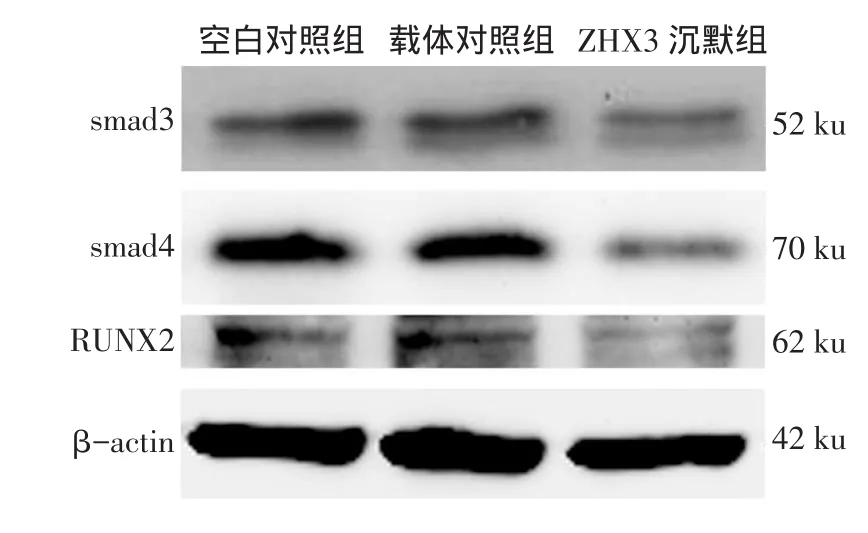
Fig.6The expressions of smad3,smad4 and RUNX2 in three groups of cells图6 3组细胞smad3、smad4、RUNX2的表达
Tab.1The Comparison of expressions of smad3,smad4 and RUNX2 between three groups of cells表1 各组细胞smad3、smad4、RUNX2表达量比较(n=3,)

Tab.1The Comparison of expressions of smad3,smad4 and RUNX2 between three groups of cells表1 各组细胞smad3、smad4、RUNX2表达量比较(n=3,)
**P<0.01;a与ZHX3沉默组比较,P<0.05
组别空白对照组载体对照组Z H X 3沉默组F s m a d 3 2 9 . 3 1 ± 0 . 9 9 a 3 0 . 8 3 ± 1 . 0 5 a 1 9 . 2 6 ± 3 . 2 5 2 8 . 2 1 1**s m a d 4 5 7 . 4 0 ± 4 . 5 2 a 5 3 . 1 7 ± 1 . 6 9 a 2 8 . 6 6 ± 0 . 6 6 9 1 . 3 4 0**R U N X 2 1 1 . 1 9 ± 1 . 2 3 a 1 0 . 1 5 ± 1 . 3 7 a 3 . 9 4 ± 1 . 5 2 2 4 . 2 1 8**
3 讨论
种子细胞诱导分化为成骨细胞的关键可能取决于早期调控的转录因子。ZHX3作为2003年新克隆的转录抑制因子[2],是成骨分化早期的标志物。Suehiro等[3]研究发现,采用siRNA技术敲减ZHX3基因,转染至BMSCs内,诱导后6~21 d的成骨能力(碱性磷酸酶含量、骨基质矿化情况)均呈明显的减弱和延迟现象,此研究结果提示ZHX3在成骨分化过程中起着重要的作用,可能是BMSCs从未分化阶段向成骨分化过程的转换开关。ZHX3作为成骨分化早期的标志物,与晚期出现的标志物相比能够更早、更快地识别干细胞的成骨潜能。
smad3和smad4是TGF-β1信号转导通路中的重要因子,在成骨细胞分化过程中发挥重要作用。smad3受体磷酸化后与smad4结合,将TGF-β1信号直接由细胞膜转导入细胞核内,诱导对TGF-β1信号的转录应答[10],进一步发挥促成骨作用。研究发现,野生型smad3基因能够抑制BMSCs增殖,通过非细胞外信号激酶通路促进BMSCs向成骨方向分化和成熟[11]。既往研究证实,smad3的缺少导致成骨标志物降低[12-13]。说明smad3不仅是促进骨形成的成分,而且在介导TGF-β1调控骨形成、成骨分化过程中发挥关键作用。smad4复合物通过影响RUNX2的表达,从而影响成骨靶基因转录[14]。通过siRNA干扰smad4表达使重要成骨细胞分子标志物和调节分子表达水平下调[15]。RUNX2是成骨细胞特异性转录因子,直接参与调控Ⅰ型胶原和骨钙蛋白成骨相关基因的表达,刺激成骨细胞分化。此外,smad4作用于与碱性磷酸酶表达有关的RUNX2基因,外源性smad4可以促进表达RUNX2的C2C12细胞的碱性磷酸酶活性,但该基因突变后,碱性磷酸酶活性也检测不出,说明smad4与RUNX2之间有协同作用。
本实验通过BMSCs慢病毒转染,建立ZHX3低表达模型,进一步观察ZHX3低表达时对成骨诱导通路中smad3、smad4、RUNX2的调控作用。免疫荧光、免疫印迹实验结果显示,当ZHX3基因沉默时,smad3、smad4、RUNX2的表达强度呈明显的减弱趋势,显著低于未经处理的BMSCs,由此笔者推测当ZHX3基因含量表达下降时,可引起TGF-β1/smad通路中的smad3、smad4的表达下调,进一步引起下游转录因子RUNX2的表达下降,从而影响BMSCs的成骨分化能力,导致成骨分化能力延迟。但是,ZHX3基因究竟处于TGF-β1/smad通路的何种位置,究竟是ZHX3基因沉默直接抑制了smad3、smad4的表达,还是ZHX3基因沉默后通过负反馈方式抑制了两者的表达,即ZHX3究竟是位于smad3、smad4的上游还是下游,还需进一步深入研究来证实。
[1]Wang Y,Li YZ.Bone marrow mesenchymal stem cells in the bone defect in between is reviewed[J].Chinese Journal of Bone and Joint Damage,2015,30(5):555-556.[王元,李屹洲.骨髓间充质干细胞在骨缺损中的研究进展[J].中国骨与关节损伤杂志,2015,30(5): 555-556].doi:10.7531/j.issn.1672-9935.2015.05.046.
[2]Yamada K,Kawata H,Shou Z,et al.Analysis of zinc-fingers and homeoboxes(ZHX)-1-interacting proteins molecular cloning and characterization of a member of the ZHX family,ZHX3[J].Biochem J,2003,373(Pt 1):167-178.
[3]Suehiro F,Nishimura M,Kawamoto T,et al.Impact of zinc fingers and homeoboxes 3(ZHX3)on the regulation of mesenchymal stem cell osteogenic differentiation[J].Stem Cells,2010,20(9):1539-1547.doi:10.1089/scd.2010.0279.
[4]Li J,Qin SJ,Bao CF,et al.Gene transfection ZHX3 BMSCs and the experimental study of in vitro osteogenesis ability[J].Chinese Journal of Clinical Anatomy,2014,32(2):174-178.[李季,秦书俭,包翠芬,等.ZHX3基因转染BMSCs及对体外成骨能力的实验研
[5]Yang JH,Kim HJ,Kim SE,et al.The effect of bone morphogenic protein-2-coated tri-calcium phosphate/hydroxyapatite on new bone formationin in a rat model of femoral distraction osteogenesis[J].Cytotherapy,2012,14(3):315-326.doi:10.3109/1465324 9.2011.630728.
[6]Zhu XL,Yan T,Yao WJ,et al.Rat bone marrow mesenchymal stem cells between the isolation and culture method of optimization[J]. Journal of Southern Medical University,2014,11:1621-1626,1631.[祝旭龙,颜谭,姚维杰,等.大鼠骨髓间充质干细胞的分离与培养方法优化[J].南方医科大学学报,2014,11:1621-1626,1631].doi 10.3969/j.issn.1673-4254.2014.11.13.
[7]Li QQ,Wang DP,Xiong JY,et al.Research of lentiviral-mediated Runx-2 transfered into bone marrow mesenchymal stem cells promoting osteogenic differentiation[J].Chinese Journal of Clinical Anatomy,2015,33(3):311-315.[李庆庆,王大平,熊建义,等. Runx2重组慢病毒感染骨髓间充质干细胞并促进其成骨分化的研究[J].中国临床解剖学杂志,2015,33(3):311-315].doi: 10.13418/j.issn.1001-165x.2015.03.017.
[8]Muruganandan S,Sinal CJ.The impact of bone marrow adipocytes on osteoblast and osteoclast differentiation[J].IUBMB Life,2014 Mar 17.doi:10.1002/iub.1254.[Epub ahead of print]
[9]Fu HY,Du HY,Bao CF.Rehmannia polysaccharide and induce cell differentiation to neurons in the rat BMSCs samples of Notch1 and Jagged1 protein expression[J].Med J Chin PLA,2014,39(6): 448-453.[付海燕,杜红阳,包翠芬.地黄多糖诱导大鼠BMSCs向神经元样细胞分化及对Notch1和Jagged1蛋白表达的影响[J].解放军医学杂志,2014,39(6):448-453].doi:10.11855/j. issn.0577-7402.2014.06.05.
[10]Wang YT,Zheng QX,Wu XT,et al.Smad3 selective adjustment TGF-beta 1 to promote differentiation of rat bone marrow mesenchymal stem cells between development of experimental research[J].Acta Med Univ Sci Technol Huazhong,2007,36(5):625-629,701.[王运涛,郑启新,吴小涛,等.Smad3选择性调节TGF-β1促进大鼠骨髓间充质干细胞成骨分化的实验研究[J].华中科技大学学报(医学版),2007,36(5):625-629,701].doi:10.3870/j. issn.1672-0741.2007.05.018.
[11]Wang YT,Zheng QX,Guo XD.Wild type Smad3 gene promote the differentiation of rat bone marrow mesenchymal stem cells between development of experimental research[J].Natl Med J China,2004,84(18):31-35.[王运涛,郑启新,郭晓东.野生型Smad3基因促进大鼠骨髓间充质干细胞成骨分化的实验研究[J].中华医学杂志,2004,84(18):31-35].doi:0.3760/j:issn:0376-2491.2004.18.008.
[12]Yang X,Chen L,Xu X,et al.TGF beta/smad3 signals repress chondrocyte hypertrophic differentiation and are required for maintaining articular cartilage[J].J Cell Biol,2001,153:35-46.
[13]Borton AJ,Frederick JP,Datto MB,et al.The loss of smad3 results in a lower rate of bone formation and osteopenia through dysregulation of osteoblast differentiation and apoptosis[J].J Bone Miner Res,2001,16:1754-1764.
[14]Miyazono K.Transforming growth factor-beta signaling in epithelial-mesenchymal transition and progression of cancer[J].Proc Jpn Acad Ser B Phys Biol Sci,2009,85(8):314-323.
[15]Yang X.Smad4 mediated transforming growth factor beta signal regulating bone development and the function of the steady state to maintain[J].Chinese Bulletion of Life Science,2008,20(2):165-170.[杨晓.Smad4介导转化生长因子-β信号调节骨骼发育和稳态维持的功能[J].生命科学,2008,20(2):165-170].doi:10.3969/j. issn.1004-0374.2008.02.002.
(2015-08-11收稿 2015-09-15修回)
(本文编辑 魏杰)
Effects of ZHX3 gene silence on the expression of osteoblast-related factors in BMSCs
ZHANG Miaomiao1,BAO Cuifen2,WANG Yan3,MIN Heming4,QIN Shujian1△
1 Department of Human Anatomy and Histology and Embryology,2 Key Lab of Molecular Cell Biology and New Drug Development,3 Department of Neurology,First Affiliated Hospital of Jinzhou City;4 Department of Cell Biology,Liaoning Medical University,Jinzhou 121000,China△
ObjectiveTo investigate the effects of zinc fingers and homeoboxes 3(ZHX3)silence on expressions of smad3,smad4 and RUNX2 in bone marrow mesenchymal stem cells(BMSCs).MethodsZHX3 low expression vector(ZHX3 silent group)was constructed and was transfected to rat BMSCs.Empty vector was transfected into BMSCs and was used as vehicle control group,and wild type BMSCs was used as the control group.The cell transfection rate was measured under a fluorescence microscope,and then the successful transfection was identified.The immunocytochemistry and immunoblotting methods were used to detect the expression levels of smad3,smad4 and RUNX2.Results(1)Cells with BMSCs phenotype can be obtained by recovery culturing.(2)After transfection,the green fluorescent protein was found in ZHX3 silence group and vehicle control group.Blank control group showed no significant fluorescence.The expression level of ZHX3 was significantly lower in ZHX3 silence group than that of vehicle control group.(3)Results of immunofluorescence asssay showed that the positive expressions of smad3 and smad4 were located in nucleus and cytoplasm,the positive expression of RUNX2 was mainly located in nucleus.Positive cells were observed in three groups.There was no significant difference in fluorescence intensity between the control group and the vehicle control group,but the fluorescence intensity was significantly lower in ZHX3 gene silence group than that of two control groups.(4)There were no significant differences in expressions of smad3,smad4 and RUNX2 betweem control group and the vehicle control group,but they were significantly higher than those of ZHX3 silence group(P<0.05).ConclusionZHX3 gene silence can delay vitro osteogenesis of BMSCs,which may play a role by the down-regulated expression levels of smad3,smad4 and RUNX2.
DNA-binding proteins;zinc fingers;genes,homeobox;transcription factors;gene silencing;mesenchymal stem cells;smad3;smad4;RUNX2;zinc fingers and homeoboxes 3
R392.12
A DOI:10.11958/j.issn.0253-9896.2015.12.004
J].中国临床解剖学杂志,2014,32(2):174-178].
10.13418/j.issn.1001-165x.2014.02.014.
国家自然科学基金资助项目(31170930,81202783)
1锦州,辽宁医学院人体解剖与组织胚胎教研室(邮编121000);2辽宁省高校分子生物与新药开发重点实验室;3辽宁医学院附属第一医院神经内科;4辽宁医学院细胞生物学教研室
张苗苗(1989),女,硕士在读,主要从事骨组织工程方面研究
△通讯作者E-mail:mianyizuhua@aliyun.com
