甲氧西林耐药/敏感金黄色葡萄球菌基因分型和毒力基因检测
2015-11-24王俊瑞杜小莉崔晶花韩艳秋
王俊瑞, 杜小莉, 塔 拉, 崔晶花, 福 泉, 韩艳秋
·论著·
甲氧西林耐药/敏感金黄色葡萄球菌基因分型和毒力基因检测
王俊瑞1, 杜小莉2, 塔 拉1, 崔晶花2, 福 泉1, 韩艳秋1
目的 分析耐甲氧西林金黄色葡萄球菌(金葡菌)(M RS A)和甲氧西林敏感金葡菌(M SS A)临床分离株基因分型及毒力基因分布特征是否存在差异,了解金葡菌耐药性演变与毒力变迁之间的相关性。方法 采用脉冲场凝胶电泳(PF G E)方法和多位点序列分型(M LST)方法对呼和浩特地区住院患者中分离的30株 M RS A和30株 M SS A进行分子分型,同步采用聚合酶链反应(PC R)方法检测菌株毒力基因。结果 60株金葡菌PF G E分型共分19个型,M SS A菌株分布在I和H 型等16个基因型中,而 M RS A株主要集中分布在K和 M 2个基因型中。20株不同PF G E型菌株 M LST分型结果显示,M RS A株主要为ST-239型;M SS A株呈多样性分布特征,主要以ST-5型、ST-7型、ST-15型为主。毒力基因在M RS A和M SS A中分布差异显著。M SS A毒力基因整体携带率明显高于 M RS A(53.9%对40.0%,χ2=32.7,P<0.01)。M RS A株sea、cna和cap8基因携带率明显高于M SS A携带率(P<0.01),而sec、seg、sei、sem、sen、seo、fnbB、ebpS、cap5基因携带率明显低于 M SS A(P<0.05)。结论 呼和浩特地区金葡菌临床分离株基因型呈现多样化分布特点,M RS A主要以ST-239型为主。M SS A毒力基因携带率高,特定毒力因子在M RS A和 M SS A株中呈现一定聚集分布特征,金葡菌特定耐药性的获得可能伴随特定毒力特征的变化。
金黄色葡萄球菌; 耐药性; 毒力基因; 分子分型
金黄色葡萄球菌(金葡菌),特别是耐甲氧西林金葡菌(M RS A)目前已成为医院感染的主要病原菌之一。金葡菌通过释放多种细胞外毒素,如肠毒素、溶血素、杀白细胞毒素等而表现出较强的致病力[1]。不同基因背景及来源金葡菌的毒力因子分布特征差异显著[2-4],且其表达特征明显地受宿主等环境因素的影响[5-6]。 随 着异质性万古 霉 素 中 介 金葡菌(h-VIS A)检出率的增加以及万古霉素耐药株(V R S A)的出现,更严格防控金葡菌的感染及其耐药性的产生成为当前医院感染防控的重要内容。但耐药性的增加与金葡菌毒力的关系见解不一[7-10]。本研究拟以内蒙古呼和浩特地区住院患者分离的60株M RS A和甲氧西林敏感金葡菌(M SS A)为研究对象,对不同耐药表型菌株进行分子分型并检测其毒力基因分布特征,分析M R S A 和 M SS A 在基因型和毒力基因分布中的差异,为进一步研究金葡菌耐药性演变与毒力变迁之间的相关性提供参数。
1 材料与方法
1.1 材料
1.1.1 菌株及质控菌株 2011年12月—2014年3月内蒙古呼和浩特地区60例住院患者(入院时间>48 h)分离M RS A 30株和 M SS A 30株作为研究对象。其中,25株分离自伤口分泌物,14株分离自全血标本,10株分离自脓液标本,4株分离自咽拭子标本,3株分离自痰液标本,2株分离自尿液标本,1株分离自胸腹水,1株分离自关节腔积液。所有金葡菌分离株均再次鉴定,并依据美国临床与实验室标准化协会(C LSI)2013年版标准进行药敏试验,采用头孢西丁纸片扩散法确认M R S A株。质控菌株金葡菌(A T C C25923)由本实验室保存。
1.1.2 主要仪器和试剂 VIT E K-Ⅱ全自动微生物分析系统及配套革兰阳性菌鉴定卡 G P(法国生物梅里埃公司)、2720型PC R仪(A BI公司)、脉冲场凝胶电泳设备(美国Bio-Rad公司)。头孢西丁药敏纸 片购自 英国O X OID公司。溶葡萄 球菌素(lysostaphin)购自Sigma公司。聚合酶链反应(PCR)master mix购 自 宝 生 物工 程(大连)有 限公 司。SeaKem Gold琼脂糖(SK G)购自美国L O NZ A公司。PC R引物合成及扩增产物测序由上海生物工程有限公司完成。
1.2 方法
1.2.1 脉冲场凝胶电泳(PF G E)分型 实验基本流程参照文献[11]进行。基本过程如下:标准菌株和试验菌株常规培养后配置一定浓度菌悬液,加入2μL溶葡萄球菌素(1 m g/m L)处理。等体积预热的S K G与菌悬液混合,立即注入模具,室温下静置直至凝固为胶块。胶块中加入细胞裂解液混合液中进行裂解。标准菌株胶块及试验菌株胶块分别置于含XbaI内切酶缓冲液及S maI限制性内切酶缓冲液中孵育。胶块在PF G E仪中进行电泳,条带比对以沙门菌 H9812进行标准化。胶块间图像比较采用BioNu merics(Version 5.1,Appl ied M aths,Inc)软件进行处理。采用1.5%条带差异允许度。聚类分析采用U P G M A(组间非加权的几何平均数)方法,D N A相关性采用 Dice系数计算。相似性系数90%以上认为菌株间亲缘关系较近,归为一类。
1.2.2 多位点序列分型(M LS T) 根据文献[12]介绍方法,随机选取不同 PF G E 图谱型 3、4 株M R S A菌株为代表株(共20株)进行7个管家基因(arcC,aroE,glp F,g m k,pta,tpi,yqiL)序列测定。首先对各菌株纯培养物进行D N A提取(细菌基因组D N A提取试剂盒,天根生化科技有限公司),利用各基因特异性引物进行P C R扩增,P C R产物送上海生工公司进行序列测定。P C R扩增与序列测定使用同一对引物。测序结果在http://saureus. mlst.net网站进行序列比对,确定其S T型别并进行亲缘关系比对。
1.2.3 毒力因子检测 每株菌纯培养物采用细菌基因组D N A提取试剂盒提取 D N A,用表1所列毒力因子基因特异引物进行P C R检测。P C R产物进行琼脂糖凝胶电泳并成像。
1.2.4 统计学分析 采用SPSS15.0软件对毒力因子分布差异进行统计分析。M R S A 和 M SS A 菌株间毒力因子携带率比较采用卡方检验。P<0.05表示差异有统计学意义。

表1 毒力基因检测PC R引物列表Table 1 Primers used in PC R detection of virulence genes
2 结果
2.1 菌株科室分布特征
60株金葡菌分离自不同住院科室。M R S A 主要分离自骨科(33.3%,10/30)、神经外科(20.0%,6/30)、IC U(13.3%,4/30)和肾内科(6.7%,2/30);M SS A株主要分离自皮肤科(23.3%,7/30)、儿科(13.3%,4/30)、骨科(13.3%,4/30)、普通外科(13. 3%,4/30)。
2.2 分子分型结果
PF G E分型结果显示,内蒙古不同地区分离金葡菌呈现多样性的基因背景特征,按照90%相似度为判断依据,60株菌共分19型。其中,优势型为I、K和M 型,分别占11.7%(7/60)、16.7%(10/60)和28.3(17/60)。M R S A 和 M SS A 菌株呈现明显的基因分型特征。其中,M SS A株共分16型,优势型为I型(11.7%,7/60)和H 型(6.7%,4/60);而M R S A集中分布在K 型(16.7%,10/60)和 M 型(28.3%,17/60),另外3株M R S A 散在分布于 G型(2株)和 H型(1株)。结果见图1。
选择PF G E各型菌株共20株进行M LS T分型,其中M R S A 9株,M SS A 11株。20株中S T-5型3株(S8、S14、S75)、S T-7型2株(S2、S81)、S T-15型2株(S65、S91)、S T-45型1株(S3)、S T-59型1株(S10)、S T-121型1株(S69)、S T-188型1株(S7)、S T-239型为7株(S4、S9、S13、S68、S71、S72、S56)、S T-338型1株(S67)、S T-1964型1株(S6)。M R S A主要是S T-239型,M SS A主要以S T-5型、S T-7型、S T-15 型为主,其他型 别在 M R S A 和M SS A中交叉分布。聚类结果如图1所示。
2.3 毒力基因分布特征
各类毒力因子在 M RSA和M SSA菌株中分布特征差异明显,M SSA菌株各种毒力因子分布更为多样化,M SSA 毒力因子整体携带率明显高于M RSA(53.9%对40.0%,χ2=32.7,P<0.01)。肠毒素基因中,sea基因总携带率最高(51.7%,31/60),携带率最低者为see基因(3.3%,1/30)。其他毒力基因中,luk-D E为85.0%(51/60),tst为6.7%(4/60),4株均为M SSA。M RSA株sea基因携带率明显高于M SSA携带率(χ2=15.01,P<0.01),而sec、seg、sei、sem、sen、seo基因携带率明显低于M SSA(χ2=23.72,P<0.01;χ2=7.92,P<0.05;χ2=11.43,P<0.01;χ2=9.32,P<0.01;χ2=18.26,P<0.01;χ2=11.59,P<0.01;χ2=12.27,P<0.01)。见表2。
结合PF G E分型,M R S A主要集中分布在K和M型(90.0%,27/30),是医院感染 M R S A 的主要流行株,毒力基因分布如图1所示。M SS A 优势型为 H和I型(36.7%,11/30),非优势型占60.0%(18/30),两类菌株毒力基因分布特征见图1。优势株肠毒素基因总携带率明显高于非优势株(50.4%对25.8%,χ2=20.04,P<0.01)。非优势株sec、sed基因携带率高于优势株(χ2=6.45,P<0.05;χ2=4.97,P<0.05),而优势株seg、lukD-E、tst、cap5基因携带率高于非优势株(χ2=15.10,P<0.05;χ2=5.64,P<0.05;χ2=7.59,P<0.05;χ2=4.97,P<0.05)。

图1 60株金葡菌PF G E分型结果Figure 1 PF G E profile of 60 strains ofStaphylococcus aureus
3 讨论
金葡菌的毒力因子主要是其产生的多种细胞外毒素,包括肠毒素、溶血素、杀白细胞毒素(lukD E、P V L)、毒性休克综合征毒素(T SS T)等。这些毒力因子因其不同的生物学特性,证实具有不同的致病特 征[1,16-17],体 现 在不同 克 隆株 间明 显 的毒 力 差异[2-4]。金葡菌毒力 的差异不 仅体现 在菌株与 菌 株之间,更与细菌自身进化及宿主因素的影响密切相关[18]。有学者认为,苯唑西林耐药性的获得与金葡菌生物膜形成能力及毒力的降低密切相关[19]。但另有不同研究结果显示,M R S A 与 M SS A 相比,前者具有更强的能力引起医院感染及菌血症[8]。因此,金葡菌耐药性的变化与其毒力变化之间的相关性尚需进一步证实。本研究选用内蒙古呼和浩特地区住院患者分离的60株金葡菌作为研究对象,对M R S A和M SS A之间毒力因子携带差异情况作进一步的分析,发现各种毒力因子呈现出多样化的分布特征,特别是各种肠毒素。其中,M R S A株的sea基因携带率明显高于M SS A株,其他肠毒素基因(sec、seg、sei、sem、sen、seo)的携带率则明显低于M SS A株。针对肠毒力基因分布特征的不同报道,结果差异明显。我国学者以全血标本分离金葡菌进行的研究发现,sea基因在M R S A株中携带率高于M SS A 株,但差异无统计学意义[20]。一项针对浙江和上海地区住院患者分离M R S A和M SS A的研究显示,sea基因在 M RS A和 M SS A中携带率无显著性差异[10]。在另一项相关研究中,M R S A 特征性的携带sec和tst-1基因,这些基因的聚集分布主要与编码这些毒力基因的一些特定可移动基因序列有关,如编码sec、sell和tst-1的Ⅰ型νSa4毒力岛基因以及编码seg、sei、selm、seln和selo的Ⅰ型νSaβ毒力岛基因[21]。这些受试菌株主要是 S T-5-SC C mecⅡ型,而本研究所分析M R S A菌株主要为S T-239型。不同菌株来源及遗传背景的差异可能是造成毒力因子分布差异明显的主要原因之一。进一步针对S T-239型 M R S A毒力因子携带特征的研究有待开展,以更加明确不同感染部位、不同地域环境分离株毒力因子分布的差异及与菌株耐药性演变之间存在的相关性。
菌株的科室分布特征表现为 M R S A 主要集中在IC U、神经外科和骨科病房,而且同一病房不同时间分离菌株呈现高度同源性;同时,骨科病房和普通外科病房金葡菌均分离自术后切口部位或脓液,这些科室患者因其易感性的增加,金葡菌在这些病房中更易传播,感染防控措施应更为加强。
我们同步采用PF G E对60株菌进行了分子分型。结果显示,基因型相近菌株呈现出相近的耐药特征,如K型和M 型均为M R S A 菌株,而 H、I型及其他少见型菌株主要为 M SS A。研究中共检测到4株T SS T阳性菌株,分别分离自伤口分泌物、脓液和全血标本,且均为M SS A。值得注意的是,4株菌均归属于同一基因型I型菌株。这些结果提示,在不考虑菌株分离地域的情况下,依据PF G E分型结果可能初步预测相近菌株的一些生物学特性,特别是毒力特征。
总之,本研究表明呼和浩特地区医院内分离金葡菌基因分型呈多样化特征,M R S A主要分布在K型和 M 型,而M SS A则分布在14个PF G E型中。毒力因子分布在 M R S A 和 M SS A 中差异显著,M SS A毒力基因分布更为丰富,特定毒力因子在M R S A和M SS A株中呈现一定聚集分布特征。这些结果提示,金葡菌特定耐药性的获得可能相应伴随特定毒力特征的变化。关于金葡菌耐药性演变与致病力变化之间的相关性值得进一步研究,以更好指导临床进行金葡菌医院感染防控和治疗。
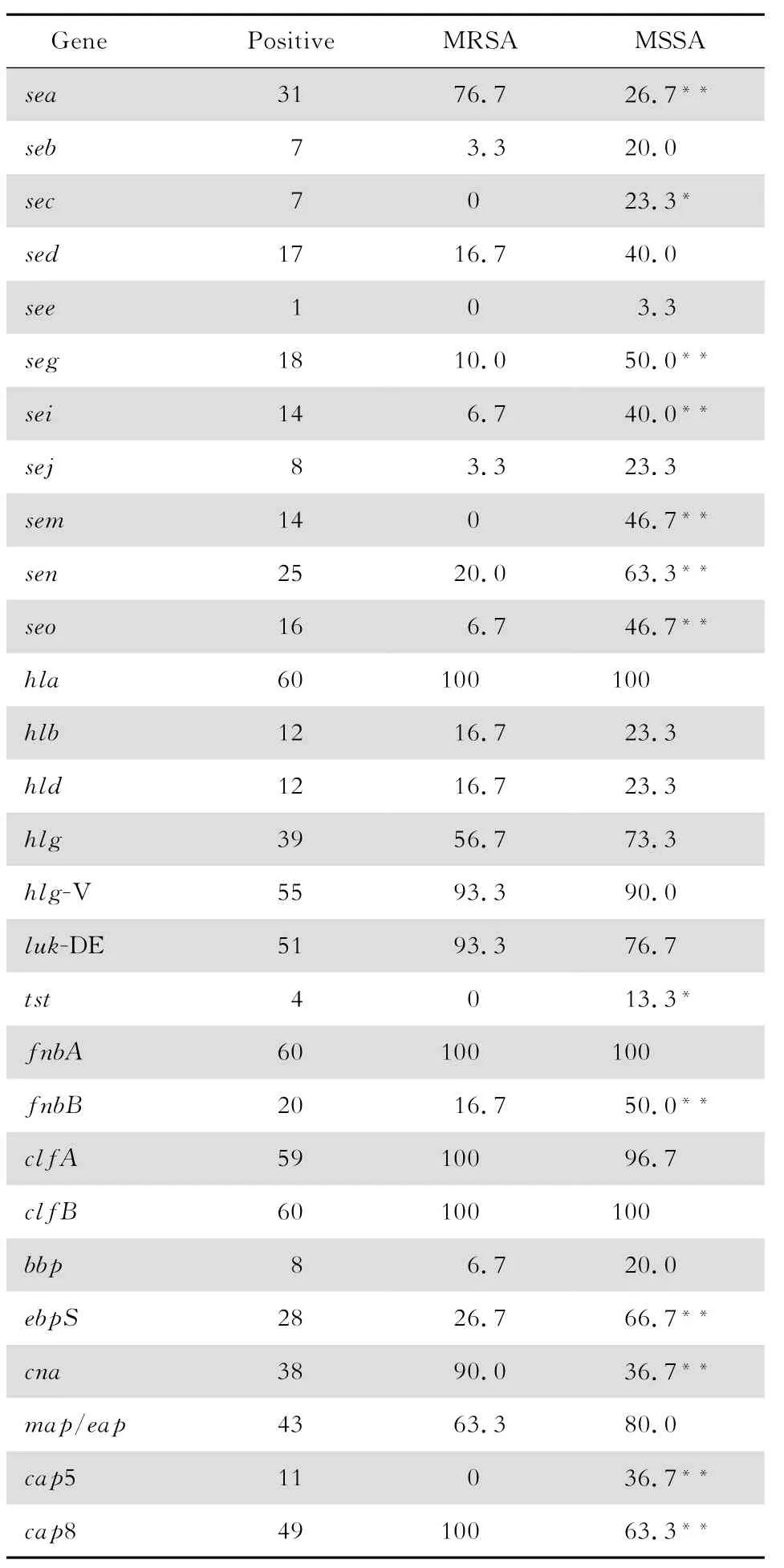
表2 M RS A和M SS A毒力基因携带情况比较Table 2 Co m parison between methicillin-resistant Staphylococcus aureusand methicillin-susceptible Staphylococcus aureusstrains in terms of the prevalence of virulence genes(n=30,%)
[1] Otto M.Staphylococcusaureustoxins[J].Curr O pin Microbiol,2014,17C:32-37.
[2] G haznavi-R ad E,N or Sha m sudin M,Seka wi Z,et al. Predo minance and emergence of clones of hospital-acquired methicillin-resistantStaphylococcus aureusin M alaysia[J].J Clin Microbiol,2010,48(3):867-872.
[3] Shukla S K,Karow M E,Brady J M,et al.Virulence genes and genotypic associations in nasal carriage, co m m unityassociated methicillin-susceptible and methicillin-resistant U S A400Staphylococcusaureusisolates[J].J Clin Microbiol,2010,48(10):3582-3592.
[4] 祝进,陆军,余旭良,等.不同来源耐甲氧西林金黄色葡萄球菌毒力基因的研究[J].检验医学,2012,76(6):475-478.
[5] Oogai Y,M atsuo M,H ashim oto M,et al.Expression of virulence factors byStaphylococcus aureusgrown in seru m[J].A ppl Environ Microbiol,2011,77(22):8097-8105.
[6] Jarraud S,M ougel C,T hioulouse J,et al.Relationships between Staphylococcus aureus genetic background,virulence factors,agr groups(Alleles),and hu man disease[J].Infect Im m un,2002,70(2):631-641.
[7] Jiménez JN,Ocampo A M,Vanegas JM,et al.Characterisation of virulence genesin methicillin susceptible and resistant Staphylococcus aureusisolates fro m a paediatric population in a university hospital of M edellín,Colo m bia[J].M em Inst Oswaldo Cruz,2011,106(8):980-985.
[8] M elzer M,Eykyn SJ,Gransden W R,et al.Is methicillinresistant Staphylococcus aureus m ore virulent than methicillin-susceptibleS.aureus?A co m parative cohort study of British patients with nosoco mial infection and bacteremia[J].Clin Infect Dis,2003,37(11):1453-1460.
[9] Chong YP,Kim ES,Park SJ,et al.Accessory gene regulator(agr)dysfunction inStaphylococcus aureusbloodstrea m isolates fro m South K orean patients[J].A ntimicrob A gents Chem other,2013,57(3):1509-1512.
[10] Fangyou Yu,Tingj ian Li,Xiaoying H uang,et al.Virulence gene profiling and m olecular characterization of hospitalacquiredStaphylococcusaureus isolatesassociated with bloodstream infection[J].Diagn Microbiol Infect Dis,2012,74(4):363-368.
[11] W ong H,L ouie L,L o R Y,et al.C haracterization of Staphylococcus aureusisolateswith a partial or co m plete absence of staphylococcal cassette chro m oso me elements[J].J Clin Microbiol,2010,48(10):3525-3531.
[12] Enright M C,Day N P,Davies C E,et al.M ultilocus sequence typing for characterization of methicillin-resistant and methicillin-susceptible clones ofStaphylococcus aureus[J].J Clin Microbiol,2000,38(3):1008-1015.
[13] Salasia SI,K husnan Z,La m mler C,et al.Co m parative studies on pheno-and genotypic properties ofStaphylococcus aureusisolated fro m bovine subclinical mastitisin central Java in Indonesia and H esse in Germany[J].J Vet Sci,2004,5(2):103-109.
[14] Peacock SJ,M oore CE,Justice A,et al.Virulent combinations of adhesin and toxin genes in natural populations of Staphylococcus aureus [J].Infect Im m un,2002,70(9):4987-4996.
[15] H avaei S A,M oghim S,Bardebari A M,et al.T he co m parison ofStaphylococcus aureustypes 5 and 8with respect to methicillin resistance in patients ad mitted to Al-Zahra H ospital by P C R[J].A dv Bio med Res,2013,2:13.
[16] He W,Liu Y,Qi J,et al.Food-animal related Staphylococcus aureusm ultidrug-resistant ST9 strains with toxin genes[J]. Foodborne Pathog Dis,2013,10(9):782-788.
[17] Naik S,S mith F,H o J,et al.Staphylococcal enterotoxins G and I,a cause of severe but reversible neonatal enteropathy[J].Clin Gastroenterol H epatol,2008,6(2):251-254.
[18] Rudkin JK,Laabei M,Ed wards A M,et al.Oxacillin alters the toxin expression profile of co m m unity-associated methicillin-resistantStaphylococcus aureus [J].A ntimicrob Agents Chem other,2014,58(2):1100-1107.
[19] Pozzi C,W aters E M,Rudkin JK,et al.Methici l l in resistance alters thebiofilm phenotype and attenuates virulence in Staphylococcus aureusdevice-associated infections[J].P LoS Pathog,2012,8(4):e1002626.
[20] Chen X,W ang W K,H an LZ,et al.Epidemiological and Genetic Diversity of Staphylococcus aureus Causing Bloodstrea m Infection in Shanghai,2009-2011[J].P LoS One,2013,8(9):e72811
[21] H u D L,O m oe K,Inoue F,et al.Co m parative prevalence of superantigenic toxin genes in meticillin-resistant and meticillin-susceptibleStaphylococcus aureusisolates[J].J M ed Microbiol,2008,57(Pt 9):1106-1112.
Genotyping and detection of virulence genes for methicillin-resistant and-sensitive Staphylococcus aureus
W A N G Junrui,D UXiaoli,T ALa,C UI Jinghua,F UQuan,H A NYanqiu. (Department of Laboratory M edicine,A ffiliated H ospital of Inner M ongolia M edical U niversity,H ohhot 010050,China)
Objective To elucidate the difference between methicillin-resistantStaphylococcus aureus(M RS A)and methicillinsensitiveS.aureus(M SS A)in terms of genotypes and distribution of virulence genes with the clinical strains isolated fro m H ohhot,and explore the relationship between the changing resistance ofS.aureusand the virulence transition.M ethods Pulsed field gel electrophoresis(PF G E)and m ulti locus sequence typing(M LST)methods were em ployed to do m olecular typing for 30 M RS A strains and 30 M SS A strains isolated fro m inpatients in H ohhot,Inner M ongolia.PC R method was used to profile the distribution of virulence genes am ong these strains.Results PF G E typing results showed that 60S.aureusstrains were classified into 19 major types.M SS A strains belonged to 16 types,mainly types I and H.M RS A strains mainly belonged to types of K and M.A m ong the 20 strains with different PF G E types,M RS A strains were mainly identified as ST-239 type. M SS A strains showed diverse STs and the predo minant types were ST-5,ST-7 and ST-15.The profile of virulence genes was significantly different between M SS A strains and M RS A strains.The overall prevalence of virulence genes in M SS A strains was significantly higher than that in M RS A strains(53.9%versus 40.0%,χ2=32.7,P<0.01).The prevalence ofsea,cnaandcap8 geneswas significantly higher in M RS A strains than in M SS A strains(P<0.01),but the prevalence ofsec,seg,sei,sem,sen,seo,fnbB,ebpSandcap5 was higher in M SS A strains than in M RS A strains(P<0.05).Conclusions The clinical strains ofS.aureusisolated fro mH ohhot showed diverse genotyping features.S T-239 was the major PF G E type of M RS A strains.The prevalence of virulence genes was higher in M SS A strains than in M RS A strains. Characteristic cluster is found for specific virulence genes.The results also suggestthat acquisition of specific antibiotic resistance may be associated with change of specific virulence feature inS.aureus.
Staphylococcus aureus;antibiotic resistance;virulence gene;m olecular typing
R378.11
A
1009-7708(2015)01-0070-06
2014-05-28
2014-07-21
国家自然科学基金(81260244)。
1.内蒙古医科大学附属医院检验科,呼和浩特010050;2.中国疾病预防控制中心传染病预防控制所。
王俊瑞(1981—),男,博士,主治医师,主要从事金黄色葡萄球菌感染致病机制研究。
韩艳秋,E-mail:qyh1016@sina.co m。
