采用耳窥镜直视下气管插管法构建小鼠鲍曼不动杆菌肺炎模型
2015-11-24肖舒心郭蓓宁
肖舒心, 赵 旭, 郭蓓宁
·论著·
采用耳窥镜直视下气管插管法构建小鼠鲍曼不动杆菌肺炎模型
肖舒心, 赵 旭, 郭蓓宁
目的 建立耳窥镜直视下气管插管法,并采用上述方法构建小鼠鲍曼不动杆菌肺炎模型。方法 ①采用美国Braintree公司插管工具盒建立在耳窥镜直视下小鼠气管插管方法;②24只IC R雌性小鼠随机分为正常对照组、免疫缺陷组、免疫缺陷感染组,每组8只,其中免疫缺陷组和免疫缺陷感染组采用环磷酰胺腹腔注射后造成免疫缺陷。3组小鼠在试验当日均按上述方法行气管插管后,免疫缺陷感染组沿气管内插管注射10μL鲍曼不动杆菌(3.2×108C F U/m L),正常对照组和免疫缺陷组沿气管内插管注射10μL生理盐水;每组小鼠均分别于0 h和48 h眼眶后静脉丛取血,观察白细胞、中性粒细胞、淋巴细胞、单核细胞等计数。并在上述时间点各处死4只小鼠,进行小鼠肺组织菌落计数和肺组织病理检查。结果 ①10只小鼠行耳窥镜直视下气管插管,均获成功,无小鼠插管后死亡。沿气管内插管注射菌液浓度为3.0×108C F U/m L,气管插管后0 h处死小鼠取肺并定量,其菌落计数为2.91×107~5.32×107C F U/g肺,平均值±标准差为(4.05×107±0.82×107)C F U/g肺,表明该方法重复性好;②3组小鼠观察48 h,正常对照组和免疫缺陷组小鼠无死亡,免疫缺陷感染组有2只小鼠死亡(2/8)。与正常对照组比较免疫缺陷组和免疫缺陷感染组小鼠在0 h均出现血液白细胞和中性粒细胞计数平均值明显下降(P<0.01);免疫缺陷感染组在感染后即刻(0 h)肺内菌量平均值达4.13×107C F U/g肺,48 h小鼠肺内菌量平均值显著升高达到3.62×1010C F U/g肺,与0 h比较菌量增长近1 000倍(P<0.01),免疫缺陷感染组病理检查结果显示肺组织内局限性肉芽肿形成,肺泡腔内可见脓肿形成。结论 采用耳窥镜直视下气管插管法构建小鼠鲍曼不动杆菌肺炎模型操作简便,成功率高,且注射入小鼠肺内的菌量较恒定,试验重复性好,本研究成功构建了小鼠鲍曼不动杆菌肺炎模型。
鲍曼不动杆菌; 气管插管; 肺炎; 动物模型
鲍曼不动杆菌(Acinetobacter bau m annii)是需氧的不发酵糖革兰阴性杆菌,属条件致病菌,主要引起医院获得性肺炎,尤其是呼吸机相关性肺炎(V A P),亦可引起血流感染、脑膜炎、腹膜炎、伤口感染等多种感染[1]。作为抗感染药物筛选和评价的基础平台,建立鲍曼不动杆菌肺炎模型极其重要。目前通常采用滴鼻法、超声雾化吸入法等构建鲍曼不动杆菌肺炎模型,但以上方法难以保证进入小鼠肺组织的菌量较恒定,故小鼠致病差异大,重复性较差[2-4]。也有部分研究采用手术暴露颈部气管后插管注射细菌的方式,这种方法虽然直观、易操作,但损伤较大[5]。本研究采用在耳窥镜直视下对小鼠进行气管插管,操作简单、动物损伤小、可重复性好、成功率高,并通过这一方法成功构建了小鼠鲍曼不动杆菌肺炎模型,今后可作为研究鲍曼不动杆菌致病性和耐药性的基础平台。
1 材料与方法
1.1 材料
1.1.1 菌株来源 鲍曼不动杆菌 H S-1511为临床分离菌株,分离自复旦大学附属华山医院住院患者脑脊液标本,微量稀释法结果显示该菌对临床常用抗革兰阴性杆菌药物亚胺培南、头孢哌酮-舒巴坦等均耐药,仅对替加环素及多黏菌素敏感。
1.1.2 试剂 环磷酰胺,批号SL B C0666 V,麻醉剂2,2,2-三溴乙醇,批号S T B C1157 V,均购自Sig ma公司;LB Broth培养基,批号14012937 G,L B A gar培养基,批号14012950 G,均购自上海生工公司;生理盐水,批号 W FI21110,旭东海普制药公司生产;甲醛组织固定剂,批号20131022,中山市康乃欣生物医疗科技有限公司生产;苏木精-伊红染色剂,批号120812,上海化学试剂公司生产。白细胞稀释液,批号20110507,南京建成生物工程研究所生产。
1.1.3 实验动物 IC R清洁级小鼠,鼠龄6周左右,体重20~25 g,雌性,合格证号:SC X K(沪):2012-0002,购自上海斯莱克实验动物有限公司。小鼠饲养温度18~25℃,相对湿度50%~70%,本试验使用43只。其中10只行耳窥镜直视下气管插管法,9只预实验,24只构建小鼠肺炎模型。
1.1.4 实验器材及仪器 小鼠气管插管工具盒(图1):美国Braintree公司产品,型号为R W-A3747,包括电池手柄、耳镜头、3.5 m m耳窥镜、门齿环、小鼠气管内导管、喉镜,一次性气管插管(采用B D公司1.1 m m×30 m m 一次性使用静脉留置针);美国Braintree公司生产 啮齿动物工作台,型号 R WA3467;美国New Brunswick科技公司生产摇床,型号innova 4200;瑞士M E T T L E R T O L E D O公司生产分析天平,型号X S205;美国U NIC公司生产紫外可见光分光光度计,型号U V-2102C型;法国Bertin公司precellys 24多功能生物样品组织均质器;日本Nikon公司E2000电子显微镜。
1.2 方法
1.2.1 耳窥镜直视下气管插管法的建立
1.2.1.1 诱导小鼠免疫抑制 根据本课题组既往的研究结果,在实验术前4 d和术前1 d分别采用腹腔注射环磷酰胺200 m g/kg和150 m g/kg后,小鼠血液中性粒细胞计数下降约90%[6]。本试验仍采用上述方法诱导小鼠免疫抑制。

图1 小鼠气管插管工具Figure 1 Mice intubation tools
1.2.1.2 菌液制备 挑取L B平皿上生长的单个鲍曼不动杆菌菌落,置10 m L LB液体培养基中于摇床中37℃、150 r/min振荡培养2 h至A 值0.1左右(600 n m),取5 m L细菌悬液,4℃、4 000 r/min离心10 min,弃上清液后采用生理盐水洗涤并制备菌液,取100μL菌液经系列稀释后接种于LB培养基培养16 h后行菌落计数,菌液浓度约为2.0×108~5.0×108C F U/m L。
1.2.1.3 小鼠气管插管操作步骤 采用美国Braintree公司工具盒建立在耳窥镜直视下小鼠气管插管方法。具体步骤如下:采用1.25%2,2,2-三溴乙醇(25 m g/kg)腹腔注射,待小鼠麻醉后仰卧位固定小鼠于啮齿动物工作台上,采用门齿环一端钩住小鼠门齿,另一端固定于操作台,缓慢倾斜工作台至45°,操作者右手持直头镊牵拉小鼠舌头,左手持带电池手柄的耳窥镜,耳窥镜尖端深入小鼠舌上,透过耳窥镜的放大镜,操作者可观察到小鼠的声门随呼吸而开启、闭合。在小鼠声门开启的瞬间,操作者迅速将已安装气管插管的气管内导管插入气道,并退出导管。将喉镜紧贴气管插管口,若喉镜表面有雾气形成表明插管成功。
1.2.1.4 注射菌液 气管插管成功后,沿气管插管注射10μL鲍曼不动杆菌菌液,吹打3次,确保菌液全部进入小鼠肺部。小鼠在啮齿动物操作台竖立1 min后,缓慢放平操作台,将小鼠放回饲养笼中(图2)。

图2 气管插管及细菌注射过程Figure 2 Intubation and injection of bacterial suspension in mice
1.2.1.5 肺组织细菌定量 待麻醉小鼠全部苏醒,颈椎脱臼法处死小鼠,无菌操作取出小鼠两肺,称重后每0.1 g肺加入0.9 m L生理盐水,组织匀浆机研磨,取100μL经系列稀释后接种于L B培养基培养16 h后行菌落计数,继而计算出每克肺组织的细菌含量。
1.2.2 小鼠鲍曼不动杆菌肺炎模型的建立
1.2.2.1 确定小鼠接种菌量 预实验共9只小鼠,在实验前4 d和前1 d分别采用腹腔注射环磷酰胺200 m g/kg和150 m g/kg诱导小鼠免疫抑制后分为3组,每组3只,第1、2和3组的接种菌量分别为2.8×107、2.8×108和2.8×109C F U/m L。采用上述气管插管法后均注射鲍曼不动杆菌10μL至小鼠肺部,观察24 h内小鼠的死亡情况,第1组和第2组的3只小鼠均存活,第3组小鼠有1只死亡,以24 h内不引起死亡的最大感染剂量作为接种菌量,即108CF U/m L作为构建肺炎模型的接种菌量。
1.2.2.2 构建小鼠肺炎感染模型 24只小鼠随机分为3组,分别为正常对照组、免疫缺陷组、免疫缺陷感染组,每组8只小鼠。其中免疫缺陷组和免疫缺陷感染组在实验前4 d和前1 d分别采用环磷酰胺200 m g/kg和150 m g/kg腹腔注射后造成免疫缺陷。在实验当日(day 0)3组小鼠均按上述方法行气管插管后,免疫缺陷感染组沿插管注射10μL鲍曼不动杆菌(3.2×108CF U/m L),正常对照组和免疫缺陷组沿气管插管注射10μL生理盐水,待小鼠全部苏醒后记为0 h。
1.2.2.3 观察指标 ①小鼠行为学观察,观察小鼠体型、进食、活动、体毛、呼吸等变化情况;②血常规变化观察,所有小鼠于处死前均从眼眶后静脉丛取血,作血涂片并吸取20μL置于380μL白细胞稀释液中行血常规分析,观察白细胞、中性粒细胞、淋巴细胞、单核细胞等计数;③肺组织菌落计数及病理检查。每组8只小鼠分别在0 h、48 h采用颈椎脱臼法处死4只,其中3只采用无菌操作取出小鼠两肺后按照上述方法行菌落计数。余1只处死后取出肺组织采用4%甲醛液固定,石蜡包埋、病理切片、苏木精-伊红(H E)染色,用显微镜观察肺组织的炎性反应和病理改变。若出现自然死亡即刻解剖取出肺组织固定后进行病理检查。
2 结果
2.1 小鼠耳窥镜直视下气管插管法构建成功
10只小鼠行耳窥镜直视下气管插管,均获成功,无小鼠插管后死亡。沿气管插管注射菌液浓度为3.0×108C F U/m L,气管插管后0 h处死小鼠取肺并定量,其菌落计数为2.91×107~5.32×107C F U/g肺,(4.05×107±0.82×107)C F U/g肺,表明该方法重复性好。
2.2 小鼠鲍曼不动杆菌肺炎模型的建立
3组小鼠接种鲍曼不动杆菌菌液浓度为3.2× 108C F U/m L,观察48 h,正常对照组小鼠进食、活动无明显异常。免疫缺陷组小鼠饮食减少、活动减少,但无小鼠死亡。免疫缺陷感染组小鼠表现为嗜睡、呼吸缓慢、弓背、反应迟钝、毛发竖立、光泽度较差易脱落,有2只小鼠(2/8)死亡。3组小鼠血液中白细胞、中性粒细胞计数及肺组织菌落计数见表1。结果显示,与正常对照组比较免疫缺陷组和免疫缺陷感染组小鼠在0 h均出现了血液白细胞和中性粒细胞计数平均值的明显下降(P<0.01),免疫缺陷感染组在感染后即刻(0 h)肺内菌量平均值达4.13 ×107C F U/g肺;与0 h比较,48 h免疫缺陷感染组小鼠肺内菌量平均值显著升高达到3.62×1010C F U/g肺,菌量增长近1 000倍(P<0.01),其白细胞和中性粒细胞计数亦升高(P<0.05)。
病理结果显示:正常对照组肺组织基本正常,肺泡腔开放,内未见异常物质,肺泡壁无增厚,壁内未见炎性细胞等浸润,支气管、血管结构正常;免疫缺陷组小鼠肺组织基本正常,未见坏死、淤血,未见炎性反应以及细胞增生;免疫缺陷感染组小鼠炎性反应强烈,肺间质充血水肿,大量炎性细胞浸润,可见局灶性肉芽肿,支气管周围和肺泡间质内见中性粒细胞、淋巴细胞、巨噬细胞为主的炎性细胞浸润,血管显著扩张、充血伴出血,部分肺泡组织结构崩解,肺泡腔内可见脓肿形成(图3)。

表1 3组小鼠血液中白细胞、中性粒细胞计数及肺组织菌落计数Table 1 The average count of w hite blood cells,neutrophils and pulm onary bacterial burden in three groups of mice
上述观察指标结果提示鲍曼不动杆菌肺炎模型构建成功。
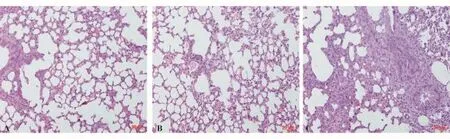
图3 3组小鼠48 h处死后的肺组织病理照片Figure 3 The histopathological pictures of lung tissue fro m 3 groups of mice at 48 h after inoculation
3 讨论
鲍曼不动杆菌目前已经成为医院感染重要的病原菌。根据2012年中国C HIN E T细菌耐药性监测显示,不动杆菌(其中89.6%为鲍曼不动杆菌)检出率在革兰阴性杆菌中位居第3,仅次于大肠埃希菌和克雷伯菌属[7]。随着广谱抗菌药物,特别是碳青霉烯类在临床上的广泛应用,鲍曼不动杆菌耐药性不断增强,多重耐药和泛耐药鲍曼不动杆菌不断增多,给临床治疗带来极大的困难。泛耐药鲍曼不动杆菌(P D R-A B)引起的呼吸机相关性肺炎(V A P)由于缺乏有效药物治疗,且感染此菌的患者绝大部分为终末期患者,免疫力低下,故病死率更高,可达40%~70%[8]。目前尤其重要的是需要构建鲍曼不动杆菌动物感染模型包括肺炎模型,鲍曼不动杆菌肺炎模型作为研究致病性和耐药性的重要基础研究平台,可用于抗感染治疗方案的筛选及评价。
既往建立鲍曼不动杆菌肺炎模型常采用的实验方法有超声雾化、直接滴鼻及手术暴露颈部气管后插管或直接注射法等3种感染途径。滴鼻法操作可控性差,细菌可能通过鼻腔进入消化道,小鼠间个体差异较大,故重复性、可靠性较差[2]。超声雾化法模拟临床肺炎感染过程较好,操作也较简单,但小鼠由于个体差异,吸入肺内菌量差异仍较大,难以保证进入小鼠肺组织的菌量在同一个数量级范围,故初始时小鼠肺部的细菌计数差异较大,形成感染的严重程度可能差别也较大,不利于作为新药评价基础研究平台的操作标准化[3]。手术暴露颈部气管后插管或直接注射细菌的方式直观、易操作,注射入小鼠肺内的细菌量较恒定,但损伤较大,操作不慎容易损伤邻近的食管、血管等组织,且无菌操作要求高,稍有不慎可能污染其他细菌,对操作人员要求较高,操作上有一定困难,难以重复[4]。
曾有文献报道采用在头戴式放大镜直视下进行小鼠气管插管法[5],此方法为非手术气管插管法,操作简单、成功率高、重复性好,可采用此方法构建鲍曼不动杆菌肺炎模型。但该研究中采用的气管插管、小鼠固定及口腔撑开装置均为自制工具,无商品销售,给其他试验者重复相同试验带来困难。
本课题组在国内首先引进了美国Braintree公司的小鼠气管插管工具盒及啮齿动物工作台进行气管插管,此方法在国外已成熟应用。此套工具设计精细,方便购买,实验操作简单、成功率高,且注射入小鼠肺内的菌量较恒定。本试验中10只小鼠注射细菌后即刻处死,肺内菌量经培养为(2.91×107~5.32×107)C F U/g肺,平均值(4.05×107±0.82× 107)C F U/g肺,最大量和最小量差别仅1.83倍,提示重复性好,易标准化,今后可用于如铜绿假单胞菌、肺炎克雷伯菌等其他细菌小鼠肺炎模型的建立。
由于鲍曼不动杆菌的毒力较低,正常小鼠可凭借其免疫系统将接种细菌清除,很难造成感染,通常构建小鼠感染模型时需要使用免疫抑制剂。由于中性粒细胞在宿主抵抗鲍曼不动杆菌感染中起重要作用,故本试验中采用腹腔注射环磷酰胺200 m g/kg和150 m g/kg诱导小鼠免疫抑制后,导致小鼠中性粒细胞缺乏,无法吞噬肺泡内细菌,造成小鼠肺部感染[9]。注射细菌48 h首先观察到小鼠行为异常如嗜睡、呼吸缓慢、反应迟钝等,同时有2只小鼠死亡,其次小鼠肺内鲍曼不动杆菌由4.13×107C F U/g肺,增殖至3.62×1010CF U/g肺,细菌量增长了约1 000倍,最后病理结果提示小鼠肺内炎性反应强烈,肺间质充血水肿,大量炎性细胞浸润,有局灶性肉芽肿及肺内脓肿形成。上述阳性结果提示本次采用耳窥镜直视下气管插管法构建小鼠鲍曼不动杆菌肺炎模型成功,可以采用此模型进一步研究鲍曼不动杆菌的感染途径和防治措施。
[1] M cConnell M J,Actis L,Pachon J.Acinetobacter bau mannii:hu man infections,factors contributing to pathogenesis and animal m odels[J].F E M S Microbiol Rev,2013,37(2):130-155.
[2] K napp S,Wieland C W,Florquin S,et al.Differentialroles of C D14 and toll-like receptors 4 and 2 in m urineAcinetobacter pneu monia[J].A m J Respir Crit Care M ed,2006,173(1):122-129.
[3] Joly-Guillou M L,W oLff M,Poeidalo JJ,et al.Use of a new m ousem odelofAcinetobacter bau m annii pneu m oniato evaluate the postantibiotic effect of Imipenem[J].A ntimicrob Agents Chem other,1997,41(2):345-351.
[4] 余道军,俞云松,方翔,等.亚胺培南耐药鲍曼不动杆菌小鼠肺部感染模型建立[J].中华检验医学杂志,2010,33(8):771-775.
[5] 曹婕,高润娣,李和权,等.在头戴式放大镜直视下小鼠气管插管方法的建立[J].中国药理学通报,2012,28(5):729-731.
[6] Guo B,Abdelraouf K,Ledesma K R,et al.Quantitativeimpact of neutrophils on bacterial clearance in a m urine pneu m onia m odel[J].A ntimicrob A gents Chem other,2011,55(10):4601-4605.
[7] 汪复,朱德妹,胡付品,等.2012年中国C HIN E T细菌耐药性监测[J].中国感染与化疗杂志,2013,13(5):321-330.
[8] Garnacho J,Sole-Violan J,Sa-Borges M,et al.Cl inicalimpact of pneu m onia caused byAcinetobacter bau m anniiin intubated patients:a matched cohort study[J].Crit Care M ed,2003,31(10):2478-2482.
[9] van Faassen H,K uoLee R,H arris G,et al.Neutrophils play an im portant role in host resistance to respiratory infection withAcinetobacter bau m anniiinmice[J].Infect Im m un,2007,75(12):5597-5608.
Establish ment of a m urine model ofAcinetobacter baumanniipneu monia with a new intubation method
XIA O Shuxin,Z H A OX u,G U OBeining. (Institute ofA ntibiotics,H uashanH ospital,Fudan University,Key Laboratory of Clinical P harm acology of A ntibiotics,N ational H ealth and Fa mily Planning Com mission,Shanghai 200040,China)
Objective To construct a new intubation method with an otoscope and establish a m urine m odel ofAcinetobacter bau m anniipneu m onia with this method.M ethods Part I:The H allowell Intubation Pack for mice(Braintree Scientific Inc.,U S A)was used to construct a new intubation method with an otoscope.Part II:T wenty-four female IC R mice were rando mized into 3 groups including control(group 1),im m unosuppression(group 2)and infection after im m unosuppression groups(group 3),with 8 mice in each group.The mice were treated with cyclophosphamide(C T X)by peritonealinjection to induce im m unodeficiency in groups 2 and 3. O n the experiment day(day 0),the mice were intubated using the new method,then the mice in group 3 were inoculated with 10μL of freshAcinetobacter bau m anniisuspension(3.2× 108C F U/m L)through endotracheal tube,those in other 2 groups were inoculated with 10μL of sterile saline.Blood(approximately 200μL)was draw n at 0 h and 48 h via theposterior orbital venous plexus.The total nu m ber of w hite blood cells,the nu m ber of neutrophils and the percentage of neutrophils were determined.Four mice were sacrificed at 0 h and 48 h after inoculation in each group.Then the lungs fro m each m ouse were aseptically collected for quantitative culture and histopathology.Results Part I:Ten mice were successfully intubated using the new method and none of the mice was dead.Pulm onary bacterial culture at baseline(0 h)was(2.91×107-5.32×107)C F U/g tissue,w hile the mean±standard deviation was(4.05×107±0.82×107)C F U/g tissue.The results showed that this new method had a perfect repeatability.Part II:Over 48 h,2 mice were dead in group 3,w hile no m ouse was dead in other 2 groups.For group 3,the average pulm onary bacterial culture was 4.13×107C F U/g tissue at 0 h and reached 3.62×1010C F U/g tissue at 48 h(increased appropriate 1 000 times,P<0.01).The histopathologic changes in lung showed local granulo mas and abscess in the alveolar space.Conclusions Intubation under the guidance of otoscope had the advantages of high repeatability and easy to operate.A dditionally,the method provided stable and consistent bacterialinocula into lungs.The m urine m odel ofAcinetobacter bau m anniipneu m onia was successfully established with a new intubation method under the guidance of otoscope.
Acinetobacter bau m annii;intubation;pneu m onia;animal m odel
R378
A
1009-7708(2015)01-0051-06
2014-05-28
2014-07-22
上海市科委实验动物研究专项基金(12140903203)。
复旦大学附属华山医院抗生素研究所,卫生部抗生素临床药理重点实验室,上海 200040。
肖舒心(1986—)女,在读硕士,主要从事细菌致病性及耐药机制的研究。
郭蓓宁,E-mail:guobeining@aliyun.co m。
