2015年10月美国和欧盟新批准药物概述
2015-11-24孙友松
孙友松
·世界上市新药·
2015年10月美国和欧盟新批准药物概述
孙友松

编者按:《药学进展》自2015年第9期开始,每期推出当月美国、欧盟和日本新批准药物及研发进展系列报道,向读者及时、全面地介绍全球新药研发动态,为从事药物研发的人员提供参考,启迪思路。
2015年10月,美国、欧盟共批准25个新药,包括新分子实体、新有效成分、新生物制品、新增适应证及新剂型药物。对全球首次获得批准的新分子实体、新有效成分、新生物制品进行分析,重点介绍这些药物的临床研究结果和研发历史进程。
新药批准;临床试验;新分子实体;新生物制品
1 2015年10月美国FDA新批准药物
2015年10月,美国FDA共批准22个药物,包括2个全球首次批准的新分子实体(月桂酰阿立哌唑、patiromer)、1个美国首次批准的新分子实体(曲贝替定)和3个全球首次批准的生物制品(Praxbind®、Coagadex®、Imlygic®),此外还有5个新增适应证药物、5个新剂型和1个新复方制剂(见表1)。
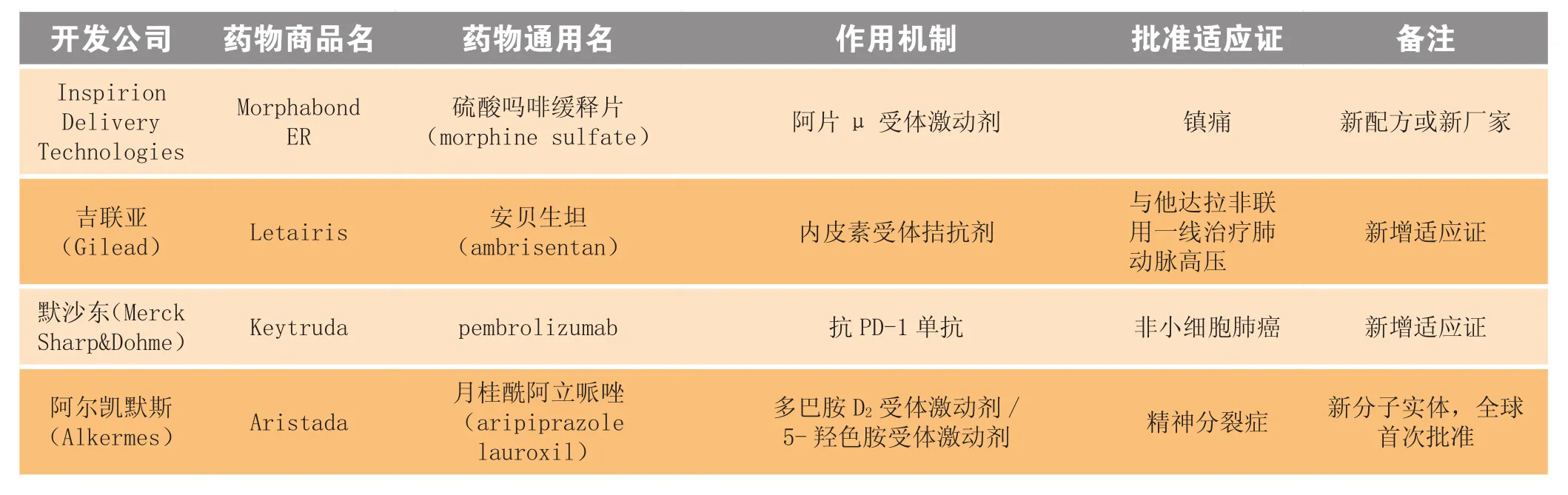
表1 2015年10月美国FDA新批准药物Table 1 New drugs approved by FDA in October 2015
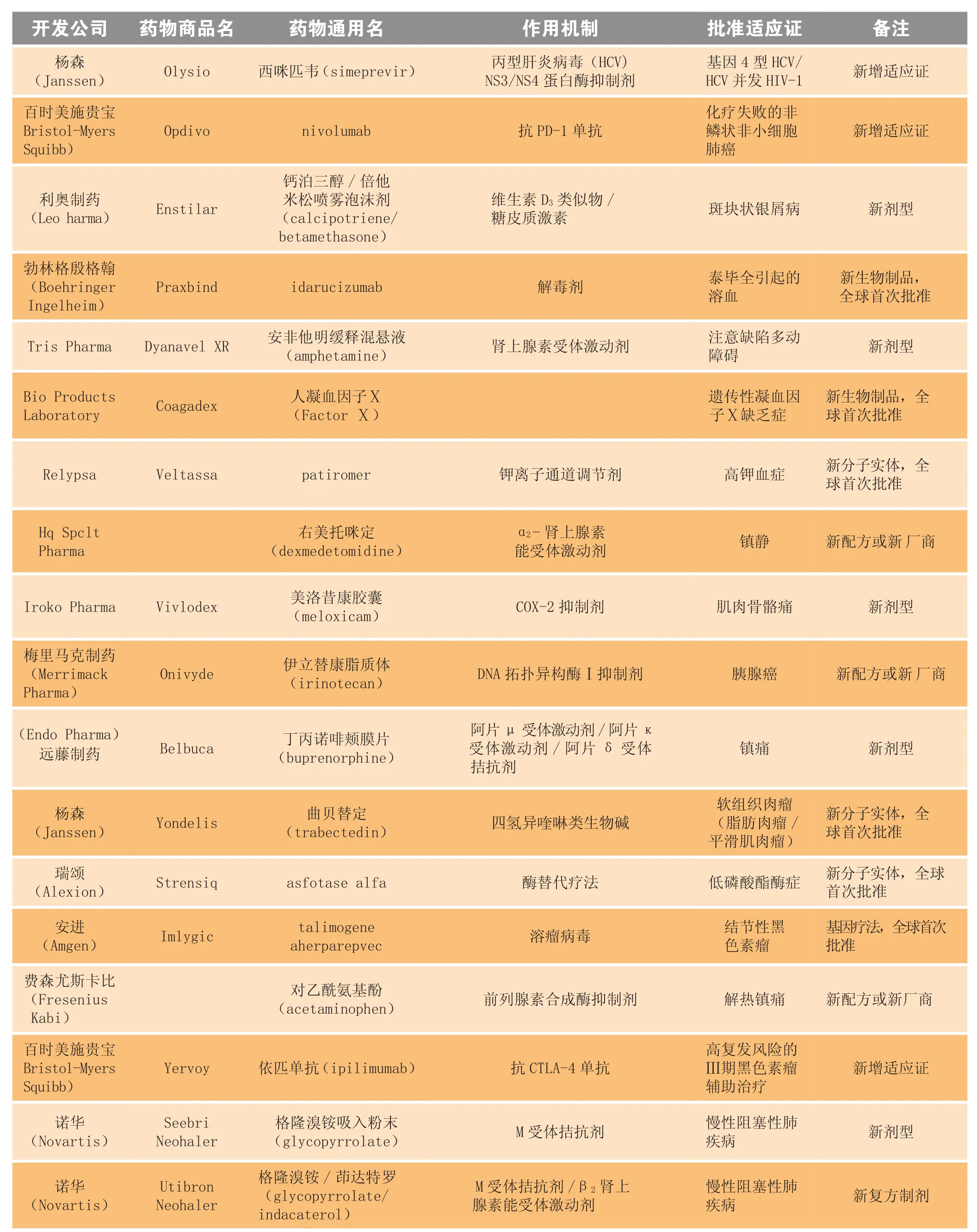
续表1
1.1 Pembrolizumab
Pembrolizumab是一种全人源化抗PD-1单克隆抗体,由默沙东公司开发,商品名Keytruda®。该药最早于2014年9月在美国获批,单用二线治疗晚期恶性黑色素瘤。2015年10月2日美国FDA加速批准其第2类适应证,单用二线治疗PD-L1表达的鳞状和非鳞状非小细胞肺癌,同时美国FDA还批准了Dako公司PD-L1体外诊断试剂IHC 22C3 pharmDx。
此次加速批准基于一项多中心队列开放式大型Ⅰb期KEYNOTE-001研究(NCT01295827)部分结果,在61例PD-L1表达的非小细胞肺癌患者中,25例患者部分应答,pembrolizumab总缓解率达41%。在25例应答患者中,21例患者持续应答,11例患者使用pembrolizumab半年以上仍有应答[1]。除肿瘤客观有效率和持久应答率数据外,默沙东于2014年开展了一项多中心随机对照开放式Ⅲ期KEYNOTE-042研究(NCT02220894),与卡铂+紫杉醇化疗方案或卡铂+培美曲塞化疗方案对比,主要终点指标为总生存期(overall survival, OS),次要终点指标为无进展生存期(progression-free survival, PFS),预计2018年默沙东将公布研究结果。
1.2 Nivolumab
Nivolumab是一种全人源化抗PD-1单克隆抗体,由百时美施贵宝公司开发,商品名Opdivo®。该药是历史上首个获得批准的抗PD-1单克隆抗体,最早于2014年7月在日本获批,用于治疗不可切除或转移性晚期恶性黑色素瘤。2014年12月和2015年3月,FDA先后批准其用于二线治疗晚期恶性黑色素瘤和鳞状非小细胞肺癌,并于2015年10月9日批准其用于二线治疗非鳞状非小细胞肺癌。
批准鳞状非小细胞肺癌适应证基于CheckMate-017研究和CheckMate-063研究结果,批准非鳞状非小细胞肺癌适应证基于CheckMate-057研究结果。CheckMate-017是一项多中心随机对照开放性Ⅲ期临床研究(NCT01642004),共招募272例鳞状非小细胞肺癌患者,与多西他赛头对头,结果显示,与多西他赛治疗组相比,nivolumab治疗组患者总生存期显著延长(9.2个月 vs 6个月)。CheckMate-063是一项多中心单臂开放性Ⅱ期临床研究,共招募117例鳞状非小细胞肺癌患者,17例患者部分应答,客观应答率(objective response rate, ORR)15%,达临床研究主要终点。CheckMate-057是一项多中心随机对照开放性Ⅲ期临床研究(NCT01673867),共招募582例非鳞状非小细胞肺癌患者,与多西他赛头对头,结果显示,与多西他赛治疗组相比,nivolumab治疗组患者总生存期显著延长(12.2个月 vs 9.4个月),达临床研究主要终点;nivolumab治疗组和多西他赛治疗组客观应答率分别为19%和12%,达临床研究次要终点[2]。
自2011年百时美施贵宝公司抗CTLA-4单克隆抗体ipilimumab获批治疗恶性黑色素瘤以来,肿瘤免疫疗法关注度逐日提升,百时美施贵宝公司抗PD-1单克隆抗体nivolumab、默沙东公司抗PD-1单克隆抗体pembrolizumab和安进公司双特异性抗体blinatumomab相继获批。截至2015年10月仅nivolumab和pembrolizumab获批了非小细胞肺癌适应证,其中nivolumab适应证为鳞状和非鳞状非小细胞肺癌,pembrolizumab适应证为PD-L1表达的鳞状和非鳞状非小细胞肺癌,pembrolizumab比nivolumab少了PD-L1阴性非小细胞肺癌适应证人群,但这类适应证人群数目远低于PD-L1阳性人群。肺癌领域是抗PD-1单克隆抗体最大的市场,由于pembrolizumab仅有Ⅰb期单臂试验客观应答率数据,而无总生存期数据,在与nivolumab竞争中将会处于劣势。
肿瘤免疫疗法竞争已进入白热化阶段,未来肿瘤免疫疗法复方将是竞争的主战场。抗PD-1单克隆抗体方面,nivolumab已与包括TGF-β抑制剂galunisertib、抗CCR4单克隆抗体mogamulizumab、IDO1抑制剂epacadostat等药开展联用研究,pembrolizumab也已与包括PARP抑制剂niraparib、ALK抑制剂克唑替尼、CSF-1R抑制剂pexidartinib等开展联用研究。抗PD-L1单克隆抗体方面,durvalumab已与包括EGFR抑制剂rociletinib、HDAC抑制剂mocetinostat等开展联用研究,atezolizumab也已与HDAC抑制剂恩替诺特开展联用研究。但肿瘤免疫疗法联用也有一定的风险,在有效性提高的同时,安全性问题也会更加突出。
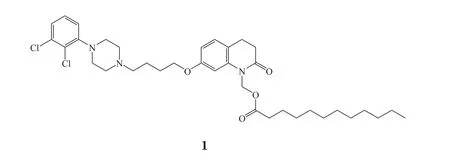
1.3 月桂酰阿立哌唑
月桂酰阿立哌唑(aripiprazole lauroxil, 1)是一种长效非典型抗精神病药物,通过部分激活多巴胺D2受体和5-羟色胺受体而发挥作用,由阿尔凯默斯(Alkermes)公司开发。2015年10月5日FDA全球首次批准月桂酰阿立哌唑缓释注射混悬液用于治疗精神分裂症,商品名Aristada®,每月或每6周注射1次,但FDA在批准月桂酰阿立哌唑时附加了一个黑框警告,警示老年痴呆相关精神病患者使用此药会增加死亡风险,月桂酰阿立哌唑不可用于痴呆相关精神病患者[3]。月桂酰阿立哌唑是日本大冢公司已上市精神分裂症药物阿立哌唑(安绿凡)的前药,在体内可转换为阿立哌唑从而发挥药效,安律凡最早于2002年在美国上市。
阿尔凯默斯公司针对精神分裂症开展了一项多中心随机双盲对照Ⅲ期临床研究(NCT01469039),共招募623例精神分裂症患者,以用药85天阳性与阴性症状量表(Positive and Negative Syndrome Scale,PANSS)评分降低值为主要终点评价指标。结果显示,与安慰剂组相比,月桂酰阿立哌唑每月441 mg剂量组PANSS评分平均降低10.9分,月桂酰阿立哌唑每月882 mg剂量组平均降低11.9分(P <0.001),达到研究主要终点。该研究亦达到用药12周临床总体印象改善量表(Clinical Global Impression- Improvement,CGI-I)评分次要终点,主要不良反应为失眠、头痛和静坐不能[4]。
1.4 Idarucizumab
Idarucizumab(Praxbind®)是抗凝血药达比加群酯(泰毕全®)的特异性逆转剂,由勃林格殷格翰公司开发,2015年10月16日在使用达比加群酯后导致大出血时使用[5]。达比加群酯先后于2008年、2010年和2011年在欧盟、美国和日本获批,idarucizumab是首个获批的达比加群酯特异性逆转剂。
此次批准基于一项安全性Ⅰ期临床研究和RE-VERSE ADⅢ期临床研究(NCT02104947)中期分析结果。Ⅰ期临床研究共招募283例健康志愿者,先使用达比加群酯再使用idarucizumab,结果显示idarucizumab作用迅速,效果好且使用后不会出现反转。RE-VERSE ADⅢ期临床研究共招募123例使用达比加群酯后发生无法控制的出血或需要紧急手术的患者,中期分析结果显示idarucizumab作用迅速,且约有一半的患者达到了最大程度的逆转。
2014年6月FDA授予idarucizumab突破性疗法认定资格,2015年9月欧盟人用药品委员会(Medicinal Products for Human Use, CHMP)也已推荐欧盟委员会批准idarucizumab。
1.5 人凝血因子Ⅹ
Bio Products Laboratory公司开发的高纯度凝血因子Ⅹ于2007年8月获美国FDA批准授予其孤儿药资格。2015年10月20日,FDA在全球率先批准该生物制品,用于控制12岁及以上遗传性凝血因子Ⅹ缺乏症患者的出血症状,或减轻患者围手术期轻度出血症状,商品名Coagadex®[6]。
此次批准基于两项Ⅲ期临床研究(NCT00930176和NCT01086852)结果。2010年,Bio Products Laboratory公司启动了一项多中心、前瞻性、开放性Ⅲ期临床研究(NCT00930176),主要终点指标为治愈率和血浆半衰期,次要终点指标为整体效能评估和最低有效剂量,共招募16例遗传性凝血因子Ⅹ缺乏症患者,研究结果显示达到治疗指标。2011年,Bio Products Laboratory公司启动另一项多中心、开放性Ⅲ期临床研究(NCT01086852),共招募4例围手术期轻度出血症状凝血因子Ⅹ缺乏症患者,结果显示Coagadex®可有效控制患者轻度出血症状。两项研究均未出现安全性问题。
1.6 Patiromer
Patiromer(Veltassa®)是一种口服混悬剂,可与胃肠道中的钾结合,降低钾的吸收水平。该药由Relypsa公司开发,2015年10月21日FDA批准其用于治疗充血性心力衰竭患者急性和慢性高钾血症,但FDA在批准时附加了一个黑框警告,称patiromer会与其他口服药物结合并影响其吸收和药效,服用该药必须与其他口服药物间隔6 h以上[7]。
该项批准基于一项Ⅲ期临床研究和一项Ⅱ期临床研究。Relypsa公司针对高钾血症开展了一项单盲OPALHKⅢ期临床研究(NCT01810939),共招募243例患者,研究结果显示patiromer给药治疗4周后患者血钾水平趋于正常。此外,Relypsa公司还开展了一项多中心随机开放性AMETHYST-DNⅡ期临床研究,共招募306例患者,研究结果显示patiromer给药治疗52周后患者血钾水平趋于正常。
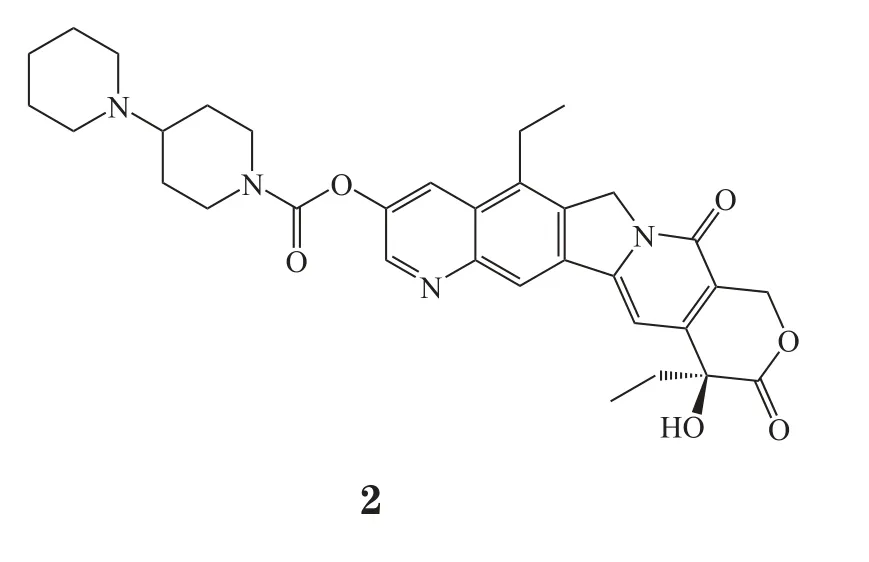
1.7 伊立替康脂质体
注射用伊立替康(2)脂质体(实验室代号为MM-398)由梅里马克(Merrimack)制药公司和台湾智擎生技(PharmaEngine)制药公司共同开发,美国FDA和中国台湾FDA于2015年10月24日同一天批准其与氟尿嘧啶和亚叶酸钙联用,二线治疗晚期或转移性胰腺癌,商品名为Onivyde®。根据美国国家癌症研究所(National Cancer Institute,NCI)数据,胰腺癌早期诊断困难,2015年,美国年新增胰腺癌确诊病例数约48 960人,年死亡病例数约40 560人[8]。
此次批准基于一项多中心随机对照开放性NAPOLI-1Ⅲ期临床研究,共招募417例已接受吉西他滨化疗的胰腺癌患者,患者分为3组,分别服用Onivyde+ 5-氟尿嘧啶+亚叶酸、Onivyde和胰腺癌二线疗法5-氟尿嘧啶+亚叶酸。结果显示,Onivyde+ 5-氟尿嘧啶+亚叶酸组总生存期和无进展生存期分别为6.1个月和3.1个月,5-氟尿嘧啶+亚叶酸组总生存期和无进展生存期分别为4.2个月和1.5个月。
1.8 曲贝替定
曲贝替定(trabectedin, 3)是从海鞘中提取的四氢异喹啉类生物碱衍生物,也是为数不多的海洋来源抗肿瘤药。由杨森公司(Janssen)开发,于2007年在欧盟等地区获批。2015年10月23日,美国FDA批准曲贝替定用于治疗2种软组织肉瘤:脂肪肉瘤和平滑肌肉瘤。软组织肉瘤是一种起源于肌肉、肌腱、脂肪、血管、淋巴管、神经等软组织的癌症,根据NCI数据,2014年软组织肉瘤年新增确诊病例数约12 000人,年死亡病例数约4 870人[9]。
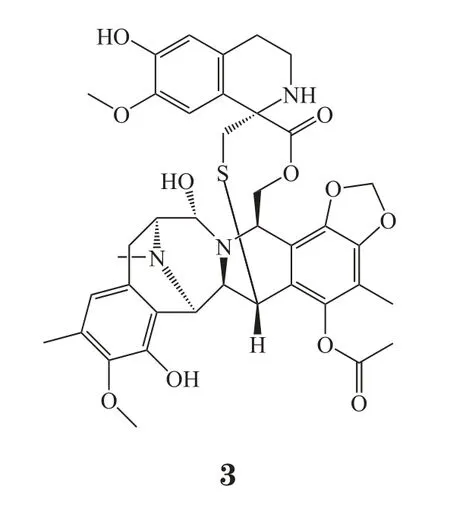
此次批准基于一项多中心、随机、对照ET743-SAR-3007Ⅲ期临床研究(NCT01343277),共招募579名已经化疗治疗的软组织肉瘤患者,患者分为曲贝替定治疗组和氮烯唑胺治疗组,结果显示,与氮烯唑胺治疗组相比,曲贝替定治疗组患者无进展生存期明显延长(4.2个月vs 1.5个月),研究达到主要临床研究终点。
1.9 Asfotase alfa
Asfotase alfa是一种重组融合蛋白,由Enobia 公司开发,2012年日本瑞颂(Alexion)公司收购Enobia,获得asfotase alfa的商业化权利。2015年7月6日,asfotase alfa最早在日本获得批准,作为低磷酸酯酶症(hypophosphatasia)的酶替代疗法,随后该药又在加拿大和欧洲获得批准。2015年10月23日,美国FDA批准asfotase alfa用于治疗新生儿型/婴儿型/儿童型低磷酸酯酶症,商品名为Strensiq®。Asfotase alfa也是美国批准的首个低磷酸酯酶症治疗药物,FDA批准的同时授予瑞颂公司一张可交易的罕见儿科疾病优先审评券(rare paediatric priority review voucher)[10]。
此次批准基于4项前瞻性临床研究及其延伸性研究的临床数据。研究结果显示,新生儿型/婴儿型低磷酸酯酶症患者使用asfotase alfa 48周后,通过Ⅹ射线检测软骨病的严重程度,发现asfotase alfa对患者骨矿物质化具有快速和持久的疗效,利用Kaplan-Meier法分析,asfotase alfa治疗组的总生存率高达97%,而现有疗法对照组的总生存率仅为42%;儿童型低磷酸酯酶症患者使用asfotase alfa 54周后,asfotase alfa治疗组的总生存率高达100%,而现有疗法对照组的总生存率仅为6%。
低磷酸酯酶症是一种常见的酶缺乏性疾病,多为常染色体隐性遗传,少数为常染色体显性遗传。多发于小儿,患者血液、肝脏、骨骼和肾脏组织中碱性磷酸酶活性低,骨化不全易骨折,尿液中磷酰乙醇氨增高。此前该疾病没有特效疗法,通常仅对症治疗以减轻症状,如用高磷酸盐治疗,继发高钙血症患者予以低钙饮食和用可的松治疗[11]。
2 2015年10月欧盟新批准药物
2015年10月,欧盟委员会(European Commission,EC)共批准3个药物,包括1个欧盟首次批准药物(艾沙康唑)和2个新增适应证药物(见表2)。

表2 2015年10月欧盟新批准药物Table 2 New drugs approved by European commission in October 2015
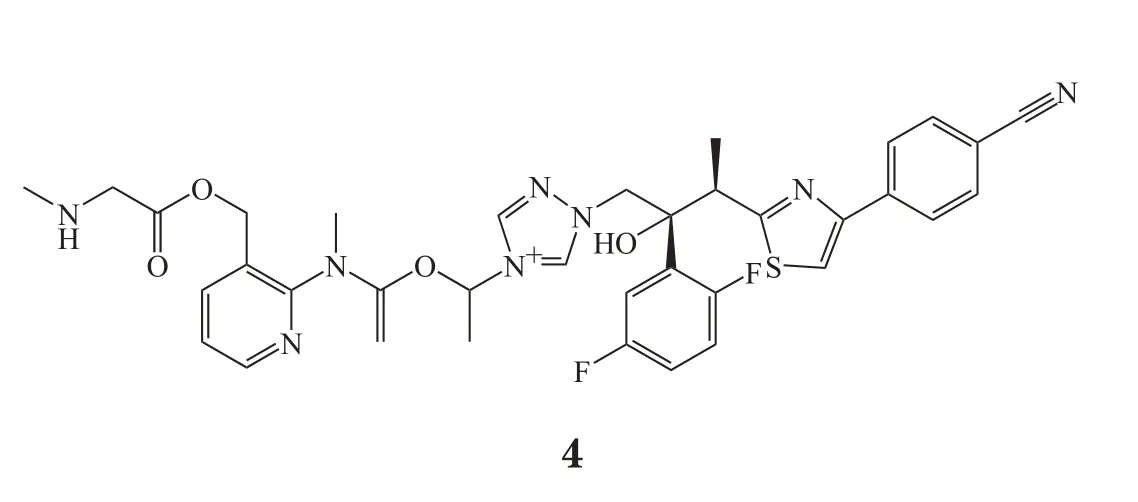
艾沙康唑(isavuconazole, 4)是一种新型抗真菌药物,由巴塞利亚(Basilea)制药公司开发,商品名Cresemba®,美国FDA于2014年7月授予该药合格传染病药品(Qualified Infectious Disease Product, QIDP)资格,并于2015年3月批准用于治疗曲霉病和接合菌病。2015年10月15日欧盟委员会批准艾沙康唑用于治疗成年患者两性霉素B不适用的曲霉病和接合菌病。这也是巴塞利亚公司继头孢托罗酯后第2个获得欧盟委员会批准的药物[12]。
此次批准基于两项Ⅲ期临床研究结果。2006年巴塞利亚公司启动了一项多中心、随机、双盲SECUREⅢ期临床研究(NCT00412893),共招募516例侵袭性曲霉病患者,与辉瑞公司伏立康唑(voriconazole)对照,艾沙康唑42天全因死亡率(all-cause mortality)呈非劣性(18.6% vs 20.2%);2008年巴塞利亚公司启动了一项多中心开放性VITALⅢ期临床研究(NCT00634049),共招募109例侵袭性曲霉病患者和37例侵袭性毛霉菌病患者,在其中的21例侵袭性毛霉菌病患者中,艾沙康唑治疗组总响应率(overall response rate)为32%,研究达到主要终点考察指标。
[1]Merck. FDA Approves KEYTRUDA®(pembrolizumab) for the treatment of patients with metastatic non-small cell lung cancer whose tumors express PD-L1 with disease progression on or after platinumcontaining chemotherapy[EB/OL]. (2015-10-02) [2015-10-05]. http:// www.mercknewsroom.com/news-release/prescription-medicine-news/ fda-approves-keytruda-pembrolizumab-treatment-patients-metas.
[2]Bristol-Myers Squibb. Bristol-Myers Squibb’s Opdivo (nivolumab)receives expanded FDA approval in previously-treated metastatic non-small cell lung cancer (NSCLC), offering improved survival to more patients[EB/OL]. (2015-10-09) [2015-10-12]. http://news.bms. com/press-release/bristol-myers-squibbs-opdivo-nivolumab-receivesexpanded-fda-approval-previously-treat.
[3]Alkermes. FDA Approves ARISTADA™ for treatment of schizophrenia[EB/OL]. (2015-10-05)[2015-10-06]. http://phx.corporate-ir.net/ phoenix.zhtml?c=92211&p=irol-corporateNewsArticle&ID=2094281.
[4]Meltzer H Y, Risinger R, Nasrallah H A, et al. A randomized, doubleblind, placebo-controlled trial of aripiprazole lauroxil in acute exacerbation of schizophrenia[J]. J Clin Psychiatry, 2015, 16(8): 1085-1090.
[5]FDA. FDA approves Praxbind, the first reversal agent for the anticoagulant Pradaxa[EB/OL]. (2015-10-16)[2015-10-18].http://www.fda.gov/ NewsEvents/Newsroom/PressAnnouncements/ucm467300.htm.
[6]FDA. FDA approves first factor X concentrate to treat patients with rare hereditary bleeding disorder[EB/OL]. (2015-10-20)[2015-10-22]. http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ ucm468038.htm.
[7]FDA. FDA approves new drug to treat hyperkalemia[EB/OL]. (2015-10-21)[2015-10-25]. http://www.fda.gov/NewsEvents/Newsroom/ PressAnnouncements/ucm468546.htm.
[8]FDA. FDA approves new treatment for advanced pancreatic cancer[EB/ OL]. (2015-10-22)[2015-10-25]. http://www.fda.gov/NewsEvents/ Newsroom/PressAnnouncements/ucm468654.htm.
[9]FDA. FDA approves new therapy for certain types of advanced soft tissue sarcoma[EB/OL]. (2015-10-23)[2015-10-25]. http://www.fda.gov/ NewsEvents/Newsroom/PressAnnouncements/ucm468832.htm.
[10]Alexion. FDA Approves StrensiqTM(asfotase alfa) for treatment of patients with perinatal-, infantile- and juvenile-onset hypophosphatasia(HPP)[EB/OL]. (2015-10-23)[2015-10-24]. http://ir.alexionpharm.com/ releasedetail.cfm?ReleaseID=938210.
[11]Millán J L, Narisawa S, Lemire I, et al. Enzyme replacement therapy for murine hypophosphatasia[J]. J Bone Miner Res, 2008, 23(6): 777-787.
[12]Basilea. Basilea announces that European Commission approves isavuconazole (CRESEMBA®) as a treatment for invasive aspergillosis and mucormycosis in the European Union[EB/OL]. (2015-10-16)[2015-10-20]. http://www.basilea.com/News-and-Media/Basilea-announcesthat-European-Commission-approves-isavuconazole-CRESEMBA-as-a-treatment-for-invasive-aspergillosis-and-mucormycosis-in-the-European-Union/1c973f43-6bf6-e9c0-acc7-a28994a4cbc3.
A n Overview of New Drugs Approved in the US and EU in October 2015
SUN Yousong
In October 2015, US Food and Drug Administration(FDA) and European Commission had totally approved 25 new drugs, including new molecular entities, new active ingredient, new biologics and new line extensions(new indications and new formulations). In this article, new molecular entities, new active ingredients and new biologics receiving their first global approval were analyzed with emphasis on the outcomes of clinical trials and development histories.
drug approval; clinical trial; new molecular entity; new biologics
R97
A
1001-5094(2015)10-0794-07
