致病性副溶血弧菌三重PCR检测方法的建立和评价
2015-11-23何再平陈永军刘迎春韩先干王少辉白雪瑞刘永杰
何再平,王 权,陈永军,刘迎春,韩先干,王少辉,白雪瑞,刘永杰,蒋 蔚
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 南京农业大学动物医学院 农业部动物疫病诊断与免疫重点开放实验室,南京 210095)
·研究论文·
致病性副溶血弧菌三重PCR检测方法的建立和评价
何再平1,2,王 权1,陈永军1,刘迎春1,韩先干1,王少辉1,白雪瑞1,2,刘永杰2,蒋 蔚1
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 南京农业大学动物医学院 农业部动物疫病诊断与免疫重点开放实验室,南京 210095)
根据副溶血弧菌种特异性基因(toxR)、耐热直接溶血素基因(tdh)和相对耐热直接溶血素基因(trh)为靶基因分别设计引物,进行PCR扩增及反应条件的优化,建立了检测含有溶血素毒力基因的致病性副溶血弧菌的多重PCR方法。3对引物能分别特异性地扩增出368、269、486 bp的目的片段。副溶血弧菌均能扩增出toxR基因,不含溶血素基因的菌株(tdh-/trh-)仅扩增出1条目的片段,而含不同溶血素基因的致病性副溶血弧菌则分别扩增出2条(tdh+/trh-或tdh-/trh+)和3条(tdh+/trh+)特异性条带。检测其他非副溶血弧菌的供试菌,则不出现任何扩增条带。人工模拟样品检测结果显示对致病性副溶血弧菌的最低检测浓度为103CFU/mL。结果表明该多重PCR检测方法具有较好的特异性和灵敏性,对检测致病性副溶血弧菌有重要意义。
副溶血弧菌;种特异性基因;溶血素基因;多重PCR;检测
副溶血弧菌(Vibrio parahaemolyticus)被认为是引起人类食源性疾病的最重要的病原之一,该菌主要存在于海产品中,食用未熟或生的带有病原菌的食物后出现肠胃炎、菌血症甚至死亡[1,2]。此外,该菌可引起多种水产动物(鱼、虾、贝、蟹等)感染发病,尤其是对凡纳滨对虾危害严重[3,4]。随着海产品消售量日益增加,加强对海产品中致病性副溶血弧菌的检测也越来越重要,建立一种快速、灵敏性和特异性较高的检测方法对人类的健康至关重要。
致病性副溶血弧菌主要毒力因子可以产生多种溶血素,耐热直接溶血素(thermostable direct hemolysin,TDH)和耐热相关溶血素(TDH-related hemolysin,TRH)是其公认的重要毒力因子[5,6]。TDH神奈川现象呈阳性,除此还具有多种生物学活性,例如溶血活性、肠毒性、细胞毒性和心脏毒性。该毒素经100℃热处理后约10 min, 生物活性仍不会丧失,故命名为耐热直接溶血素[6,7]。TRH 是副溶血弧菌另外一个重要的致病因子,60℃处理10 min生物活性就丧失。TRH的氨基酸序列与TDH氨基酸序列同源性将近67%,且两者存在相近的作用方式,同TDH一样也具有细胞毒性和肠毒性,但引起溶血的敏感红细胞种类与TDH不同,故称为耐热相关溶血毒素(TRH)[8]。致病性副溶血弧菌菌株一般含有溶血素基因tdh和/或trh,而非致病性副溶血弧菌一般不含有这两个基因。另外,toxR基因已在副溶血弧菌、创伤弧菌(Vibrio vulnificus)、鳗弧菌(Vibrio anguillarum)等很多弧菌中被发现,同时异种之间的toxR基因核苷酸序列保守性较高,是弧菌科种间鉴定的良好分子靶标[9]。
采用传统的培养方法检测临床和食物中的毒力菌株比较困难,一些生物化学和微生物学的检测方法费时且工作量大。因此,建立一种既能鉴别副溶血弧菌,又能确定是否为携带溶血素基因(tdh和/或trh)的致病性副溶血弧菌的检测方法具有重要意义。
1 材料与方法
1.1 菌株 副溶血弧菌ATCC33847购自中国微生物菌种保藏管理委员会普通微生物中心;副溶血弧菌ATCC17802和创伤弧菌ATCC27562购自美国模式培养物集存库;其余副溶血弧菌由本实验室分离和保存。副溶血弧菌各菌株溶血素基因携带情况如下:菌株ATCC33847、VPh503、VPh510、VPSHJLA和VPSHJLC为tdh+trh-;菌株ATCC17802和VPh66为tdh-trh+;VPh67、VPh299、VPh56和VPh503为tdh+trh+;菌株VP24、VP35、VP50、VP65和VP72为tdh-trh-。霍乱弧菌以及其他常见食源性细菌大肠杆菌、沙门菌和金黄色葡萄球菌等菌株为本实验室保存株。
1.2 试剂 蛋白胨、酵母提取物、TCBS培养基购自英国OXOID公司;科玛嘉弧菌显色琼脂购自上海科玛嘉微生物技术有限公司;DNA Marker 购自大连宝生物公司;2×PCR TaqMix 购自广州东盛生物科技有限公司;琼脂糖凝胶回收DNA片段试剂盒购自美国Axygen公司;其余试剂为进口或国产分析纯。
1.3 引物的设计与合成 根据已有文献和序列,分别设计鉴别副溶血弧菌的种特异性基因(toxR)和主要溶血素基因(tdh和trh)的引物,引物由上海英骏生物技术有限公司合成,引物序列、退火温度及扩增片段大小见表1。

表1 PCR 反应引物、退火温度和目的片段长度列表Table 1 PCR primers, anneal temperature and product size
1.4 细菌DNA提取 取1 mL新鲜培养菌液于离心管中,10 000×g离心2 min,弃去上清,收集沉淀;根据细菌基因组DNA提取试剂盒(上海天根生物技术有限公司)说明书提取细菌DNA,保存于-20℃备用。
1.5 单重PCR特异性检测 以副溶血弧菌、霍乱弧菌、创伤弧菌及其他供试菌的DNA为模板,分别检测3对引物的特异性。各引物进行单重PCR的反应体系(25μL):PCR 2×Mix 12.5 μL、上下游引物(10 pmol/μL)各0.5 μL、模板1 μL,用ddH2O调整终体积至25 μL。反应条件:94℃预变性4 min;94℃变性45 s;55℃退火45 s;72℃延伸1 min,共30个循环,最后72℃延伸10 min。扩增产物用1%琼脂糖凝胶电泳检测,在凝胶成像系统下拍照记录结果,将回收的目的基因分别与载体pGEM-T在16℃下连接过夜,之后转入E.coli TOP10感受态细胞中。将转化菌接种于含100 μg/ mL氨苄青霉素的LB琼脂平皿,37℃培养12~20 h。挑取菌落,接种于含100 μg/mL氨苄青霉素的LB液体培养基中,37℃、200 r/min震荡培养过夜。按照质粒小提试剂盒提取质粒DNA,经PCR扩增确定后由上海英骏有限公司进行测序分析。
1.6 单重PCR敏感性检测 将TCBS平板上的副溶血弧菌单菌落接种3%牛肉浸膏培养基,200 r/min、37℃培养至对数期,在含3% NaCl的LB平板上计数。将各菌样以106CFU /mL等体积混合后,用无菌生理盐水以10倍梯度稀释为106~100CFU /mL。各梯度取1 mL菌液,采用试剂盒提取DNA模板,用3对引物分别进行单重PCR,反应条件同1.5,扩增产物用1%琼脂糖凝胶电泳检测, 在凝胶成像系统下拍照记录结果。
1.7 多重PCR反应体系优化 从模板量、退火温度、退火时间和循环参数进行优化。反应体系:PCR 2× Mix 12.5μL,3对上下游引物(10 pmol/μL)分别加:0.5 μL(toxR F/R)、0.5 μL(tdh F/R)、1 μL(trh F/R),模板2 μL,用ddH2O调整终体积至25 μL。反应条件:94℃预变性4 min;94℃变性45 s;退火温度从55℃至65℃设10个梯度,45 s; 72℃延伸1 min,共30个循环,最后72℃延伸10 min。选择最佳反应体系及退火温度后,对退火时间进行优化,退火时间分别设为为30 s、45 s、1 min。最后对循环参数进行优化,将循环参数分别设为20、30、40个循环。
1.8 多重PCR引物特异性分析 分别选取tdh+/trh+、tdh+/trh-、tdh-/trh+、tdh-/trh-的副溶血弧菌菌株以及其他供试菌的DNA为模板,以最佳反应体系进行反应,分析多重PCR特异性分析。
1.9 多重PCR敏感性的检测 将细菌基因组DNA用灭菌纯化水作10倍梯度稀释,以最佳反应体系进行反应,分析多重PCR的检测灵敏度。
1.10 人工布菌样品的检测 在当地农贸市场采集牡蛎,超净台无菌操作剪碎,用FJ-200高速分散均质机打碎为匀浆,称取10 g样品与90 mL灭菌的3%NaCl碱性蛋白胨水混匀。取过夜培养的副溶血弧菌(tdh+/trh+)菌悬液进行涂平板计数,10倍梯度稀释。对106、105、104、103、102CFU/mL这5个稀释度的菌液各取1 mL接种至牡蛎肉中,分别提取基因组DNA,未加菌的样品作为阴性对照,采用多重PCR进行检测。
2 结果
2.1 单重PCR特异性评价 利用针对toxR、trh、tdh基因的3对引物分别进行单重PCR,以副溶血弧菌阳性菌株的DNA为模板,能分别特异性地扩增出368、486、269 bp大小的目的条带,同时测序结果也表明3个基因扩增正确,不携带相应毒力基因的副溶血弧菌和其他供试菌株均无相应大小的条带出现(见图1A、B和C),表明设计的引物有较高的特异性。
2.2 单重PCR敏感性评价 以倍比稀释的副溶血弧菌DNA为模板,单重PCR分别检测trh、tdh、toxR基因,当这3种引物溶度分别为2、0.5、0.5 μL时,3种单重PCR的最低检测限均为1×102CFU/mL(图2)。
2.3 多重PCR体系优化 在25 μL反应体系中,退火温度在55℃~65℃时,3对引物均出现较明显的目的条带(图3A)。退火时间在30 s时tdh产物的条带较模糊,退火时间在45 s和1 min时,3条目的条带均较清晰(图3B)。循环参数为30时,目的条带最明显(图3C)。因此,用于检测副溶血弧菌毒力因子的多重PCR,最佳反应体系确定为(25 μL):Mix 10μL,上下游引物(10 pmol/μL)分别为trh 2 μL、tdh 0.5 μL、toxR 0.5 μL,模板2 μL,ddH2O调整终体积至25 μL。反应条件:94℃预变性4 min;94℃变性45 s;退火温度60℃,退火时间45 s;72℃延伸1 min,共30个循环,最后72℃延伸10 min。
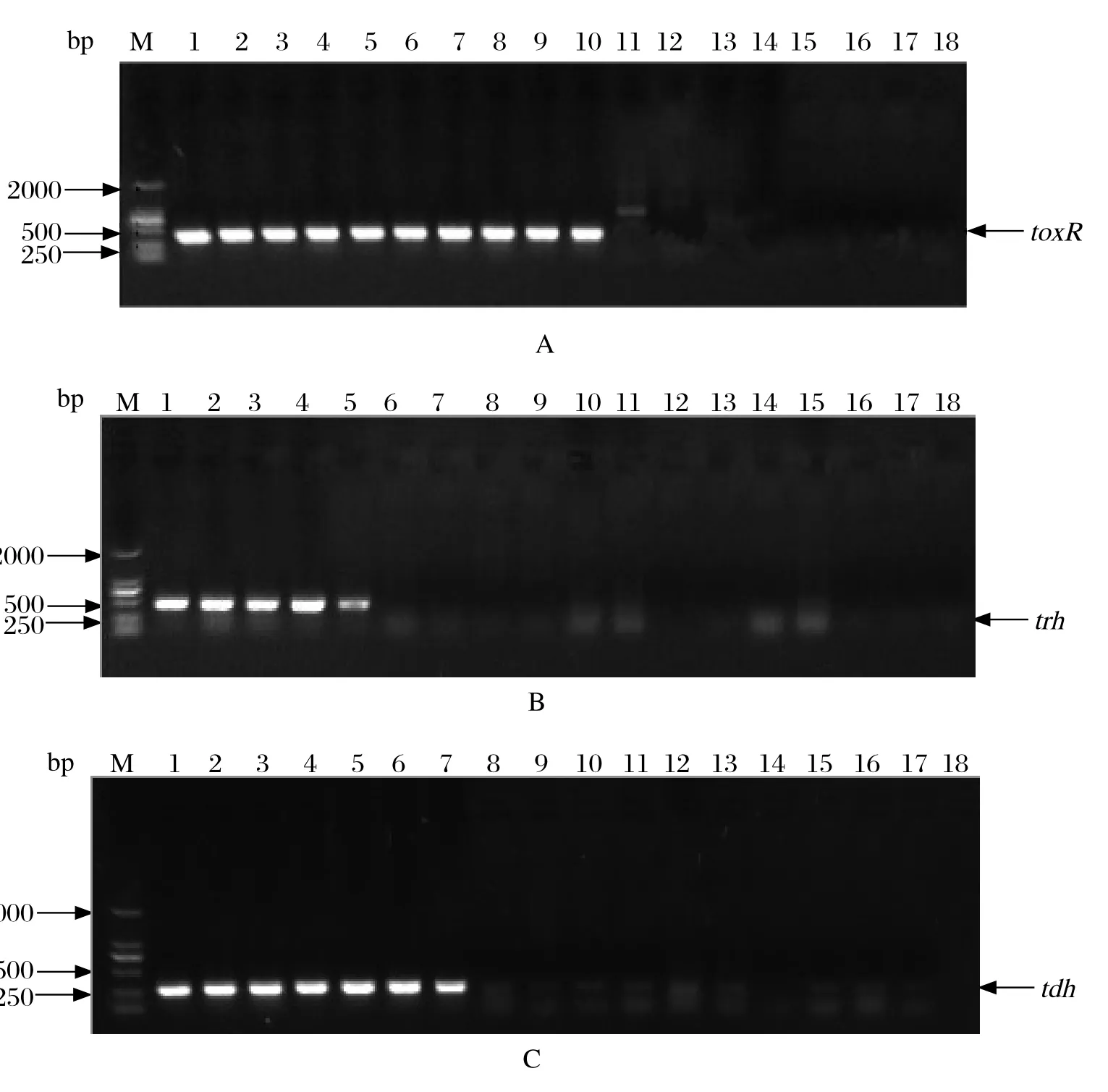
图1 单重PCR特异性检测Fig.1 Specifi city test of single plex PCR

图2 单重PCR敏感性检测Fig.2 Sensitivity test of single plex PCR

图3 多重PCR反应条件的优化Fig.3 Optimization of reaction conditions for multiplex PCR
2.4 多重PCR特异性评价 多重PCR检测方法分别对tdh+/trh+、tdh+/trh-、tdh-/trh+和tdh-/trh-副溶血弧菌菌株,及其他细菌进行特异性检测(图4),阳性菌株都出现了相应大小的特异性条带,而阴性菌均未出现特异性条带,结果表明该多重PCR检测方法有较高的特异性。
2.5 多重PCR敏感性检测 选取tdh+/trh+的副溶血弧菌菌株培养液进行梯度稀释,各取1 mL提取 DNA,进行多重PCR检测,在102CFU/mL时仍能检测到toxR目的条带,在103CFU/mL时能明显看到trh和tdh的条带(图5)。因此对于致病性副溶血弧菌,多重PCR的检测限为103CFU/mL。
2.6 人工模拟样品检测限的测定结果 多重PCR检测结果显示,未接种副溶血弧菌的样品未出现相应的条带,说明样品在处理前未被污染。副溶血弧菌浓度为102CFU/mL时,可以检测到toxR基因,但是trh和tdh的扩增条带比较模糊。副溶血弧菌浓度为103CFU/mL时,3个条带均较清晰(图6)。可见,本研究建立的多重PCR方法对致病性副溶血弧菌的检测限为103CFU/mL。
3 讨论
近些年,副溶血弧菌作为一个重要致病因子越来越受到人们重视。据我国国家食源性疾病监测网2003~2007年报告显示,副溶血弧菌已超过大肠埃希氏菌和沙门氏菌成为我国最主要的食源性致病菌[10]。有学者在分子流行病学调查过程中发现,可用作副溶血弧菌检测的靶基因主要有:编码溶血素的tlh基因、编码促旋酶的gyrB基因序列、编码毒力操纵子调节基因toxR、副溶血弧菌的16S核糖体RNA基因(16S rRNA)和伴侣蛋白基因groEL等[11,12]。选用上述特异性靶基因对副溶血弧菌进行鉴定均具有良好的特异性。但是部分基因并不能有效区分副溶血弧菌和其他细菌,例如,副溶血弧菌、溶藻弧菌、哈氏弧菌和坎氏弧菌的16S rRNA 和23S rRNA基因序列具有高度的相似性,用这两个基因为靶基因检测副溶血弧菌有一定的困难[13,14]。相比之下,许多研究发现toxR基因用于检测副溶血弧菌时有较强的特异性,可以将副溶血弧菌和其他菌种准确地检测出,并且所有副溶血弧菌均能扩增到toxR基因[15]。本实验室前期研究也发现toxR和groEL基因的种特异性均非常好,因此本试验选取toxR基因作为鉴别副溶血弧菌和其他细菌的种特异性基因。
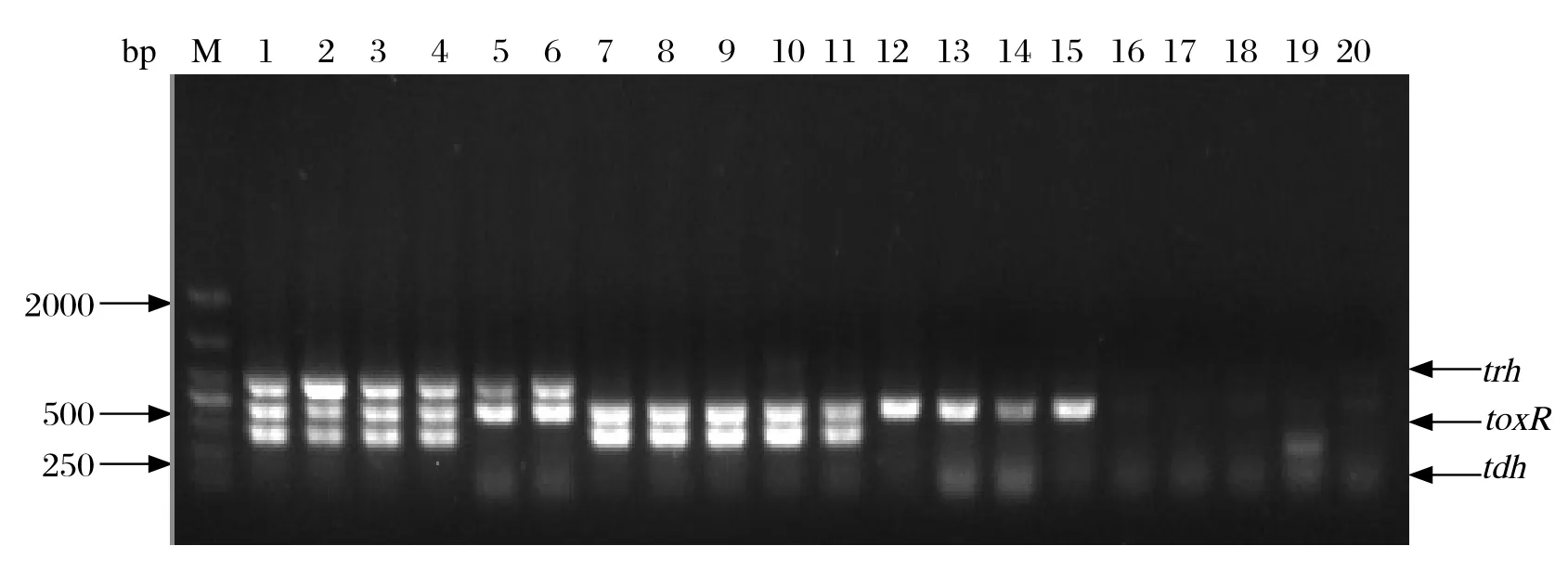
图4 多重PCR特异性检测Fig.4 Specifi city test of multiplex PCR
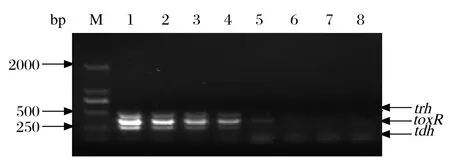
图5 多重PCR敏感性检测结果Fig.5 Sensitivity test of multiplex PCR

图6 模拟样品的多重PCR检测结果Fig.6 Detection of artifi cially infected samples by multiplex PCR
为了进一步鉴别致病菌株和非致病菌株,还需检测副溶血弧菌重要的毒力基因。研究认为TDH和TRH是副溶血弧菌最重要的两个致病因子,分别由tdh和trh基因编码,它们单个或同时存在均可造成副溶血弧菌很强的致病力[5,6],检测是否含有这两种毒力因子对确定副溶血弧菌是否对人类健康造成威胁具有重要的意义。目前已建立了关于以tdh和trh为目标基因的分子学研究方法[16,17]。PCR具有操作简单、高效、成本低及高灵敏度的优点,得到越来越广泛的运用。本研究建立了以菌种特定基因和毒力基因为靶基因的多重PCR检测方法。种特异性基因toxR可以将副溶血弧菌和其他细菌区别开来,毒力基因tdh和trh可以鉴别非致病性和致病性副溶血弧菌,同时还能确定致病菌是同时具有还是分别具有tdh和trh毒力基因,并且通过电泳可以很容易区分开3个基因。将细菌按梯度连续稀释后,进行人工模拟布菌试验,可以检测到102~103CFU/mL以上的致病性副溶血弧菌。
本研究建立的多重PCR不仅能够准确地检测出副溶血弧菌,而且可以区分非致病性和致病性副溶血弧菌,进一步可确定致病菌株含有单个还是两个不同溶血素毒力基因的情况,可用于食品安全检测、诊断和分类研究。
[1] Yeung P S, Boor K J. Epidemiology, pathogenesis,and prevention of foodborne Vibrio parahaemolyticus infections[J]. Foodborne Pathog Dis, 2004, 1(2)∶ 74-88.
[2] 蒋蔚, 李欣彤, 何再平, 等. 副溶血弧菌 SHJLA 株的分离鉴定及致病性分析[J]. 中国动物传染病学报, 2013,21(6)∶ 26-32.
[3] Soto-Rodriguez S A, Gomez-Gil B, Lozano-Olvera R, et al. Field and experimental evidence of Vibrio parahaemolyticus as the causative agent of acute hepatopancreatic necrosis disease of cultured shrimp(Litopenaeus vannamei) in Northwestern Mexico[J]. Appl Environ Microbiol, 2015, 81(5)∶ 1689-1699.
[4] 樊景凤, 宋立超, 王斌, 等. 一株引起凡纳滨对虾红体病的病原菌—副溶血弧菌的初步研究[J]. 海洋科学, 2006,30(4)∶ 40-44.
[5] Zhang L, Orth K. Virulence determinants for Vibrio parahaemolyticus infection[J]. Curr Opin Microbiol, 2013,16 (1)∶70-77.
[6] 李毅, 朱心强. 副溶血弧菌及其溶血素研究进展[J]. 中国卫生检验杂志, 2008, 18(12)∶ 1004-8685.
[7] Broberg C A, Calder T J, Orth K. Vibrio parahaemolyticus cell biology and pathogenicity determinants[J]. Microbes Infect, 2011, 13 (12-13)∶ 992-1001.
[8] Shirai H, Ito H, Hirayama T, et al. Molecular epidemiologic evidence for association of thermostable direct hemolysin (TDH) and TDH-related hemolysin of Vibrio parahaemolyticus with gastroenteritis[J]. Infect Immun,1990, 58(11)∶ 3568-3573.
[9] Rosec J P, Simon M, Causse V, et al. Detection of total and pathogenic Vibrio parahaemolyticus in shellfish∶comparison of PCR protocols using pR72H or toxR targets with a culture method [J]. Int J Food Microbiol,2009,129 (2)∶136-145.
[10] 毛雪丹, 胡俊峰, 刘秀梅. 2003-2007年中国1060起细菌性食源性疾病流行病学特征分析[J].中国食品卫生杂志,2010, (3)∶ 224-228.
[11] 陈万义. 副溶血性弧菌高通量分子检测方法的建立与基因分型研究[D]. 上海∶ 上海交通大学, 2011.
[12] Venkateswaran K, Dohmoto N, Harayama S. Cloning and nucleotide sequence of the gyrB gene of Vibrio parahaemolyticus and its application in detection of this pathogen in shrimp [J]. Appl Environ Microbiol, 1998, 64(2)∶ 681-687.
[13] Croci L, Suffredini E, Cozzi L, et al. Comparison of different biochemical and molecular methods for the identification of Vibrio parahaemolyticus[J]. Appl Microbiol, 2007, 102(1)∶ 229-237.
[14] Haldar S, Neogi S B, Kogure K, et al. Development of a haemolysin gene-based multiplex PCR for simultaneous detection of Vibrio campbellii, Vibrio harveyi and Vibrio parahaemolyticus[J]. Lett Appl Microbiol, 2010, 50(2)∶146-152.
[15] Kim Y B, Okuda J, Matsumoto C, et al . Identification of Vibrio parahaemolyticus strains at the species level by PCR targeted to the toxR gene [J]. J Clin Microbiol, 1999,37(4)∶ 1173-1177.
[16] Bej A K, Patterson D P, Brasher C W, et al. Detection oftotal and hemolysin-producing Vibrio parahaemolyticus in shellfish using multiplex PCR amplification of tlh, tdh and trh [J]. J Microbiol Methods, 1999, 36 (3)∶ 215-225.
[17] Nemoto J, Sugawara C, Akahane K, et al. Rapid and specific detection of the thermostable direct hemolysin gene in Vibrio parahaemolyticus by loopmediated isothermal amplification [J]. Food Prot, 2009,72(4)∶ 748-754.
DEVELOPMENT AND EVALUATION ON A MULTIPLEX PCR FOR DETECTION OF PATHOGENIC VIBRIO PARAHAEMOLYTICUS
HE Zai-ping1,2, WANG Quan1, CHEN Yong-jun1, LIU Ying-chun1, HAN Xian-gan1,WANG Shao-hui1BAI Xue-rui1,2, LIU Yong-jie2, JIANG Wei1
(1. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2. Key Laboratory of Animal Disease Diagnostic and Immunology of the Ministry of Agriculture, College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, China)
In order to identify Vibrio parahaemolyticus that produce toxin genes, a rapid, sensitive and specifi c multiplex PCR assay was developed in this study. Three pairs of primers were designed to detect species-specifi c gene (toxR), heat direct hemolysin gene (tdh) and heat-related hemolysin gene (trh) of V.parahaemolyticus, respectively. The reaction conditions for the multiplex PCR were optimized to establish a rapid, sensitive and convenient method for detection of pathogenic V. parahaemolyticus in aquatic animals. The results showed that the multiplex PCR produced specifi c amplicons with expected sizes 368 bp, 269 bp and 486 bp. The three pairs of primers amplifi ed diff erent V. parahaemolyticus strainss: one band for tdh-/trh-V. parahaemolyticus, two bands for tdh+/trh-or tdh-/trh+V. parahaemolyticus and three bands for tdh+/trh+V. parahaemolyticus. The multiplex PCR did not detect any other bacteria. The detection limit of the multiplex PCR was 1×103CFU/mL for pathogenic V. parahaemolyticus. Development of the multiplex PCR off ers an eff i cient way for high sensitive and special detection of pathogenic V. parahaemolyticus.
V. parahaemolyticus; species-specifi c gene; hemolysin gene; multiplex-PCR; detection
S852.612
A
1674-6422(2015)06-0048-08
2015-09-15
上海市科学技术委员会科研计划项目(13DZ0502702);公益性行业(农业)科研专项(201303045)
何再平,女,硕士,主要从事微生物学和免疫学研究
蒋蔚,E-mail:jiangweijw99@163.com;刘永杰,liuyongjie@njau.edu.cn
