Tet-On系统调控p53稳定表达的H1299细胞系的建立与应用
2015-11-23武专昌魏建超杨逸凡赵秋华邵东华李玉明齐鹏飞李蓓蓓邱亚峰马志永
武专昌,王 鑫,魏建超,杨逸凡,赵秋华,邵东华,李玉明,齐鹏飞,刘 珂,李蓓蓓,邱亚峰,马志永
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 临沂大学生命科学学院,临沂 276000;3.上海交通大学生命科学技术学院,上海 200240;4.上海市闵行区动物疫病预防控制中心,上海201109)
·研究论文·
Tet-On系统调控p53稳定表达的H1299细胞系的建立与应用
武专昌1,王 鑫2,魏建超1,杨逸凡3,赵秋华4,邵东华1,李玉明1,齐鹏飞1,刘 珂1,李蓓蓓1,邱亚峰1,马志永1
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 临沂大学生命科学学院,临沂 276000;3.上海交通大学生命科学技术学院,上海 200240;4.上海市闵行区动物疫病预防控制中心,上海201109)
应用Tet-on系统和H1299细胞,建立了p53诱导表达的H1299细胞系p53-Tet H1299,p53表达受强力霉素(doxycycline,Dox)调控,存在一定的剂量依赖性。诱导表达的p53蛋白有很好的核定位能力和转录活性,能显著上调p21、TLR3、Bax等多种p53转录激活的下游靶基因表达,同时还可显著抑制水泡性口炎病毒(Vesicular stomatitis virus,VSV)的复制,说明p53-Tet H1299可作为研究p53抗病毒作用的细胞模型。p53诱导表达细胞系的建立为进一步研究p53抗病毒作用机制、转录调控基因的筛选及其他生物学功能研究提供了很好的研究工具。
p53;Tet-on;H1299;Dox;抗病毒
肿瘤抑制因子p53在DNA损伤修复、细胞周期捕获、细胞凋亡、细胞衰老、代谢和先天性免疫调控等多种生物学过程中发挥重要作用[1-6],p53作为转录调控因子,其功能发挥多依赖于p53激活后细胞核定位,转录起始或抑制许多靶基因的表达,发挥相应的生物学功能。近年来,p53与先天性免疫,特别是I型干扰素(I-IFN)信号通路的关系逐渐被揭示。p53具有增强I-IFN信号通路的抗病毒作用,一些在抗病毒先天性免疫中发挥重要作用的干扰素诱导基因也是p53直接转录调控的下游靶基因,如干扰素调节因子:IRF9、IRF5,模式识别分子:TLR3、RIG-I,抗病毒基因:干扰素刺激基因ISG15、蛋白激酶PKR等[7-10]。另外p53也是I-IFN直接转录的靶基因,I型IFN能转录p53基因,增加p53的蛋白水平,并且能增强IFN诱导的细胞凋亡作用[11]。
四环素(tetracycline,Tet)诱导调控表达系统是在大肠杆菌Tn10转座子中特异的Tet抗性操纵子基础上建立的一种用于调控基因表达的系统,该系统已被广泛应用于基因功能和基因治疗研究[12,13]。Teton调控系统主要由反义Tet转录活化因子(reverse tetracycline transcriptional activator,rtTA)、Tet应答元件(Tet-responsive element,TRE)和诱导物(Tet衍生物、强力霉素Doxycycline)组成。在无Doxycycline(Dox)时,rtTA不能结合TRE,基因表达关闭;而Dox存在时,与rtTA结合,使其构象改变,结合在TRE上,启动基因表达。Tet-on诱导调控表达系统具有本底低、高诱导表达、特异性强和毒性小等优点[12]。
为了更好的研究p53抗病毒的分子机制及其他生物学功能,选用p53表达缺失的H1299细胞和Teton 3G系统,建立了Dox诱导p53表达的H1299细胞系p53-Tet H1299,其p53表达受Dox的严格控制,并存在一定的Dox剂量依赖性。诱导表达的p53蛋白主要定位于细胞核中,能有效转录调控p53下游靶基因p21、Bax、TLR3、RIG-I和IRF9的表达。另外,在Dox存在条件下,p53拮抗的水泡性口炎病毒(Vesicular stomatitis virus,VSV)[11]在p53-Tet H1299中的复制能力显著受到抑制。
1 材料与方法
1.1 细胞、病毒和质粒 人非小细胞肺癌细胞H1299、乳仓鼠肾细胞BHK-21购自中国科学院上海细胞保藏中心;水泡性口炎病毒由中国农业科学院上海兽医研究所猪病研究室保存;人p53真核表达质粒p3xFlag-p53为本实验室保存;Tet-on 3G诱导表达系统购自Clontech公司,包含质粒pCMV-Tet3G、pTRE3G、pTRE3G-Luc和线性嘌呤霉素抗性DNA(Linear Puromycin Marker)。
1.2 试剂 抗生素G418、嘌呤霉素、多西环素(doxycyclin,Dox)和无四环素类抗生素的胎牛血清及XfectTM转染试剂均购自Clontech公司;总RNA提取试剂盒(RNAiso Reagent)、PrimeScriptTMRT reagent Kit with gDNA Eraser和SYBR荧光定量试剂盒(SYBR®Premix Ex TaqTM)购自大连宝生物公司;T4 DNA连接酶购自NEB公司;快速限制性内切酶购自Fermentas公司;DMEM培养基、0.25%胰酶和胎牛血清购自Gibco公司;ECL发光试剂盒购自Pierce公司;Promega's Steady-Glo®萤光素酶检测试剂盒购自Promega公司;抗人p53单克隆抗体(DO-1)、p21单克隆抗体(F-5)和HRP标记山羊抗小鼠IgG二抗购自Santa Cruz公司;FITC标记山羊抗小鼠IgG荧光二抗购自Invitrogen公司;抗β-actin单克隆抗体购自Proteintech公司。
1.3 p53诱导表达质粒pTRE-p53的构建 p3× Flag-p53为模板,引物p53-Tet-F:5'-gaagatctAACCCC AATTGGGGAGGAGCCGCAGTCAG-3' 和p53-Tet-R:5'-cgggatcctcaGTCTGAGT-CAGGCCCTTC-3' 扩增p53基因,小写部分为限制性内切酶位点和保护性碱基,加粗部分为Kozak序列。扩增的1200 bp片段切胶回收,用Bgl II和Bam H I酶切位点连接到四环素诱导表达载体pTRE3G中,测序阳性的重组质粒命名为pTRE-p53。
1.4 H1299 嘌呤霉素和G418最小杀伤浓度的滴定H1299细胞传代于24孔细胞培养板,5×105细胞/孔,培养24 h后,更换含不同浓度抗生素和5%FBS的DMEM培养基,G418选择0、100、200、300、400、500、600 μg/mL 6个梯度,嘌呤霉素选择0、1、2、3、4、5、6 μg/mL的不同浓度处理,每3~4 d更换1次培养基和抗生素,选择7~10 d内细胞全部死亡的浓度作为细胞系抗性筛选的最小杀伤浓度。
1.5 p53-Tet H1299细胞系的建立 Tet-on 3G系统构建p53诱导表达的H1299细胞系需要依次构建pCMVTet3G(编码反式激活因子Tet-on 3G和G418抗性)和pTRE3G-p53(编码p53蛋白)的稳定整合的细胞系。H1299细胞转染pCMV-Tet3G质粒后,加300 μg/mL G418筛选,抗性克隆用荧光素酶报告试验进行筛选,选择高诱导水平和低背景的克隆作为Tet-on 3G稳定表达细胞系,命名为Tet-on 3G H1299。pTRE-p53和Linear Puromycin Marker共转染Tet-on 3G H1299(pTRE-p53:Linear Puromycin Marker≥10∶1),用1 μg/mL 嘌呤霉素筛选,阳性克隆用Western blot进行筛选,选择p53蛋白受Dox诱导表达调控且表达水平最高的克隆命名为p53-Tet H1299。其他详细步骤参照Clontech公司的Tet-on 3G诱导表达系统手册。
1.6 荧光素酶活性试验(luciferase reporter assay)将pCMV-Tet3G稳定整合H1299细胞克隆传代于24孔板,每个克隆接种2个孔。当细胞密度达到50%时,转染pTRE3G-Luc质粒和pTK-RL质粒(10∶1比例),pTK-RL质粒用于校正不同孔间转染效率差异,转染6 h后加1 μg/mL Dox处理或加等量灭菌ddH2O作未诱导对照,诱导24 h后,细胞样品用双荧光素酶报告系统检测试剂盒(Promega)的方法,计算相对荧光素酶活性,筛选Tet-on 3G转录激活蛋白稳定高效表达的克隆,相对诱导活性= (Luc+Dox/ RL+Dox)/(Luc-Dox/RL-Dox),其中Luc表示萤火虫荧光素酶(Luciferase)活性,RL表示海肾荧光素酶(Rinilla)活性。
1.7 细胞生长曲线绘制 p53-Tet H1299细胞传代于24孔细胞培养板,1×104细胞/孔,培养12 h后,加1 μg/mL Dox处理,ddH2O做对照。分别于加药后0、12、24、36、48、60、72 h消化细胞,计数细胞总数,每个时间点做3个重复,以培养时间为横轴,细胞数为纵轴,绘细胞生长曲线。
1.8 荧光定量PCR 细胞用Trizol裂解后,提取细胞总RNA,测定RNA浓度后进行反转录反应。 RNA提取和RT-qPCR反应具体步骤参照TaKaRa公司的总RNA提取试剂盒(RNAiso Reagent)、PrimeScriptTMRT reagent Kit with gDNA Eraser 和SYBR荧光定量试剂盒(SYBR®Premix Ex TaqTM)说明书。GAPDH作为内参基因,采取2-ΔΔCt法计算相对表达差异倍数。
1.9 VSV滴度测定(tissue culture infective dose,TCID50) 将BHK-21细胞接种96孔板(1×105细胞/孔),培养24 h后,每孔加入用空白DMEM逐级10倍稀释的种毒液,100 μL/孔,感染2 h后,弃去培养基并用PBS洗涤1次后,加含2% FBS的培养基,37℃、CO2培养箱内继续培养5~7 d后,计数病变孔,用Reed-Munch法计算病毒TCID50。
2 结果
2.1 p53诱导表达质粒pTRE-p53的构建 以p3x Flag-p53为模板,p53-Tet-F和p53-Tet-R为引物,用Pfu DNA聚合酶扩增p53基因,扩增出长约1200 bp的片段(图1A),与目的基因大小一致。Bgl II和Bam H I酶切回收的片段和pTRE3G载体后,回收酶切产物进行连接转化,挑取单克隆进行培养与质粒提取。Bgl II和BamH I双酶切质粒后电泳结果显示,阳性质粒出现长约1200 bp的p53基因和3430 bp的载体片段,与预期相符(图1B)。阳性质粒进行DNA测序,选取与人野生型p53序列完全一致的重组质粒用于后续细胞系的建立。
2.2 Tet-on 3G稳定表达H1299细胞系的建立 质粒pCMV-Tet3G转染H1299细胞并用300 μg/ml G418筛选,抗性克隆用克隆环消化传代于24孔细胞培养板。为评估反式激活因子Tet-on 3G的转录活性,每孔转染质粒pTRE3G-Luc和pTK-RL,6 h后加1 μg/ mL Dox继续处理24 h,诱导Luciferase的表达,用双荧光素酶报告系统检测试剂盒检测相对荧光素酶活性。结果显示在24株G418抗性的细胞克隆中,Dox诱导Luciferase表达水平差异很大,5#克隆相对荧光素酶活性最低,仅为0.79,而诱导活性最高的4#克隆为91.8(图2)。选取Dox诱导后的相对荧光素酶活性最高的4#克隆继续扩大培养,命名为Tet-on 3G H1299,用作建立下一步细胞系的细胞株。
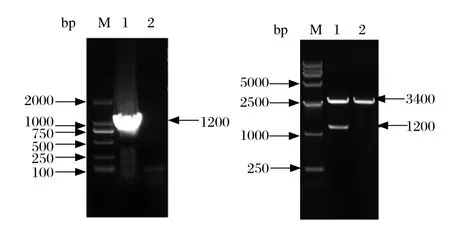
图1 p53基因PCR扩增和pTRE-p53质粒酶切鉴定Fig.1 PCR amplifi cation of p53 gene and identifi cation of recombination plasmid pTRE-p53 by restriction enzymes digestion
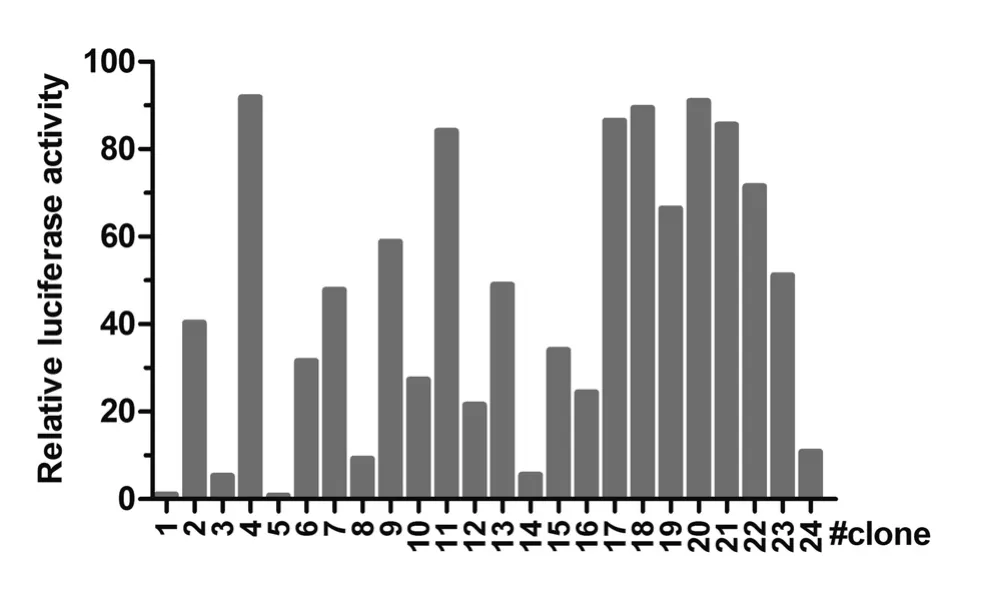
图2 荧光素酶报告试验筛选Tet-on 3G稳定表达H1299细胞克隆Fig.2 Screening of Tet-3G H1299 clones by luciferase reporter assay
2.3 p53稳定诱导表达H1299细胞系的建立 pTRE-p53质粒不含抗性筛选标记,将100 ng Linear Puromycin Marker与2 μg pTRE-p53质粒共同转染Tet-on 3G H1299细胞,用1 μg/mL 嘌呤霉素筛选抗性克隆。挑取单细胞克隆传代于24孔细胞培养板,分别用1 μg/ mL Dox或等量ddH2O处理,24 h后用Western blot检测不同细胞克隆的p53表达情况。结果显示,在挑取的不同嘌呤霉素抗性克隆中,8#克隆p53表达受Dox调控,但表达水平比较低,而其他克隆Dox诱导后未发现p53蛋白表达,只有1#克隆p53蛋白高效表达且受Dox的诱导调控(图3),将1#克隆命名为p53-Tet H1299细胞,并扩大培养。
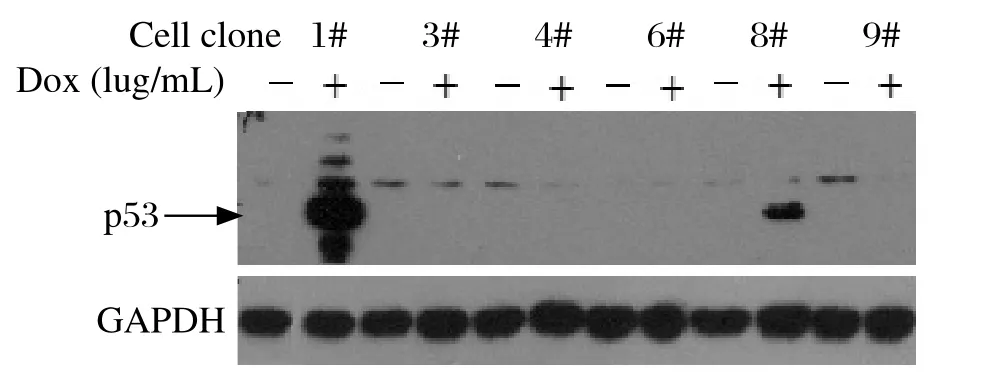
图3 Western blot筛选p53-Tet H1299细胞克隆Fig.3 Screening of p53-Tet H1299 clones by Western blot
2.4 p53诱导表达及转录活性的验证 为了选取p53诱导表达所使用Dox的适合浓度,p53-Tet H1299细胞传代于6孔细胞培养板,2×105细胞/孔,培养12 h后,分别加0、0.01、0.1、0.5、1、2 μg/mL Dox诱导24 h,收集细胞检测p53表达变化。Western blot结果显示10 ng/mL Dox处理即可诱导p53表达,随着Dox用量提高,p53蛋白表达有一定的上升趋势;1 μg/mL Dox诱导时,p53表达量已达到最高水平(图4A),选择1 μg/mL Dox作为诱导p53高效表达的使用浓度。
作为转录因子,p53蛋白生物学功能的发挥依赖于细胞核聚集并转录调控下游靶基因的能力。为了进一步验证Dox诱导表达的p53蛋白的生物学活性,分别检测了p53核定位和转录下游靶基因的能力。IFA结果显示,在1 μg/mL Dox诱导24 h后,p53大量表达,胞浆与胞核中均有分布,但主要分布于胞核中,与DAPI能很好的重叠在一起,表现出很好的核定位能力;未加Dox处理的细胞中,未检测到p53的表达(图4B)。TLR3、RIG-I和IRF9是干扰素信号通路中p53直接转录调控的下游靶基因,p21与Bax分别是p53参与细胞周期和细胞凋亡过程的重要调控基因。为评估p53的转录活性,1 μg/ mL Dox处理p53-Tet H1299细胞24 h后,提取细胞总RNA进行性对定量分析。qPCR结果显示与对照组(-Dox)相比,Dox处理后TLR3、RIG-I、IRF9、p21和Bax基因转录水平均显著上调(图4C),说明了诱导表达的p53具有很好的转录活性。
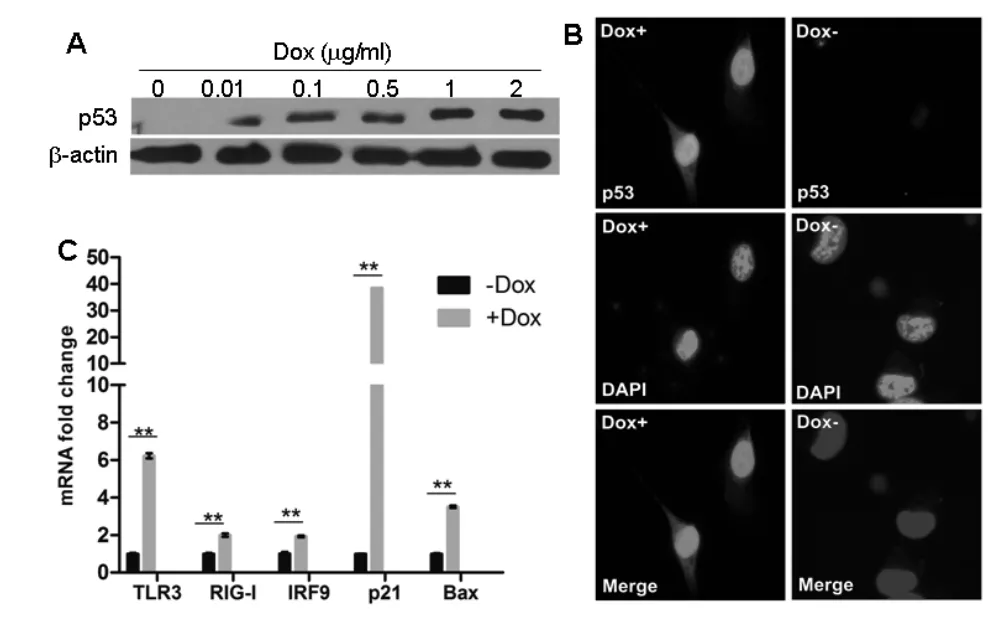
图 4 p53的诱导表达及转录活性分析Fig.4 Transcriptional activity of induced p53 in p53-Tet H1299 cell
2.5 p53-Tet H1299细胞在p53抗病毒研究中的应用p53-Tet H1299细胞系在Dox存在的条件下,能高效诱导p53表达,并转录调控其下游靶基因表达,发挥相应的生物学作用。p53可以调控p21等基因表达,参与细胞周期调控,诱导细胞生长停滞。含10% FBS的DMEM培养基中,加1 μg/mL Dox处理Tet-on 3G H1299和p53-Tet H1299细胞的不同时间点测定细胞数目,细胞生长曲线发现Dox诱导后的0~12 h,两种细胞的增殖动态基本一致。但12~72 h,p53-Tet H1299细胞增殖速率明显减缓,72 h细胞数目仅为12 h的1.5倍,而Tet-on 3G H1299细胞仍然快速增殖,72 h细胞数是p53-Tet H1299的3倍多(图5A)。说明Dox诱导p53表达抑制了细胞的增殖,从而限制了在研究抗病毒中的应用。为此,在Dox诱导12 h后,培养基更换为含1μg/ml Dox和2% FBS的DMEM,细胞生长曲线表明,两种细胞的细胞增殖速率均变慢,不同时间的细胞数基本相同(图5B),从而排除了细胞增殖速率不同对评估p53抗病毒作用中的限制。
p53能抑制VSV等多种病毒复制,Tet-on 3G H1299和p53-Tet H1299细胞用1 μg/mL Dox处理12 h后,接种0.01 MOI VSV,感染1 h后,更换含1 μg/mL Dox和2% FBS的培养基继续培养,24 h后收集细胞上清检测病毒滴度(图5C)。与Tet-on 3G H1299相比,p53-Tet H1299细胞上清的VSV滴度均显著降低,仅为对照组的1/6(图5D),说明p53抑制VSV的复制,p53-Tet H1299可作为研究p53抗病毒作用的细胞模型。

图 5 p53-Tet H1299在研究p53抗病毒作用中的应用Fig.5 Application of p53-Tet H1299 in studying antiviral role of p53
3 讨论
当细胞DNA产生损伤时,肿瘤抑制因子p53可以抑制细胞分裂,修复损伤的DNA或诱导细胞凋亡,防止细胞发生转化与肿瘤形成,因而p53被称为“基因组卫士”[14]。从1979年发现p53开始,p53的多种功能逐步被揭示,涉及细胞周期、凋亡、衰老和免疫等多方面[15],为进一步研究p53在抗病毒先天性免疫和其他生物学过程中的作用,利用Teton系统和p53蛋白表达缺失的H1299细胞,建立了Dox处理下的实现p53功能获得与缺失的p53诱导表达细胞系。Dox诱导表达的p53蛋白能很好的定位于细胞核,转录调控其下游靶基因的表达,同时还能发挥其抑制VSV和流行性乙型脑炎病毒(Japanese encephalitis virus,JEV)复制的能力,为后续研究提供了很好的细胞模型。
基因诱导表达是调控基因表达与否或表达量高低的重要手段,Tet-on系统具有严谨性、特异性、本底低等优点,已广泛应用于基因功能研究[12,13]。H1299细胞p53基因发生部分缺失突变,蛋白表达缺失,结合四环素诱导表达系统,实现p53在H1299细胞内的可控表达。p53-Tet H1299基于Tet-on系统并依赖于Dox诱导,四环素(Tet)并不能诱导p53表达,主要是因为Tet-on 3G转录激活蛋白并不结合四环素,不能引起其发挥转录激活作用的构象改变。p53-Tet H1299对Dox具有很高的敏感性,低至10 ng/ mL的Dox处理,即可引起p53的大量表达,1 μg/mL Dox处理已使p53表达达到最大的诱导水平。
当评估p53-Tet H1299细胞在研究p53抗病毒中的可用性时,为排除Dox和转录因子Tet-on 3G对病毒复制的干扰,用Tet-on 3G H1299作为对照细胞。肿瘤抑制因子p53能诱导细胞周期停滞和细胞凋亡,发挥抑制癌症发生的作用,p53的诱导表达12 h后,p53-Tet H1299的增殖明显受到抑制。Dox诱导72 h后,p53-Tet H1299细胞数量仅为Tet-on 3G H1299的1/3,使病毒有效感染和复制的细胞数量减少,从而难以评估p53抗病毒作用。细胞生长曲线显示Dox诱导12 h并未改变细胞增殖速率,而此时p53已大量诱导表达,可以在此时感染病毒,然后再更换为含2% FBS的维持培养基,减缓细胞增殖,两种细胞的增殖速率基本一致。病毒感染24 h后的细胞上清滴度测定结果显示JEV和VSV在p53-Tet H1299细胞中的复制水平显著降低,说明p53的诱导表达抑制了病毒的复制,进一步验证了p53的抗病毒活性及p53-Tet H1299在抗病毒研究中的可用性。
总之,本研究利用p53蛋白表达缺失的H1299细胞和Tet-on 3G系统建立了Dox诱导调控下p53表达细胞系p53-Tet H1299,诱导表达的p53具有很好核定位能力、转录活性和抑制VSV复制的能力,为进一步研究p53抗病毒分子机制、靶基因筛查和其他生物学功能提供了有利的工具。
[1] Mercer W E, Amin M, Sauve G J, et al. Wild type human p53 is antiproliferative in SV40-transformed hamster cells[J]. Oncogene, 1990, 5(7)∶ 973-980.
[2] Mercer W E, Shields M T, Amin M, et al. Negative growth regulation in a glioblastoma tumor cell line that conditionally expresses human wild-type p53[J]. Proc Natl Acad Sci USA, 1990, 87(16)∶ 6166-6170.
[3] Michalovitz D, Halevy O, Oren M. Conditional inhibition of transformation and of cell proliferation by a temperature-sensitive mutant of p53[J]. Cell, 1990, 62(4)∶671-680.
[4] Yonish-Rouach E, Resnitzky D, Lotem J, et al. Wildtype p53 induces apoptosis of myeloid leukaemic cells that is inhibited by interleukin-6[J]. Nature, 1991,352(6333)∶ 345-347.
[5] Serrano M, Lin A W, McCurrach M E, et al. Oncogenic ras provokes premature cell senescence associated with accumulation of p53 and p16INK4a[J]. Cell, 1997, 88(5)∶593-602.
[6] Jones M, Davidson A, Hibbert L, et al. Dengue virus inhibits alpha interferon signaling by reducing STAT2 expression[J]. J Virol, 2005, 79(9)∶ 5414-5420.
[7] Hsu T H, Chu C C, Jiang S Y, et al. Expression of the class II tumor suppressor gene RIG1 is directly regulated by p53 tumor suppressor in cancer cell lines[J]. FEBS Letters, 2012, 586(9)∶ 1287-1293.
[8] Taura M, Eguma A, Suico M A, et al. p53 regulates Toll-like receptor 3 expression and function in human epithelial cell lines[J]. Mol Cell Biol, 2008, 28(21)∶6557-6567.
[9] Mori T, Anazawa Y, Iiizumi M, et al. Identification of the interferon regulatory factor 5 gene (IRF-5) as a direct target for p53[J]. Oncogene, 2002, 21(18)∶ 2914-2918.
[10] Munoz-Fontela C, Macip S, Martinez-Sobrido L, et al. Transcriptional role of p53 in interferon-mediatedantiviral immunity[J]. J Exp Med, 2008, 205(8)∶ 1929-1938.
[11] Takaoka A, Hayakawa S, Yanai H, et al. Integration of interferon-alpha/beta signalling to p53 responses in tumour suppression and antiviral defence[J]. Nature,2003, 424(6948)∶ 516-523.
[12] Gossen M, Bujard H. Tight control of gene expression in mammalian cells by tetracycline-responsive promoters[J]. Proc Natl Acad Sci USA, 1992, 89(12)∶ 5547-5551.
[13] Kistner A, Gossen M, Zimmermann F, et al. Doxycyclinemediated quantitative and tissue-specific control of gene expression in transgenic mice[J]. Proc Natl Acad Sci USA, 1996, 93(20)∶ 10933-10938.
[14] Lane DP∶ Cancer. p53, guardian of the genome[J]. Nature,1992, 358(6381)∶ 15-16.
[15] Levine A J, Oren M. The first 30 years of p53∶ growing ever more complex[J]. Nat Rev Cancer, 2009, 9(10)∶ 749-758.
(上接封二)
细菌
湖南省猪源粪肠球菌耐药性分析 ...........................................................................王送林,等(2-41)
血清15型鹅源鸭疫里默氏杆菌的分离鉴定及交叉免疫保护研究 ........................姜安安,等(3-17)
应用抑制性差减杂交筛选鸭疫里默氏杆菌强弱菌株基因组的差异片段 .................俞 慧,等(3-24)
上海副猪嗜血杆菌分离鉴定及其耐药性分析 ...........................................................张 悦,等(4-25)
上海市动物源性食品中单增李斯特菌的流行病学及生物被膜形成能力研究..........................................................................................................................王少辉,等(4-31)
猪源假结核耶尔森氏菌的分离与鉴定 ...................................................................石於友,等(5-36)
鸭疫里默氏杆菌pfs基因的克隆表达及单克隆抗体制备 ......................................范国博,等(5-41)
链球菌蛋白G的结构域重构、表达及鉴定 ..............................................................许 瑞,等(5-46)
副猪嗜血杆菌外膜蛋白PlpD基因的原核表达及免疫保护性分析 .......................刘秋菊,等(5-53)
猪清道夫受体SRA/CD204多克隆抗体的制备以及该受体介导的细菌吞噬功能分析..........................................................................................................................黎倩倩,等(6-42)
致病性副溶血弧菌三重PCR检测方法的建立和评价 ...........................................何再平,等(6-48)
副溶血弧菌TDH蛋白高效表达、免疫原性分析及初步应用 ...............................李欣彤,等(6-56)
天津市奶牛乳房炎葡萄球菌的分离鉴定及药敏试验 ............................................马腾宇,等(6-63)
寄生虫
犬吉氏巴贝斯虫截短型抗原BgTRAP的重组表达及其在诊断上的初步应用..........................................................................................................................杨其清,等(1-21)
动物园野生动物消化道寄生虫感染调查 ..................................................................罗 琴,等(1-27)
日本血吸虫PDIA3的原核表达和多抗血清制备 ......................................................刘 群,等(1-33)
日本血吸虫SjCHGC06822蛋白诱导BALB/c小鼠免疫保护效果观察 ................段明明,等(1-39)
柔嫩艾美耳球虫乳酸脱氢酶单克隆抗体的制备及其在蛋白定位中的应用 .............李 莎,等(2-47)
柔嫩艾美耳球虫沉默信息调节因子2 真核表达质粒的构建及在细胞中的表达..........................................................................................................................杨斯涵,等(2-53)
环形泰勒虫表面抗原重组蛋白Tasp-Tams1-Spag1生物信息学分析与原核表达.............................................................................................................................任 方,等(2-60)
日本血吸虫混合与单性感染雌虫的形态观察及凋亡检测 ........................................韩 愉,等(3-30)
基于微小隐孢子虫重组CP15/60蛋白的间接ELISA检测方法的建立及上海市猪隐孢子虫感染情况调查 ...................................................................................................刘宇轩,等(4-37)
喜鹊和山斑鸠体内棘口科吸虫的种类鉴定............................................................梁思婷,等(4-44)
兔感染日本血吸虫后血浆中宿主源循环microRNAs变化研究 ............................王宇清,等(5-58)
毒害艾美耳球虫第二代裂殖子cDNA文库的构建 ................................................蔡秀清,等(5-65)
华南虎狮弓蛔虫三种线粒体基因的遗传进化分析 ................................................宋美冉,等(6-68)
其他
牛源ISG15 蛋白的原核表达及抗血清的制备 ..........................................................陶 洁,等(2-68)
磺胺氯吡嗪钠单克隆抗体的制备及鉴定 ..................................................................张 梦,等(3-36)
鸭Toll样受体3实时荧光定量PCR检测方法的建立 ..........................................宋凯杰,等(3-42)
鸭TLR3基因胞外区的原核表达及抗体制备 ........................................................宋凯杰,等(5-70)
Tet-On系统调控p53稳定表达的H1299细胞系的建立与应用..........................................................................................................................武专昌,等(6-76)
·简报·
一株雏鹅呼肠孤病毒的分离与鉴定 .......................................................................陈红梅,等(1-47)
人工感染猫芮氏等孢球虫卵囊排出规律的观察 ....................................................张祖航,等(1-51)
四川省山羊多头蚴线粒体cox2基因序列测定及种系发育分析............................郝桂英,等(1-54)
转基因羊对体表吸血蜱的生物学特性影响............................................................周勇志,等(1-60)
采用泊洛沙姆为佐剂的O型口蹄疫多肽疫苗对大鼠脾细胞的增值作用 .............王霄旸,等(2-74)
鸭甲肝病毒与新型呼肠孤病毒复合RT-PCR检测方法的建立 ............................孙晓军,等(3-50)
2011~2014年上海市屠宰场上市肉猪主要病毒感染情况调查 ..............................鞠厚斌,等(3-55)
川藏黑猪与长白猪仔猪猪瘟母源抗体消长规律比较研究 .....................................于吉锋,等(3-61)
新疆喀什部分地区驴梨形虫病检测初报 ............................................卡丽比努尔·尔肯,等(3-65)
新疆阿勒泰富蕴县马自然感染消化道线虫情况初报 .............................图尔荪·萨迪尔,等(3-69)
猪圆环病毒2型Cap蛋白在杆状系统中的表达与纯化 ...........................................张 晓,等(4-53)
洱源县马街自然村奶牛血吸虫病综合治理防控效果观察 .....................................杨志平,等(4-57)
羊源长角血蜱吸血后中肠优势菌群分析 ...............................................................廖芷卉,等(4-61)
2010~2014年上海规模猪场母猪群伪狂犬病毒感染抗体血清学调查 ..................夏炉明,等(5-75)
·综述·
蓝氏贾第虫致病机制的研究进展 .............................................................................武 省,等(1-64)
巴贝斯虫感染对宿主红细胞及免疫系统的影响 ....................................................魏金龙,等(1-71)
中国蛙类吸虫种类与地理分布 ..............................................................................门启斐,等(1-78)
四种钙信号蛋白及其在寄生虫学上的初步研究 ....................................................王自文,等(2-78)
寄生虫潜在药物靶标—乳酸脱氢酶 ..........................................................................李 莎,等(3-73)
传染性法氏囊病病毒蛋白功能的研究进展............................................................孙晓媛,等(3-81)
应激颗粒和抗病毒先天性免疫 ..............................................................................董路娜,等(4-65)
副猪嗜血杆菌毒力因子的研究进展 .......................................................................贾爱卿,等(4-72)
寄生虫烯醇化酶的研究进展 .....................................................................................陈 宁,等(4-81)
蜱半胱氨酸蛋白酶分子研究进展 ...........................................................................于新茂,等(5-79)
ESTABLISHMENT AND APPLICATION OF P53 INDUCED EXPRESSION H1299 CELL LINE
WU Zhuan-chang1, WANG Xin2, WEI Jian-chao1, YANG Yi-fan3, ZHAO Qiu-hua4, SHAO Dong-Hua1,LI Yu-ming1,QI Peng-fei1, LIU Ke1, LI Pei-pei1, QIU Ya-feng1, MA Zhi-yong1
(1. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2. College of Life Science, Linyi University, Linyi 276005,China; 3. School of Life Sciences and Biotechnology, Shanghai Jiaotong University, Shanghai 200240, China; 4. Minhang Center of Animal Disease Prevention and Control in Shanghai, Shanghai 201109, China)
To explore new biological functions of p53, the inducable expression cell line p53-Tet H1299 was established using Tet-on technique in p53-defi cient H1299 cells. The p53 expression was regulated under doxycycline (Dox) in a dose-dependent manner. The Doxinduced p53 exhibited abilities to localize in the nuclei and to transactivate its target genes, such as p21, TLR3 and Bax. The replication of Vesicular stomatitis virus (VSV) was signifi cantly inhibited in p53-Tet H1299 with Dox treatment. The established p53-Tet H1299 cell line would be used as a cell model for exploring the new functions of p53, such as the antiviral mechanisms and the transcription of novel target genes.
p53; Tet-on; H1299; Dox; antiviral role
S852.723
A
1674-6422(2015)06-0076-07
2015-09-01
国家自然科学基金面上项目(81371814、81171547、81201266);公益性行业(农业)科研专项(201303045)
武专昌,男,博士研究生,预防兽医学专业
马志永,E-mail:zhiyongma@shvri.ac.cn
