阿魏酸酯酶与纤维素酶协同水解麦麸释放阿魏酸的研究
2015-11-20曾妍于皓杰杨标殷欣邬敏辰
曾妍,于皓杰,杨标,殷欣,邬敏辰*
(1.江南大学药学院,江苏无锡 214122;2.江南大学无锡医学院,江苏无锡 2141222;3.江南大学生物工程学院,江苏无锡 214122)
阿魏酸酯酶与纤维素酶协同水解麦麸释放阿魏酸的研究
曾妍1,于皓杰2,杨标2,殷欣3,邬敏辰*2
(1.江南大学药学院,江苏无锡 214122;2.江南大学无锡医学院,江苏无锡 2141222;3.江南大学生物工程学院,江苏无锡 214122)
研究了重组阿魏酸酯酶和纤维素酶协同作用水解去淀粉麸皮对阿魏酸释放量的影响。以高效液相色谱法检测阿魏酸的提取量,结果显示,底物的超声预处理最佳条件为350 W,20 min,是未经超声处理的底物阿魏酸释放率的1.45倍,单独使用阿魏酸酯酶(reAoFaeA)30 U时阿魏酸的释放率仅为4.1%,单独使用纤维素酶(rAuCel12A)并不释放阿魏酸,当两种酶协同作用时,阿魏酸的释放率明显提高,经单因素试验确定双酶协同作用的最佳条件为:reAoFaeA的最适添加量为30 U,rAuCel12A的最适添加量为70 U,水解时间为10 h,水解温度为40℃,水解pH为5.0,料液质量体积比为1 g:30 mL,此时阿魏酸的释放率为23.6%。该结果表明,去淀粉麸皮中纤维素的降解,对提高阿魏酸酯酶水解释放阿魏酸效率具有重要作用。
阿魏酸酯酶;纤维素酶;淀粉麸皮;协同作用;阿魏酸
阿魏酸酯酶(E.C.3.1.1.73,ferulie acid esterase,FAE)又称肉桂酸酯酶,是羧酸酯水解酶的一个亚类,也是一种胞外酶。它的主要功能是水解植物细胞壁中多糖与阿魏酸连接的酯键,释放出游离的单体阿魏酸或阿魏酸二聚体[1]。阿魏酸酯酶的产物阿魏酸(Ferulic acid,FA)是一种天然有效的抗氧化剂,具有清除氧自由基,降低胆固醇,抗血栓和动脉粥样硬化,抗菌消炎,抗肿瘤,抗衰老,抗病毒,抗紫外辐射等生理功能[2,3]。FA毒性很低,在日本和美国,FA己被作为抗氧化剂应用于食品添加剂中[4]。
我国是小麦生产大国,近年来小麦的年产量超1亿多吨,每年仅小麦加工生产的副产品—麦麸高达2 000多万吨,多被丢弃或用作动物饲料。麸皮中被发现含有丰富的FA,因此,它也成为生产FA的优质原材料[3]。目前,酶法水解植物纤维质制备FA由于其反应条件温和,专一性强,对环境友好已成为广泛研究的热点[5]。在植物细胞壁上,FA连接于木聚糖侧链,纤维素与木聚糖之间形成的空间阻碍是影响FAE作用的因素之一,单一使用FAE,并不能很好地渗入木聚糖分子内部,影响酶与底物的有效接触,导致水解率低。已有报道表明,FAE可以协同木聚糖酶等半纤维素酶提高植物纤维质中FA的释放量[6,7],然而,关于纤维素酶与FAE协同作用释放FA的研究比较少。作者利用本实验室发酵的重组阿魏酸酯酶(reAoFaeA)与重组纤维素酶(rAuCel12A)协同作用去淀粉麸皮释放FA,从底物超声预处理,酶液添加量,酶解时间,温度,pH,料液比等方面对探讨了双酶协同作用的工艺条件。
1 材料与方法
1.1 菌株和培养基
分别产阿魏酸酯酶和纤维素酶的工程菌株GS115/AofaeA和GS115/Aucel12A均为本实验室构建保存[8,9]。BMGY和BMMY培养基参考Multi-Copy Pichia Expression Kit操作手册。
1.2 材料和试剂
FA标准品、阿魏酸甲酯:购自美国Sigma公司;YNB、生物素、酵母粉、蛋白胨:购自上海Sangon公司;麸皮购自农贸市场;色谱纯甲醇:购自江苏汉邦试剂有限公司;其它化学试剂均为国产或进口分析纯。
1.3 主要设备仪器
戴安UltiMate-3000高效液相色谱仪:戴安(中国)有限公司产品;ZW&A-C18反相色谱柱(4.6 mm×260 mm,5 μm):无锡科奥美萃生物科技有限公司产品;恒温水浴摇床:江苏太仓市实验设备厂产品;Pellico超滤系统:Millipore公司产品。
1.4 重组阿魏酸酯酶和纤维素酶的制备
按文献[10]的方法诱导表达重组酵母GS115/ AofaeA和GS115/Aucel12A,分别获得reAoFaeA和rAuCel12A。将reAoFaeA和rAuCel12A利用Pellico超滤系统进行超滤浓缩。reAoFaeA的酶活力按文献[8]的方法测定,rAuCel12A的酶活力按文献[9]的方法测定。
1.5 麸皮中FA总量的测定
去淀粉麸皮(DSWB)按照文献[11]的方法制备。麸皮中FA的总量以碱法提取得到的FA计算[12]。FA释放率为FA的酶解释放量占碱提取的FA总量的百分率。FA质量分数的测定采用HPLC法。色谱条件:戴安UltiMate-3000高效液相色谱仪,ZW&AC18反相色谱柱,紫外检测器,检测波长320 nm,柱温为30℃,流动相为甲醇和体积分数1%乙酸二步梯度洗脱(0~10 min内甲醇体积分数由20%上升为50%,10~20 min内甲醇体积分数由50%上升为80%),流量为1 mL/min,进样量为20 μL。
1.6 底物超声处理对FA释放率的影响
准确称取0.5 g DSWB,加入10 mL 50 mmol/L磷酸盐(pH 5.0)缓冲液,以不同的超声时间和超声功率25℃下超声对底物进行预处理,然后加入60 U的rAuCel12A和30 U的reAoFaeA,置于40℃恒温水浴摇床反应10 h,以未经超声处理的底物作为对照,考察底物超声预处理对FA释放率的影响。
1.7 reAoFaeA和rAuCel12A添加量对FA释放率的影响
将0.5 g预处理的DSWB加入60 U的rAuCel12A和不同量的reAoFaeA,以50 mmol/L磷酸盐(pH 5.0)缓冲液将反应体系补至终体积为30 mL,40℃反应10 h,观察reAoFaeA添加量对FA释放率的影响。
将0.5 g预处理的DSWB,加入饱和量的reAoFaeA,并在此基础上,加入不同量的rAuCel12A,以50 mmol/L磷酸盐(pH 5.0)缓冲液将反应体系补至终体积为30 mL,40℃反应10 h,观察rAuCel12A的添加量对reAoFaeA水解DSWB,释放FA的影响。
1.8 酶解时间对FA释放率的影响
将0.5 g预处理的DSWB加入饱和量的reAoFaeA和rAuCel12A,以50 mmol/L磷酸盐(pH 5.0)缓冲液将反应体系补至终体积为30 mL,于40℃恒温水浴摇床中分别反应0~16 h,每2 h取样测定,观察酶解时间对FA释放率的影响。
1.9 酶解温度对FA释放率的影响
将0.5 g预处理的DSWB,加入饱和量的reAoFaeA和rAuCel12A,以50 mmol/L磷酸盐(pH 5.0)缓冲液将反应体系补至终体积为30 mL,于32~52℃(每4℃一个间隔)反应10 h,观察酶解温度对FA释放率的影响。
1.10 酶解pH对FA释放率的影响
将0.5 g预处理的DSWB,加入饱和量的reAoFaeA和rAuCel12A,以50 mmol/L pH 4.2~6.2(每0.4一个间隔)的磷酸盐缓冲液将反应体系补至终体积为30 mL,于最适温度下反应10 h,观察酶解pH对FA释放率的影响。
1.11 料液质量体积比对FA释放率的影响
将0.5 g预处理的DSWB加入饱和量的reAoFaeA和rAuCel12A,以50 mmol/L磷酸盐最适pH的磷酸盐缓冲液将反应体系补至不同终体积,于最适作用温度下反应10 h,观察不同料液比对FA释放率的影响。
2 结果与分析
2.1 底物超声处理对FA释放率的影响
由图1可知,底物经适当的超声处理可以增加FA的释放率。在不同的超声功率条件下,超声时间在0~20 min范围内,FA释放率均随超声时间的延长呈显著增加趋势;而超声时间超过20 min时,FA提取率却略有下降减少,这可能是超声时间的延长对FA结构的破坏作用导致其释放率下降。因此,最佳超声时间为20 min。当超声功率达到350 W时,释放率达到最大,达到20.8%,是未经超声处理的底物FA释放率的1.45倍,超声波在溶剂中形成“空化效应”,使液-固之间发生相互渗透,促使麸皮中FA溶解与提取。当功率超过350 W后释放率有下降的趋势,这可能是由于FA不稳定,超声功率过强可能会促使其发生分解。
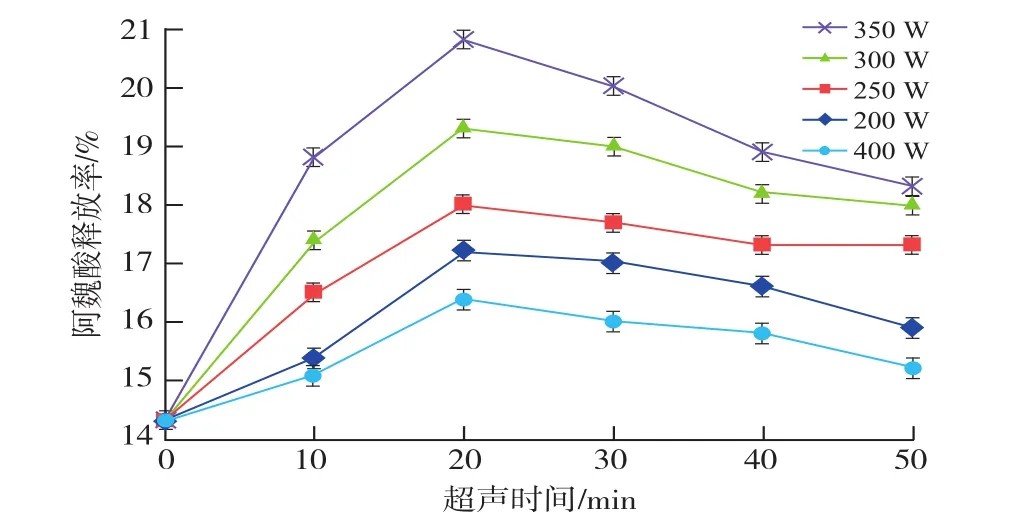
图1 超声处理对FA释放率的影响Fig.1InfluenceofultrasonicpretreatmentonFAextraction
2.2 reAoFaeA与rAuCel12A添加量对FA释放率的影响
固定rAuCel12A为60 U,加入0~50 U的reAoFaeA,考察reAoFaeA的最适添加量。结果如图2(a)所示,当加入reAoFaeA量为0 U时,体系不释放FA,当reAoFaeA添加量在0~30 U范围内,FA释放率不断增大,加入量为30 U时,FA释放率达到20.8%。但当加入量大于30 U时,FA释放率变化趋势平缓,可能由于底物已趋于饱和,进一步添加reAoFaeA不能增加水解率。因此,reAoFaeA的最适添加量为30 U。在加入30 U reAoFaeA的基础上,再加入0~80 U rAuCel12A,考察rAuCel12A的最适添加量。如图2(b)所示,仅加入30 U reAoFaeA时FA的释放率为4.1%,当加入rAuCel12A量达到70 U时FA释放率达到22.9%,是FA单独作用时的5.58倍,因此,rAuCel12A的最适添加量为70 U。证明FAE与纤维素酶在水解麸皮释放FA时有协同作用。


图2 reAoFaeA和rAuCel12A添加量对FA释放率的影响Fig.2Influence of different activity units of reAoFaeA and rAuCel12A on FA extraction
2.3 酶解时间对FA释放率的影响
在30 U reAoFaeA和70 U rAuCel12A存在条件下,酶解体系反应0~16 h,考察最佳酶解时间。结果如图3所示,在0~10 h之间,FA释放率随着酶解时间的延长而逐渐升高。当酶解10 h时,FA的释放率为22.9%,但当酶解时间大于10 h时,FA释放率趋于平稳,达到16 h时有明显的下降,这可能与FA本身的稳定性有关。因此,最佳酶解时间为10 h。

图3 酶解时间对FA释放率的影响Fig.3Influence of incubation time on FA extraction
2.4 酶解温度对FA释放率的影响
在30 U reAoFaeA和70 U rAuCel12A存在条件下,酶解体系分别在不同的温度下反应10 h,考察最佳酶解温度。结果如图4所示,当反应温度在32~40℃之间时,FA释放率随着温度的升高而提高。当反应温度为40℃时,FA的释放率则达到22.9%。但当酶解温度大于40℃时,FA释放率降低,尤其当温度大于48℃时,释放率骤降。这与酶的温度稳定性有关,高温会使酶的稳定性降低,从而降低了FA的释放率。因此,最佳酶解温度为40℃。

图4 酶解温度对FA释放率的影响Fig.4Influence of incubation temperature on FA extraction
2.5 酶解pH对FA释放率的影响
将0.5 g预处理的DSWB悬浮于50 mmol/L不同pH的磷酸盐缓冲液中,加入30 U reAoFaeA和70 U rAuCel12A,在40℃下反应10 h,考察最佳酶解pH。结果如图5所示,当pH为5.0时,FA释放率达到最高22.9%。当pH高于5.8时,FA的释放率明显降低。这与酶的pH稳定性有关,pH过高或过低都会使酶的稳定性降低,从而降低了FA的释放率。因此,最佳酶解pH为5.0。

图5 酶解pH对FA释放率的影响Fig.5Influence of incubation pH on FA extraction
2.6 料液质量体积比对FA释放率的影响
将0.5 g预处理的DSWB悬浮于不同体积的50 mmol/L磷酸盐缓冲液中,加入30 U reAoFaeA和70 U rAuCel12A,在40℃下反应10 h,考察最佳料液比。结果如图6所示,当料液质量体积比为1 g∶30 mL时,相应的释放率为23.6%。当料液质量体积比在1 g∶10 mL~1 g∶30 mL范围内,料液质量体积比的增加促进了FA的释放率,可能由于较低的水分影响了酶分子的扩散速率以及水分的流动性,使得体系分布不均匀,酶的传质增加而使酶和底物不能够充分接触,因而降低了FA的释放率。当料液质量体积比大于1 g∶30 mL时FA的释放率变化不大,因此,选择最佳酶解料液质量体积比为1 g∶30 mL。

图6 料液质量体积比对FA释放率的影响Fig.6Influence of ratio of solid to liquid on FA extraction
3 结语
利用麦麸获得高营养价值和高经济价值的深加工产品FA,对小麦麸皮进一步深加工具有重要意义。采用FAE与木聚糖酶及其他辅助酶作用于麦麸,释放大量的FA已得到广泛研究。其中FAE与木聚糖酶系的协同作用研究较多,Faulds[6]等人率先报道了黑曲霉(Aspergillus niger)FAE-Ⅲ与绿色木霉(Trichoderma viride)木聚糖酶的协同作用,当两种酶共同作用于小麦麸皮时,FA释放量达到麸皮中总FA含量的95%,比FAE-Ⅲ单独作用时提高了近24倍。Wang[7]等人从嗜酸乳酸杆菌(Lactobacillus acidophilus)中分离得到的一种新型FAE,单独使用水解100 mg DSWB并不释放FA,分别与木聚糖酶和α-L-阿拉伯糖苷酶协同作用最大可以得到12.4 nmol和3.64 nmol的FA,3种酶共同作用最大可以得到15.7 nmol的FA,证明以木聚糖酶为主,α-L-阿拉伯呋喃糖苷酶为辅可以协同作用FAE促进FA的释放。FAE与纤维素酶协同作用的研究主要集中在对植物细胞壁的降解上,曾薇[13]等人利用FAE与纤维素酶水解气爆稻草,证明FAE的添加可以促进纤维素酶对天然木质纤维素的酶解效率,提高原料可及度50%以上。Knoshaug[14]等人从青霉菌(Penicillium funiculosum)中分离出两种FAE(FaeA和FaeB),分别与纤维素酶协同作用水解玉米秸秆可以提高19%和7%的纤维二糖的释放量,3种酶共同作用可以提高25%的纤维二糖的释放量。然而,在释放FA的角度,探讨关于FAE与纤维素酶协同作用的报道较少。
作者以DSWB为研究对象,经单因素试验确定reAoFaeA和rAuCel12A协同作用DSWB,高效获得FA的条件为:0.5 g底物DSWB经超声350 W处理20 min,reAoFaeA的最适添加量为30 U,rAuCel12A的最适添加量为70 U,最佳酶解时间为10 h,最佳酶解温度为40℃,最佳pH为5.0,最佳料液质量体积比为1 g∶30 mL,此时FA的释放率为23.6%,明显高于FAE单独作用时的释放率(4.1%),证实了纤维素所形成的空间位阻也是影响FA释放率的一个重要因素。
由此可以推测FAE、木聚糖酶和纤维素酶3种酶共同作用,同时切断木聚糖的长链和降低纤维素的位阻,阿魏酸释放率将会得到进一步的提高。
[1]Nieter A,Haase-Aschoff P,Linke D,et al.A halotolerant type A feruloyl esterase from Pleurotus eryngii[J].Fungal Biology,2014,118(3):348-357.
[2]Mathew S,Abraham TE.Ferulic acid:An antioxidant found naturally in plant cell walls and feruloyl esterases involved in its release and their applications[J].Critical Reviews in Biotechnology,2004,24(2-3):59-83.
[3]Koseki T,Fushinobu S,Ardiansyah,et al.Occurrence,properties,and applications of feruloyl esterases[J].Applied Microbiology and Biotechnology,2009,84(5):803-810.
[4]龚燕燕,殷欣,邬敏辰,等.宇佐美曲霉阿魏酸酯酶A基因的克隆表达及酶学性质研究[J].食品与生物技术学报.2013,7:706-712.
GONG Y Y,YIN X,WU MC,et al.Cloning,expression and enzymatic characterization of feruloyl esterase A from Aspergillus usamii[J].Journal of Food Science and Biotechnology,2013,7:706-712.
[5]Wong DWS,Chan VJ,Batt SB,et al.Engineering Saccharomyces cerevisiae to produce feruloyl esterase for the release of ferulic acidfrom switchgrass[J].Journal of Industrial Microbiology and Biotechnology,2011,38:1961-1967.
[6]Faulds CB,Williamson G.Release of ferulic acid from wheat bran by a ferulic acid esterase(FAE-Ⅲ)from Aspergillus niger[J]. Applied Microbiology and Biotechnology,1995,43(6):1082-1087.
[7]Wang XK,Geng X,Egashirar Y,et al.Release of ferulic acid from wheat bran by an inducible feruloyl esterase from an intestinal bacterium Lactobacillus acidophilus[J].Food Science and Technology Research,2005,11(3):241-247.
[8]曾妍,龚燕燕,邬敏辰,等.阿魏酸酯酶A的基因克隆与表达及其水解产物的纯化[J].生物工程学报.2014,30(3):425-434.
ZENG Y,GONG Y Y,WU M C,et al.Gene cloning,expression of a feruloyl esterase A and purification of its hydrolysis products[J]. Chinese Journal of Biotechnology,2014,30(3):425-434.
[9]Shi HL,Yin X,Wu MC,et al.Cloning and bioinformatics analysis of an endoglucanase gene(Aucel12A)from Aspergillus usamii and its functional expression in Pichia pastoris[J].Journal of Industrial Microbiology and Biotechnology,2012,39(2):347-357.
[10]Li JF,Zhao SG,Tang CD,et al.Cloning and functional expression of an acidophilic β-mannanase gene(Anman5A)from Aspergillus niger LW-1 in Pichia pastoris[J].Journal of Agricultural and Food Chemistry,2012,60(3):765-773.
[11]Johnson KG,Harrison BA,Schneider H,et al.Xylan-hydrolysing enzymes from Streptomyces spp[J].Enzyme and Microbial Technology,1988,10(7):403-409.
[12]Tilay A,Bule M,Kishenkumar J,et al.Preparation of ferulic acid from agricultural wastes:Its improved extraction and purification[J].Journal of Agricultural and Food Chemistry,2008,56(17):7644-7648.
[13]曾薇,陈洪章.阿魏酸酯酶和纤维素酶在水解汽爆稻草中的协同作用[J].生物工程学报,2009,25(1):49-54.
ZENG W,CHEN H Z.Synergistic effect of feruloyl esterase and cellulase in hydrolyzation of steam-exploded rice straw[J]. Chinese Journal of Biotechnology,2009,25(1):49-54.
[14]Knoshaug EP,Selig MJ,Baker JO,et al.Heterologous Expression of Two Ferulic Acid Esterases from Penicillium funiculosum[J]. Applied Biochemistry and Biotechnology,2008,146(1-7):79-87.
Synergistic Effect of Feruloyl Esterase and Cellulase on the Release of Ferulic Acid from Wheat Bran
ZENG Yan1,YU Haojie2,YANG Biao2,YIN Xin3,WU Minchen*2
(1.School of Pharmaceutical Science,Jiangnan University,Wuxi 214122,China;2.Wuxi Medical School,Jiangnan University,Wuxi 214122,China;3.School of Biotechnology,Jiangnan University,Wuxi 214122,China)
The synergistic effect of feruloyl esterase and cellulose on the release of ferulic acid from de-starched wheat bran(DSWB)was studied.The HPLC results showed that DSWB which was ultrasonically pretreated at a power of 350 W for 20 minutes released ferulic acid at a level of 1.45-fold more than that unpretreated.ReAoFaeA(30 U)by itself released only 4.1%of total alkaliextractable ferulic acid from wheat bran,while no ferulic acid released if rAuCel12A was used.The rate of ferulic acid released was significantly increased when both enzymes were used.The conditions using two enzymes simultaneously were optimized by a single factor test.A maximum of 23.6%totalferulic acid released could be reached in combinations of 30 U reAoFaeA and 70 U rAuCel12A with the ratio of solid to liquid of 1∶30(g∶mL)at pH 5.0 and treated under 40°C for 10 h.
feruloyl esterase,cellulase,starched wheat bran,synergistic action,ferulic acid
Q 786
A
1673—1689(2015)04—0379—06
2014-06-13
国家自然科学基金项目(31271811)。
*通讯作者:邬敏辰(1962-),男,江苏无锡人,理学博士,教授,博士研究生导师,主要从事酶工程与基因工程研究。Email:bioch@163.com
