应用脱枝酶提取大米蛋白质的研究
2015-11-20黄武宁王嘉宇肖静
黄武宁,王嘉宇,肖静
(1.义乌市海之纳生物工程有限公司,浙江义乌 322000;2.南京大学生命科学学院,江苏南京 210093)
应用脱枝酶提取大米蛋白质的研究
黄武宁1,王嘉宇2,肖静1
(1.义乌市海之纳生物工程有限公司,浙江义乌 322000;2.南京大学生命科学学院,江苏南京 210093)
为了提高大米蛋白提取的效率及质量,将一种新型的淀粉水解酶-脱枝酶引入大米蛋白的酶法提取工艺中。使用高效体积排阻色谱(HPSEC)分析相对分子质量分布表明大米淀粉经脱枝酶作用后重均相对分子质量降低明显;同时氢谱核磁共振图谱显示脱枝酶可将大米淀粉的α-1,6-糖苷键彻底水解,为糖化酶的水解提供了良好条件。将脱枝酶与糖化酶协同作用于大米制糖后的液化米渣,最终可将大分子的糊精完全水解为水溶性的寡糖从而除去,较单独使用糖化酶总糖的去除率提高39.7%。所获得大米粗蛋白的总氮质量分数达到90.58%,纯度较传统酶法提取大为提高。
大米蛋白;酶法提取;脱枝酶
大米中含有约质量分数80%的淀粉和7%的蛋白质[1],其中的淀粉是人类主要食物来源之一。大米除了为人直接使用外,还有相当一部分用于制糖,与玉米、马铃薯、小麦等同为主要的制糖原料作物。大米制糖后会产生约含有蛋白质质量分数60%左右的废渣,国内主要将其简单处理后作为饲料使用,附加值极低。近年来的研究表明,大米蛋白的生物价(B.V.)和蛋白价(P.V.)在各种粮食蛋白中均居第一位[2],含有人体所需的全部氨基酸,是一种完全蛋白质;大米又是唯一可以免于过敏实验的谷物,这些使得大米蛋白被公认为优质食品蛋白质,尤其适合用于保健品和婴幼儿食品中。
传统的大米蛋白提取方式是碱法提取[3]。其优点是工艺简单,提取率高,蛋白质收率可达90%以上。但由于高碱性环境会引起分子间交叉耦合和重排,破坏多种氨基酸,甚至产生毒性物质Lysinoalnine等[4]。相比较碱法提取,通过使用淀粉酶水解淀粉而提取大米蛋白质的酶法提取条件更为温和,产品也更为安全。随着酶制剂研究的进展,越来越多具有优异性能的淀粉水解酶被开发出来,这些新型酶制剂的应用,将会使大米蛋白质酶法提取的效率及产品质量进一步提高。
脱枝酶能够水解淀粉中的α-1,6-糖苷键,当它与其它淀粉酶协同作用时可实现淀粉的彻底水解[5,6]。作者研究了一种新型脱枝酶对大米淀粉的作用机制,优化了其与其他酶制剂协同作用的工艺条件,为大米蛋白质的酶法提取工艺中引入淀粉脱枝步骤提供了理论依据和应用实例。
1 材料与方法
1.1 材料与试剂
材料:大米:采用东北大米;液化酶,糖化酶:江苏奥谷生物工程公司提供;NaOH,HCl等均为分析纯试剂。
1.2 仪器与设备
Waters 600高效液相色谱仪:美国Waters公司产品;ICS-5000离子色谱仪:美国Dionex公司产品;液相色谱系统Agilent 1100 Series:美国Agilent公司产品;AVANCE III 400 MHz全数字化核子共振谱仪:瑞典Bruker公司产品;UV-2100分管光度计:上海尤尼科仪器有限公司产品;SLSC超级恒温水油槽:南京顺流有限公司产品。
1.3 试验方法
1.3.1 米渣原料的预处理及酶水解反应大米制糖后的残渣经过烘干后,过60目筛筛分获得米渣样品。将米渣于缓冲液中配制成质量分数30%的溶液,分别使用液化酶10 U/g、糖化酶10 U/g、脱枝酶10 U/g及其中几种酶的组合,于50℃pH 6.0的条件下酶解。反应结束后灭酶,离心获得上清组分后以待分析。
1.3.2 分析条件高效体积排阻色谱(HPSEC)条件:Ultrahydrogel Linear 300 mm×7.8 mm色谱柱;流动相:0.1 mol/L NaNO3;流量:0.9 mL/min;柱温:45℃;进样量:20 μL。
高效阴离子交换色谱-脉冲安培检测法(PADHPAEC)条件:CarboPac PA-200 3 mm×150 mm色谱柱;ED40电化学检测器;流动相:0.25 mol/L NaOH(A),1 mol/L NaAc+0.1 mol/L NaOH(B)+H2O(A),流动相比例见表1;流量:0.5 mL/min;进样量:20 μL。

表1 高效离子交换色谱分离条件Table 1Mobile phase composition of HPAEC
氢核磁共振谱(1H-NMR)条件:样品溶于D2O中配制成10 mg/mL的溶液并于70℃搅拌过夜,使得淀粉分子与D2O充分交换羟基质子。检测温度:60℃;5 mm探头定量;以4、4-二甲基-4-硅代戊磺酸钠(DSS)作为内标;为保证最优信噪比使用每个样品调谐探头;使用Bruker UXNMR软件处理原始一维数据经傅里叶变换得到的图谱。
寡糖的高效液相色谱(HPLC)条件;Waters Xbridge BEH Amide 150 mm×D2.1 mm色谱柱;示差折光检测器;流动相:体积分数70%乙腈;流量:1.0 mL/min;柱温:30oC;进样量:50 μL。以葡萄糖,麦芽糖及DP 3~5的麦芽寡糖为标准物,定量分析产物中的寡糖成分。
蛋白质的测定依照凯式定氮法[7];水分的测定依照两次烘干测定法[8]。
2 结果与分析
2.1 脱枝酶作用对淀粉相对分子质量分布的影响
由图1可知,聚合态的大米淀粉经过HPSEC分离成单一峰,重均相对分子质量(Mw)约为3 141 000。而脱枝酶作用0.5 h后的样品呈现了两个峰,其中一个仍为聚合态的大分子淀粉,Mw约为2 041 000;另一个峰为相对分子质量较小的线性葡聚糖及寡糖,Mw约为44 000,两峰之间分布着Mw约为10 000至600 000的大分子线性葡聚糖。

图1 大米淀粉经脱枝酶水解前后的HPSEC图谱Fig.1Size exclusion HPLC of rice starch digested by debranching enzymes.A.digestion time 0 h;B.digestion time 1 h.
图2为大米淀粉及其脱枝酶水解物的氢核磁共振谱。由图中可明显看出大米淀粉中位于化学位移δ 5.35×10-6处的α-1,4糖苷键与位于化学位移δ 4.94×10-6处的α-1,6糖苷键的比例为21:1。经过脱枝酶作用,大米淀粉的α-1,6糖苷键被完全降解,转化成具有α型或β型还原末端的葡聚糖或小分子寡糖(其化学位移分别位于δ 5.21和4.65×10-6);同时,作用前后的α-1,4糖苷键的无变化,这表明该脱枝酶可彻底水解大米淀粉的α-1,6糖苷键分支点处的α-1,6糖苷键,而对α-1,4糖苷键无作用。以上结果初步揭示了该脱枝酶对于大米淀粉及同类底物的作用机制:从淀粉分子内部和外部随机及专一地作用于分支点处的α-1,6糖苷键,生成直链淀粉和麦芽寡糖,其最小水解单位为2-3个葡萄糖残基;为脱枝酶应用于大米蛋白质的提取过程提供了理论依据。Harada[9]应用凝胶排阻层析分析了Pseudomonas脱枝酶对于直链淀粉的脱枝机制。结果显示足量的脱枝酶可完全水解聚合态支链淀粉,生成线性葡聚糖,支链葡聚糖以及少量寡糖,与本研究中所使用的芽孢杆菌脱枝酶性质相近。大米蛋白质的提取首先是一个淀粉的水解过程。现有的酶法提取工艺中通过加入液化酶将大米淀粉转化为可溶性的寡糖及小分子糊精从而除去[10]。由于液化酶随机内切的特性,其单独使用在短时间内无法将大分子不溶性糊精彻底水解。而脱枝酶的添加却可以迅速除去淀粉分子的支链,从而显著提升了液化酶水解的效率,足量的脱枝酶与液化酶协同作用可实现大米淀粉的完全水解。

图2 大米淀粉经脱枝酶水解前后的氢谱图谱Fig.21H-NMR spectrum of rice starch.A.Native rice starch;B.debranching enzyme digested rice starch.
2.2 脱枝酶与液化酶和糖化酶协同作用对淀粉相对分子质量的影响
大米经过粉碎后添加液化酶于高温下水解制糖,残留的米渣中蛋白质质量分数质约为50%;其余成分主要为小分子的糊精,其相对分子质量分布如图3所示。这部分糊精的Mw约为1 348,由于支链的存在,液化酶很难将这部分糊精彻底水解。

图3 大米淀粉制糖残渣的糊精HPSEC图谱Fig.3Size exclusion HPLC of the residual dextran of rice starch saccharification.
表2为大米蛋白提取过程中各样品经HPSEC分离后主要组分的相对分子质量分布数据。结果表明,在米渣中加入脱枝酶后,样品中小分子糊精的数均相对分子质量(Mn)及Mw都显著降低;这一方面显示了液化残留极限糊精中支链成分的大量存在,另一方面也体现出脱枝酶对于淀粉彻底水解的关键作用。为了进一步降低残留糊精的相对分子质量以便将其与蛋白分离,在液化米渣脱枝后的样品中加入了糖化酶。糖化酶从直连糊精的外侧以葡萄糖为单位逐步水解,可将淀粉的相对分子质量降至最低程度。结果显示,在脱枝酶与糖化酶的协同作用下,液化极限糊精几乎全部转化为可溶性的寡糖,18 h后的反应产物中主要成分的Mw仅为356,表明此时糊精已被彻底水解。

表2 大米蛋白提取过程中各样品的相对分子质量分布Table 2Molecular weight distribution of different samples in rice protein extraction process
2.3 脱枝酶与液化酶和糖化酶协同作用对大米淀粉去除的影响
将液化米渣以pH 6.0的磷酸缓冲液配成质量分数10%的溶液,在其中分别单独加入糖化酶50 U/g糖化以及糖化酶50 U/g和脱枝酶50 U/g协同作用。于50℃反应4 h后检测上清液中水解释放出的总糖质量浓度,结果如图4所示。液化米渣溶液中总糖质量浓度为34 g/L,其中上清液中的游离总糖质量浓度为8.6 g/L。加入糖化酶和脱枝酶协同作用后,上清液中总共释放出32.7 g/L的总糖,较单独使用糖化酶提高了39.7%,基本实现了液化米渣中淀粉质物质的彻底消除。

图4 不同酶制剂作用对大米淀粉总糖水解的影响Fig.4Effect of enzymes on reducing sugar released in saccharification
2.4 脱枝酶与液化酶和糖化酶协同作用对大米蛋白提取率的影响
将液化米渣以pH 6.0的磷酸缓冲液配成质量分数10%的溶液,在其中分别单独加入糖化酶糖化以及糖化酶和脱枝酶协同作用。于50℃反应4 h后检测沉淀中的总氮含量,结果如图5所示。结果显示,液化米渣中的总氮质量分数为57.12%。作为大米蛋白的提取原料,此时主要的杂质为大分子的糊精,由于其与大米蛋白彼此紧密缠绕而很难直接分离。另一方面,由于液化过程的高温造成了大米蛋白的变性和结构压缩,进一步提高了其提取难度。糖化酶和脱枝酶的水解作用可以使蛋白从糊精中的包裹中解放出来,释放出蛋白酶的作用位点以便其进一步提纯。最终水解后的沉淀中总氮质量分数达到90.58%,得到了纯度极高的大米蛋白质。
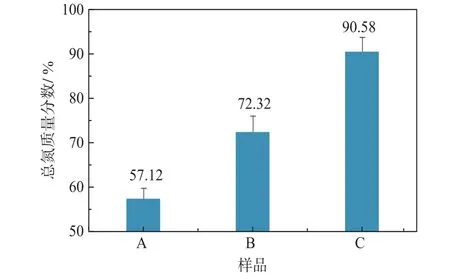
图5 不同酶制剂作用对大米蛋白提取率的影响Fig.5Effect of enzymes on yield of rice protein extraction
3 讨论
欧美发达国家很早就开展了食用大米的纯蛋白质粉的开发,形成了稳定的市场规模。目前美国亨氏公司的各种细分配方蛋白质粉占据了市场中的大部分份额,年产值超过100亿人民币。与之相比,国内企业的蛋白质粉制品竞争力不足的最大原因就在于生产技术落后,无法加工出高品质的蛋白粉产品。近年来,受疯牛病,口蹄疫和禽流感的侵扰,国内外对新蛋白质来源的需求愈加迫切。大米蛋白质因其完善的营养成分和低过敏性的特质成为最具开发前景的食用蛋白质品种。在现有的大米蛋白质生产工艺中,碱法提取收率高,但部分营养成分遭到破坏,传统的液化+糖化提取又无法保证产品的纯度。为此,将新型酶制剂-脱枝酶引入大米蛋白的酶法提取工艺中,分别从理论及实际应用考察了该酶对于大米蛋白质提取的影响。结果显示脱枝酶在液化和糖化过程中均能以很少的添加量带来大米淀粉水解率的显著提高,从而提升了大米蛋白质的提取效率及纯度。
[1]李福谦,唐书泽,李爱萍,等.碱消化法提纯大米淀粉的研究[J].食品与发酵工业,2006,31(7):55-58.
LI Fuqian,TANG Shuze,LI Aiping,et al.Isolation and purification of rice starch by alkaline digestion[J].Food and Fermentation Industries,2015,31(7):55-58.(in Chinese)
[2]Eggum B O,Cabrera M I Z,Juliano B O,et al.Protein and lysine digestibility and protein quality of cooked Filipino rice diets and milled rice in growing rats[J].Plant Foods Human Nutri,1993,43(2):163-170.
[3]万娟,陈嘉东,钟国才,等.碱法提取籼碎米中大米蛋白工艺的研究[J].现代食品科技,2009(9):1073-1075.
WAN Juan,CHEN Jiadong,ZHONG Guocai,et al.Extraction of protein from broken long-grain rice by alkali method[J].Modern Food Science and Technology,2009,25(9):1073-1075.(in Chinese)
[4]De Groot A P,Slump P,et al.Effects of severe alkali treatment of proteins on amino acid composition and nutritive value[J].J Nutri,1969,98(1):45-56.
[5]李由然,赵献春,王正祥,等.Bacillus sp.CBB272脱枝酶的酶学性质[J].食品与生物技术学报,2011,30(1):131-137.
LI Youran,ZHAO Xianchun,WANG Zhengxiang,et al.Biochemical properties of debranching enzyme from Bacillus sp.CBB272[J].Journal of Food Science and Biotechnology,2011,30(1):131-137.(in Chinese)
[6]Li Y,Zhang L,Niu D,et al.Cloning,expression,characterization,and biocatalytic investigation of a novel bacilli thermostable type I pullulanase from Bacillus sp.CICIM 263[J].J Agr Food Chem,2012,60(44):11164-11172.
[7]Read S M,Northcote D H,et al.Minimization of variation in the response to different proteins of the Coomassie blue G dye-binding assay for protein[J].Anal Biochem,1981,116(1):53-64.
[8]张骏,张慜,单良,等.真空微波工艺条件对香脆鳙鱼片品质的影响[J].食品与生物技术学报,2006,25(2):37-41.
ZHANG Jun,ZHANG Min,SHAN Liang.Effect of microwave-vacuum on the quality of crisp bighead carp slices[J].Journal of Food Science and Biotechnology,2006,25(2):37-41,47.(in Chinese)
[9]Harada T,Misaki A,Akai H,et al.Characterization of Pseudomonas isoamylase by its actions on amylopectin and glycogen: comparison with Aerobacter pullulanase[J].Biochimica et Biophysica Acta(BBA)-Enzymology,1972,268(2):497-505.
[10]郭荣荣,潘思轶,王可兴,等.碱法与酶法提取大米蛋白工艺及功能特性比较研究[J].食品科学,2005,26(3):173-177.
GUO Rongrong,PAN Siyi,WANG Kexing,et al.Comparing research on functionality of rice protein extracted by alkali and enzyme[J].Food Science,2005,26(3):173-177.(in Chinese)
Application of Debranching Enzyme for the Extraction of Rice Protein
HUANG Wuning1,WANG Jiayu2,XIAO Jing1
(1.Yiwu Highstar Biotechnology Co.Ltd.,Yiwu 322000,China;2.School of Life Scjence,Nanjing University,Nanjing 210093,China)
Debranching enzyme was used to enhance the extraction efficiency and product quality of rice protein.A significant decrease in molecular weight was detected by HPSEC for rice starch digested by debranching enzyme and the1H-NMR analysis proved that the enzyme completely hydrolyzed α-1,6-linkages,which facilitated the following function of glucoamylase.Debranching enzyme together with α-amylase and glucoamylase could entirely hydrolyze the dextrin in liquefied rice dreg after sugar processing into water soluble oligosaccharides,which increased the removal rate by 38.9%compared with the processing only through glucoamylase.The total nitrogen content of the crude protein reached up to 90.58%,which was higher than that obtained by the traditional methods.
rice protein,enzymatic extraction,debranching enzyme
Q819
A
1673—1689(2015)04—0443—05
2014-09-25
黄武宁(1964-),男,浙江东阳人,高级工程师,主要从事大米深加工技术研究。E-mail:1977513347@qq.com
