西瓜花叶病毒三抗体夹心法与纸质免疫检测传感器检测方法的建立
2015-11-20孔德昭朱怡橙马伟徐丽广胥传来
孔德昭,朱怡橙,马伟,徐丽广,胥传来*
(1.江南大学食品学院,江苏无锡 214122;2.淮阴工学院生命科学与化学工程学院,江苏淮安,223003)
西瓜花叶病毒三抗体夹心法与纸质免疫检测传感器检测方法的建立
孔德昭1,朱怡橙2,马伟1,徐丽广1,胥传来*1
(1.江南大学食品学院,江苏无锡 214122;2.淮阴工学院生命科学与化学工程学院,江苏淮安,223003)
利用西瓜花叶病毒2号外壳蛋白的小鼠单克隆抗体与兔多克隆抗体,建立两种针对西瓜花叶病毒2号的检测方法。运用现有的抗体建立了三抗体夹心酶联免疫吸附法(TAS-ELISA);运用碳纳米管与抗体包裹滤纸制备纸质免疫检测传感器,再基于电化学工作站建立电化学纸质免疫检测传感器检测方法。两种方法对实际样品检测限分别为0.15、0.20 μg/mL,检测时间分别为3 h和30 min。根据结果分析比较,三抗体夹心法具有较高的检测灵敏度,而电化学纸质免疫传感器检测方法具有更短的检测时间。
西瓜花叶病毒2号;外壳蛋白;三抗体夹心法;电化学纸质免疫检测传感器
西瓜花叶病毒2号(Watermelon mosaic viruses-2,WMV-2),一种重要的瓜类作物病毒,其侵染范围主要包括葫芦科、豆科植物,主要由病毒汁液摩擦接种传播,也可由出桃蚜、棉蚜等进行非持久性传毒,但也有非蚜传株系,现今很多国家已经报道过西瓜花叶病毒对葫芦科、豆科植物的危害[1]。
分子生物学技术检测植物病毒具有灵敏度高的优点,但是对检测样品的RNA抽提存在步骤繁琐、容易污染等缺点,而且需要专门的检测人员与检测设备[2-3]。血清学方法检测方法是传统的植物病毒的检测方法,其操作简单,可以同时检测大批量样品,但是依赖于具有高度特异性和灵敏度的抗血清[4]。为了建立快速、简便、灵敏的西瓜花叶病毒检测方法,作者利用高效价、高特异性的西瓜花叶病毒2号外壳蛋白的抗体,分别基于ELISA技术与电化学分析方法技术建立了三抗体夹心法(TASELISA)与电化学纸质免疫传感器检测方法。
1 材料与方法
1.1 材料与试剂
WMV-2感染样品(南瓜病叶)、WMV-2外壳蛋白小鼠单克隆抗体、WMV-2外壳蛋白兔多克隆抗体:中国检验检疫科学研究院动植物检疫研究所产品;明胶、3,3,5,5-四甲基联苯胺(TMB)、聚苯乙烯磺酸钠(PSS):Sigma公司产品;HRP-羊抗兔抗体:Jackson公司产品;短羧基化高纯单壁碳纳米管(TNSSC):中国科学院成都有机化学有限公司产品;预染蛋白相对分子质量标准:生兴生物技术有限公司产品;其他试剂均为分析纯试剂。
1.2 主要仪器
DHG-9070A型电热恒温鼓风干燥箱:上海精宏实验设备有限公司产品;高吸附性96孔酶标板:无锡国盛生物工程有限公司产品;FR-980A生物电泳图像分析系统:上海复日科技有限公司产品;CHI760b电化学工作站:上海辰华仪器公司产品。
1.3 试验方法
1.3.1 西瓜花叶病毒外壳蛋白纯化西瓜花叶病毒感染的南瓜病叶,加入2倍体积0.2 mol/L磷酸钠缓冲溶液(pH7.4,含体积分数1%巯基乙醇)匀浆,加入等体积氯仿,4℃搅拌30 min,充分乳化;乳化液9 000 r/min离心15 min,吸出上清水相,加入PEG6000和NaCl使其终质量分数分别为8%与4%,搅拌至溶解,4℃过夜;9 000 r/min离心25 min,弃去上清,沉淀用适量磷酸钠缓冲液悬浮,用组织研磨器匀浆后抽提;9 000 r/min离心15 min,弃去沉淀;上清经质量分数20%蔗糖溶液40 000 r/min离心2 h,弃去上清;去离子水悬浮沉淀,匀浆抽提4~5遍;少量去离子水悬浮沉淀,9 000 r/min离心15 min,上清即为提纯病毒外壳蛋白[5]。提纯病毒外壳蛋白通过SDS-聚丙烯酰胺凝胶电泳表征。电泳使用5 g/dL浓缩胶,恒压80 V 30 min,8 g/dL分离胶,恒压120 V 120 min,固定液(25 g三氯乙酸+200 mL超纯水)固定30 min,染色液(1 g考马斯亮蓝+100 mL固定液)染色5 min,脱色液(1 mL乙醇+1 mL乙酸+ 98 mL超纯水)脱色4 h,使用FR-980A生物电泳图像分析系统进行鉴定并计算相对分子质量。
1.3.2 TAS-ELISA方法的建立使用中国检验检疫科学研究院动植物检疫研究所提供的WMV-2外壳蛋白小鼠单克隆抗体为包被抗体,包被质量浓度为2 μg/mL,100 μl/孔,37℃孵育2 h,弃去液体,使用质量分数0.05%PBST溶液洗板3次,加入含0.2 g/dL明胶的CBS封闭溶液,200 μL/孔,37℃孵育2 h,重复洗板3次拍干。每孔加入100 μL不同质量浓度提纯病毒外壳蛋白溶液(0.15~10 μg/mL)或不同稀释度WMV-2感染病叶研磨液上清液,37℃孵育1 h,重复洗板3次,每孔加入100 μL 2 μg/mL WMV-2外壳蛋白兔多克隆抗体,37℃孵育1 h,重复洗板3次,每孔加入100 μL体积比1∶3 000稀释的HRP-羊抗兔抗体,37℃避光孵育30 min,重复洗板4次,每孔加入100 μL TMB底物显色液,37℃避光孵育15 min,每孔用50 μL 2 mol/L硫酸终止液终止,酶标仪检测450 nm波长吸光度值[6-7]。
1.3.3 TAS-ELISA方法特异性检测西瓜花叶病毒TAS-ELISA方法分别对不同稀释比例WMV-2感染病叶研磨液上清、健康南瓜叶片研磨液上清、建兰花叶病毒感染病叶研磨液上清、齿舌兰环斑病毒感染病叶研磨液上清进行检测。
1.3.4 电化学纸质免疫检测传感器的制备将聚苯乙烯磺酸钠(PSS)按1:6比例均匀分散于去离子水中,再将不同质量水溶性的羧基修饰的短臂碳纳米管分散于PSS-水溶液中,超声处理6 h使得碳纳米管在PSS-水溶液中充分分散。充分分散的PSS-水溶液冷却至室温,加入WMV-2外壳蛋白兔多克隆抗体,抗体终质量浓度为15 μg/mL,震荡均匀。将固定长宽度的滤纸(0.5 cm×6 cm)浸没到抗体-碳纳米管-PSS溶液中,浸泡10 min后取出,冷冻干燥。反复循环操作浸没-干燥过程一定次数,将干燥后的纸电极4℃密封保存,即制得植物病毒纸质免疫检测传感器[8]。
1.3.5 电化学纸质免疫检测传感器检测方法建立使用CHI 760B电化学工作站进行检测实验。实验初始电压为2 V、采样间隔0.001 s,以所制得的WMV-2纸质免疫检测传感器为工作电极,Pt电极为对电极,饱和甘汞电极为参比电极,pH7.4的0.1 mol/L PBS为缓冲溶液,在电化学工作站控制下,记录随着时间流经工作电极的电流,即i-t曲线;分别向缓冲溶液体系中加入不同体积WMV-2提纯病毒外壳蛋白溶液,得到不同终浓度病毒外壳蛋白缓冲溶液(0.5~160 nmol/L),分别记录每次检测的i-t曲线;以每次记录的i-t曲线的稳定电流值为纵坐标,以所记录的电流值所对应的WMV-2浓度为横坐标,建立电流-WMV-2浓度标准曲线[9]。
2 结果与分析
2.1 西瓜花叶病毒外壳蛋白提纯后表征
提纯病毒分别稀释两个不同的浓度,与病毒感染南瓜病叶研磨液上清同时比对表征,提纯后的病毒上清液与病叶研磨上清液相比显示出一条明显的蛋白条带,经生物电泳图像分析系统分析,其主要条带相对分子质量约为3.24×104(图1),与文献报道基本相符[10]。
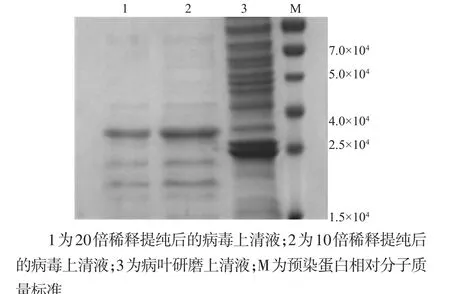
图1 不同稀释度提纯后的病毒上清液与病叶研磨上清液电泳表征图Fig.1Different dilution degrees of purified virus supernatant and disease leaves
2.2 TAS-ELISA方法
以西瓜花叶病毒外壳蛋白小鼠单克隆抗体与兔多克隆抗体分别作为包被抗体与捕获抗体,以HRP-羊抗兔抗体作为检测抗体,以提纯西瓜花叶病毒外壳蛋白作为检测标准品,建立的TAS-ELISA方法显示出对西瓜花叶病毒外壳蛋白的良好的检测结果。线性范围达到0.156~10 μg/mL,相关系数R2为0.996,其回归方程为y=0.16899x+0.19727,x为西瓜花叶病毒外壳蛋白浓度,y为450 nm吸光度值(图2)。

图2 TAS-ELISA方法检测西瓜花叶病毒2号外壳蛋白标准曲线Fig.2The standard curve for WMV-2 coat protein in TAS-ELISA.
应用建立的TAS-ELISA方法对不同稀释倍数病毒感染南瓜病叶研磨液上清进行检测,结果显示TAS-ELISA方法对不同稀释倍数的实际感染病叶研磨液上清均有良好的检出性,当病毒感染南瓜病叶研磨液上清稀释倍数达到640倍时仍为阳性,表明检测灵敏度可以达到1:640。应用建立的TASELISA方法分别检测不同稀释倍数的病毒感染南瓜病叶研磨液上清、健康南瓜叶片研磨液上清、建兰花叶病毒感染病叶研磨液上清与齿舌兰环斑病毒感染病叶研磨液上清,结果显示建立的TAS-ELISA方法只对西瓜果叶病毒感染的南瓜病叶研磨液上清有阳性检测结果,而对健康南瓜叶片研磨液上清、建兰花叶病毒感染病叶研磨液上清与齿舌兰环斑病毒感染病叶研磨液上清检测结果均显阴性,表明建立的TAS-ELISA方法对西瓜花叶病毒具有良好的特异性,而且对于实际样品具有良好的检测性。
2.3 电化学纸质免疫检测传感器
基于单壁碳纳米管对于滤纸具有良好的粘附力,将羧基修饰的单臂碳纳米管按一定浓度溶解分散在体积比1:6的PSS-去离子水溶液中,通过重复浸没-冷冻干燥过程,将纳米管层层包裹在固定长宽度(0.5 cm×6 cm)的滤纸表面,包裹层数即为重复浸没-冷冻干燥的次数。随包裹层数的增加,滤纸表面形态与颜色逐渐发生变化。
在碳纳米管内,电子沿碳纳米管轴向运动,表现出良好的导电性。使用CHI 760B电化学工作站为检测仪器,初始电压为2 V、采样时间间隔0.001 s,工作电极为纸质免疫检测传感器,对电极为Pt电极,参比电极为饱和甘汞电极,缓冲溶液使用pH7.4的0.1 mol/L的PBS溶液,在确定的检测条件下对不同包裹层数的纸质免疫检测传感器稳定电流值进行检测。可以明显看出在低包裹次数条件下纸质免疫检测传感器稳定电流值随包裹层数的上升而上升,当包裹层数达到一定次数之后,纸质免疫检测传感器的稳定电流值上升趋势减缓。综合考虑,选择纸质免疫传感器的包裹层数为12层,以取得较高的稳定电流值与较快的制备速度。
在相同的包裹层数条件下,使用不同碳纳米管终浓度的羧基修饰的单臂碳纳米管-PSS-去离子水溶液对固定长宽度(0.5 cm×6.0 cm)的滤纸进行包裹,滤纸表面吸附的单壁碳纳米管形态有着明显的差异,对纸质免疫传感器的导电性能有着显著的影响。在低浓度碳纳米管的包裹液条件下,纸质免疫检测传感器的稳定电流值较低;随着包裹液中碳纳米管浓度的上升,纸质免疫检测传感器的稳定电流值呈现上升趋势,直至达到一个稳定值;随着包裹液中碳纳米管浓度的进一步上升,纸质免疫检测传感器表面的碳纳米管会出现起皱,脱落现象。综合考虑,选择碳纳米管质量浓度为40 mg/mL的羧基修饰的单臂碳纳米管-PSS-去离子水溶液对纸质免疫检测传感器进行包裹。
2.4 电化学检测方法
配制碳纳米管终浓度为40 mg/mL的羧基修饰的单臂碳纳米管-PSS-去离子水溶液,室温下加入终浓度为15 μg/m的WMV-2病毒兔多抗,对固定长宽度(0.5 cm×6.0 cm)的滤纸反复进行浸没-冷冻干燥过程,共循环12次,制备得到电化学纸质免疫检测传感器。以添加不同浓度WMV-2提纯病毒外壳蛋白溶液(终浓度0.5~160 nmol/L)的pH7.4的0.1 mol/L的PBS缓冲溶液作为标准品,使用建立的电化学纸质免疫检测传感器检测方法分别检测其i-t曲线的稳定电流值。结果显示随着标准品溶液中WMV-2提纯病毒外壳蛋白溶液浓度的上升,电化学纸质免疫检测传感器检测方法检测到的i-t曲线的稳定电流值逐步下降。以每次检测的稳定电流值为纵坐标,以所记录的电流值所对应的WMV-2外壳蛋白浓度为横坐标,建立电流-WMV-2外壳蛋白浓度标准曲线,两者之间成线性关系。线性范围为0.25~20 μg/mL,相关系数R2为0.992 15,其回归方程为y=3.032 76-0.054 25x,x为西瓜花叶病毒2号外壳蛋白质浓度,y为i-t曲线稳定电流值(图5)。表明所建立的电化学纸质免疫检测传感器检测方法可以在一定的范围内定量的检测出样品中所含有的WMV-2病毒外壳蛋白质的浓度。

图3 电化学纸质免疫检测传感器检测法检测西瓜花叶病毒2号外壳蛋白Fig.3Paper supported immunosensor to detect the coat protein of watermelon Mosaic virus 2
3 结语
使用西瓜花叶病毒2号的高特异性、高灵敏度小鼠单克隆抗体和兔多克隆抗体,基于ELISA检测技术原理,建立针对西瓜花叶病毒2号外壳蛋白的高灵敏度TAS-ELISA检测方法。在基于电化学分析方法的基础上,将碳纳米管材料与其相结合,利用免疫学原理,使用西瓜花叶病毒2号的高特异性、高灵敏度兔多克隆抗体建立起针对西瓜花叶病毒2号的电化学纸质免疫检测传感器的快速检测方法。
所建立的两种针对西瓜花叶病毒外壳蛋白的检测方法对该病毒均具有很好的检出效果。两种方法相比较,所建立的TAS-ELISA方法具有更高的检测灵敏度与很好的特异性等优点;所建立的电化学纸质免疫检测传感器检测方法具有更快的检测速度、更便捷等优点。所建立两种检测方法对西瓜花叶病毒的检疫鉴定工作均具有良好的实际意义。
[1]任春梅,程兆榜,缪倩,等.江苏省葫芦科作物西瓜花叶病毒的分子鉴定和序列分析[J].南方农业学报,2013,44(9):1464-70.
REN Chunmei,CHENG Zhaobang,MIAO Qian,et al.Molecular identification and sequence analysis for watermelon mosaic virus in Jiangsu[J].Journal of southern agriculture,2013,44(9):1464-70.
[2]Candresse T,Lanneau M,Revers,F,et al.PCR-based techniques for the detection of plant viruses and viroids[J].International Symposium on Methods and Markers for Quality Assurance in Micropropagation 530,1999:61-67.
[3]Ling K S,Wechter W P,Walcott R R,et al.Development of a Real-time RT-PCR assay for squash mosaic virus useful for broad spectrum detection of various serotypes and its Incorporation into a multiplex seed health assay[J].Journal of Phytopathology,2011,159(10):649-56.
[4]李凤梅,崔崇士.南瓜病毒病的研究进展[J].东北农业大学学报,2002,33(1):100-104.
Li fengmei,Cui congshi.The research of pumpkin virus disease.[J].Journal of Northeast Agricultural University,2002,33(1): 100-104.
[5]Purcifull D,Hiebert E,Petersen M,et al.Partial characterization of a distinct potyvirus isolated from watermelon in Florida[J]. Plant disease,1998,82(12):1386-90.
[6]梁新苗,李桂芬,马洁,等.西瓜花叶病毒单克隆抗体及TAS-ELISA试剂盒的研制[J].植物检疫,2013,002:53-56.
Liang xin-miao,Li gui-fen,Ma jie,et al.Preparation of the monoclonal antibody against watermelon mosaic virus and TAS-ELISA kit[J].Plant quarantine,2013,002:53-56.
[7]张勋,匡华,徐丽广,等.绿色无毒黄曲霉毒素B1免疫检测方法[J].食品与生物技术学报,2013,32(12):1293-1297.
Zhang xun,Kuang hua,Xu liguang,et al.Green and nontoxic enzyme-linked immunosorbent assay for aflatoxin B1 detection[J]. Journal of food science and biotechnology,2013,32(12):1293-1297.
[8]Wu X,Kuang H,Hao C,et al.Paper supported immunosensor for detection of antibiotics[J].Biosensors and Bioelectronics,2012,33(1):309-12.
[9]许定花.基于免疫反应的高灵敏检测方法的建立[D].无锡:江南大学,2009.
[10]李向东,朱汉城.山东省侵染四瓜的西瓜花叶病毒(WMV-2)和黄瓜花叶病毒(CMV)的研究[J].山东农业大学学报:自然科学版,1995,26(3):299-306.
Li xiangdong,Zhu hancheng.The research of infection in shangdong province of watermelon mosaic virus(WMV-2)and cucumber mosaic virus(CMV)[J].Journal of Shangdong Agricalture University,1995,26(3):299-306.
TAS-ELISA and Electrochemical Paper Assisted Immunosensor for the Detection of Watermelon Mosaic Virus
KONG Dezhao1,ZHU Yicheng2,MA Wei1,XU Liguang1,XU Chuanlai*1
(1.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.School of Life Science and Chemical Engineering,Huaiyin Institute of Technology,Huaian 223003,China)
Using a mice monoclonal antibody and a rabbit polyclonal antibody of the watermelon mosaic virus(WMV)-2 coat protein,we developed two detection methods for WMV-2.The trimer antibody sandwich enzyme-linked immunosorbent assay(TAS-ELISA)method was established based on two different antibodies;the electrochemical paper assisted immunosensor detection method was established by combining the electrochemical workstation with the paper assisted immunosensor prepared by the carbon nanotube and the antibody-coated filter paper.The detection limit was 0.15 and 0.2 μg/ml,and the testing time was 3 hours and 30 minutes for two methods,respectively.According to these results,the TAS-ELISA method had a higher detection sensitivity,and the electrochemical paper assisted immunosensor detection method had a shorter testing time.
watermelon mosaic virus 2,coat protein,TAS-ELISA method,electrochemical paper assisted immunosensor
S432.41
A
1673—1689(2015)04—0367—05
2014-06-20
国家“十二五”科技支撑计划项目(2012BAC01B07)。
孔德昭(1990-),男,安徽宣城人,食品科学与工程博士研究生,主要从事食品安全检测研究。E-mail:kdz19900910@163.com
*通讯作者:胥传来(1965-),男,江苏盐城人,工学博士,教授,博士研究生导师,主要从事食品安全研究。E-mail:xcl@jiangnan.edu.cn
