乳兔单一左心房肌细胞原代培养及鉴定
2015-11-20郑甲林张新金陶四明代华磊韩明华李建美
郑甲林 郭 涛 张新金 陶四明 代华磊 韩明华 李建美
(昆明医科大学第四附属医院心内科,云南 昆明 650021)
Harary等〔1〕首次尝试Wistar乳鼠心肌细胞原代分离培养。然而,到目前为止研究心肌细胞培养方法更多集中在心室肌细胞培养或心室肌与心房肌细胞混合培养,且多选择乳鼠作为研究对象。关于单一心房肌细胞的培养研究相对较少,局限于左心房的心肌细胞培养实验未见报道。本文对以往心肌细胞培养方法学习总结,成功分离、纯化、培养并鉴定出了乳兔单一左心房肌细胞。
1 材料与方法
1.1动物、试剂、实验设备 日本大耳乳兔,出生48 h内,雌雄不限,由昆明医科大学动物实验室中心提供。胎牛血清(Hyclone公司),高糖型DMEM培养基(Gibco公司),磷酸盐缓冲液(PBS、自配),胰蛋白酶(Difco),Ⅱ型胶原酶(Invitrogen),5-溴脱氧尿嘧啶核苷(Sigma公司),聚乙二醇辛基苯基醚(TritonX-100、Amresco),组织固定液(多聚甲醛,Sigma),封闭专用脱脂奶粉(BSA、北京 Applygen公司),0.4%台盼蓝(Trypan Blue,Sigma公司),一抗为α-横纹肌肌动蛋白抗体小鼠抗兔(α-Sarcomeric actin Antibody,Santa Cruz公司),二抗为羊抗小鼠IgG-FITC荧光标记及羊抗小鼠IgG-Cy3荧光标记(武汉博士德生物有限公司);4',6-二脒基-2-苯基吲哚(DAPI,Sigma公司);青链霉素双抗(hyclone公司);其他试剂均为国产分析纯;细胞培养皿、培养瓶、培养板(美国BD Falcon);恒温二氧化碳培养箱(美国 New Brunswick Scientific Innova CO-170 CO2incubator);生物安全柜(美国Thermo Electron Corporation forma classⅡA2);倒置显微镜(日本Olympus IX51);离心机(中国京立LDZ5-2);恒温磁力搅拌器(韩国WiseStir MSH-20D);恒温振荡水浴箱(北京恒久科学仪器厂)。
1.2乳兔左心房肌细胞培养及纯化 借鉴Bénardeau等〔2〕心房肌细胞培养方法并加以改良。同时取10只出生48 h内的日本大耳乳兔,断颈处死,75%酒精全身消毒后,在生物安全柜内,消毒眼科剪剪开胸骨,迅速剪下心脏并置于磷酸盐缓冲液(PBS)中多次清洗、去血,用眼科剪在手术用放大镜下仔细剪下左心房(含房间隔),再次用PBS液多次清洗、去血致组织块变白,在PBS液中用眼科剪将左心房及房间隔剪成直径约1 mm3大小的组织块。用吸管将1 mm3的组织块转移至离心管中,加入0.1%胰酶,37℃水浴10 min,反复轻柔吹打,弃上清液。将组织块液全部转移至直径为6 cm的培养皿中,再加入预配0.1%胰酶、0.1%Ⅱ型胶原酶混合酶液5 ml,将组织块尽量吹分散,培养皿中放入预先消毒的磁力搅拌子,将培养皿放在磁力搅拌器上,剩余组织再加入0.1%胰酶、0.1%Ⅱ型胶原酶混合酶液5 ml,将培养皿放在磁力搅拌器上,参数设置同上,重复消化,并留取上清液,直至组织块完全消化。每次吸取的上清液加入容积为10 ml离心管中,再加入等体积的杜尔伯科改良伊格尔(DMEM)培养基(含10%胎牛血清,1%青链霉素双抗)终止消化。收集所有的组织消化液离心,800 r/min,5 min,用吸管小心吸取上清液弃之,沉淀的细胞加入适量DMEM培养基,用吸管反复轻柔吹打,制成细胞悬液。在细胞悬液中加入1滴无菌的1 mg/ml溶于水的DNA酶,防止消化的细胞粘连成团块。用200目消毒不锈钢网过滤细胞悬液,将细胞悬液接种于直径为6 cm的培养皿中,培养皿置入恒温二氧化碳培养箱(5%CO2、37℃)中培养60 min后,平稳取出培养皿,用吸管小心吸取培养皿中的细胞悬液转移至另一培养皿中,用2次差速贴壁法去除成纤维细胞。调整细胞悬液为1×105个/ml,再将细胞悬液转移至培养瓶中(培养瓶面积25 cm2)。最初的2 d在培养瓶中加入5-溴脱氧尿嘧啶核苷(5-BrdU)抑制非心肌细胞(成纤维细胞)生长,每1 ml培养基中加入10 mmol/L的5-BrdU 10 μl即得到5-BrdU终浓度0.1 mmol/L。置入恒温二氧化碳培养箱中培养,以后每2天换培养基一次。
细胞传代方法:单层细胞贴壁铺满培养瓶底的80% ~90%时进行传代。用吸管小心吸取原代细胞瓶内的培养液弃之,加入PBS反复轻柔清洗细胞,弃PBS后加0.1%胰酶2 ml,镜下观察。当细胞由片状收缩呈球形时,迅速加入DMEM培养基终止消化。用吸管反复吹打瓶壁,使细胞与瓶壁分离脱落,以1∶2分装接种。细胞接近长满瓶底后(约4~6 d)可再传代,取第3代细胞进行鉴定与实验。
细胞爬片制备:将第2代铺满培养瓶底的细胞同上步骤,制成细胞悬液滴加在放置有盖玻片的6孔培养板中,每孔加样3 ml,置入恒温二氧化碳培养箱(5%CO2、37℃)中培养,以后每2天换培养基一次。
1.3心房肌细胞生长、形态观察 每次消化后取0.5 ml细胞悬液于直径3.5 cm的培养皿中,在倒置显微镜(200倍)下观察心房肌细胞贴壁情况、生长状况、形态学变化、细胞搏动时间及频率,并照相。并从培养24 h至第7天,镜下计数细胞搏动频率(次/min)。
1.4酶消化后细胞存活率计算 经酶消化后,细胞接种前计数存活率。取吹打均匀的细胞悬液2 ml,与0.4%台盼蓝液5 ml、PBS液3 ml混合吹打均匀制成细胞悬液,于室温下静置5 min,使其充分染色,吸取少量混合细胞悬液于倒置显微镜下观察,鉴定消化后的细胞存活率。正常细胞不被染色,显微镜下为透明、折光性强的圆形细胞,死亡细胞被染成蓝色。在显微镜(200倍)下计数4个大格中的细胞总数及着色细胞数,每次计数3次,求平均值,重复3次。细胞成活率(%)=〔(总细胞数-着色细胞数)/总细胞数×100%〕。
1.5绘制细胞生长曲线 采用计数法绘制细胞生长曲线(计数方法同上)。选择生长良好且接近融合的第2代细胞,经胰酶消化,用上述相同方法在新的培养基上制成细胞悬液。接种于24孔培养板内,每孔5×104个/ml做传代培养,共接种21孔细胞。置入恒温二氧化碳培养箱(5%CO2、37℃)中培养。24 h后开始计算细胞个数,之后每隔24 h计数一次,连续计数7 d,每次取3孔细胞分别计数,计算平均值。分别以时间(d)、单位细胞数(细胞个数/ml)为横、纵坐标绘制细胞生长曲线,并计算细胞群体的倍增时间(Td),Td=t×lg2/1gNt-lgNo,其中 t代表计数间隔时间或称培养时间,No代表接种后的细胞数,Nt代表对数生长期任一点的理论观察值(即培养t h后的细胞数)。
1.6心房肌细胞免疫荧光及纯度鉴定 采用间接免疫荧光鉴定法。培养48 h后取出细胞爬片,PBS洗涤3次,5 min/次;用4%的多聚甲醛,室温下固定30 min,PBS洗涤3次,5 min/次;细胞爬片上加0.5%TritonX-100对细胞进行打孔5 min,吸去打孔通透液,PBS洗涤3次,5 min/次;0.1%BSA室温封闭30 min,加一抗小鼠抗兔α-横纹肌肌动蛋白抗体(1∶50稀释)4℃ 过夜;PBS洗涤3次,5 min/次;加二抗为羊抗小鼠 IgGFITC荧光标记及羊抗小鼠IgG-Cy3荧光标记(1∶100稀释),室温90 min,PBS洗涤3次,5 min/次。加入抗荧光淬灭液封片。DAPI染色细胞核。荧光显微镜下观察并照相,设立对照组(不加一抗,只加二抗)。于显微镜下(200倍)任选10个视野,计数阴性细胞数及细胞总数,计数3次,求平均值,阳性细胞率=细胞总数-阴性细胞数/细胞总数×100%。
2结果
2.1心房肌细胞镜下观察 每次消化后取0.5 ml细胞悬液于直径3.5 cm的培养皿中,于倒置显微镜下观察,可见心房肌细胞呈圆形或椭圆形。首次消化细胞量少,第2、3次消化细胞量较多,经3次后多可完全消化组织。收集所有的组织消化液经两次差速贴壁后将细胞悬液接种于直径为6 cm的培养皿中,倒置显微镜下可见单个细胞散在悬浮于培养基中,大多数细胞呈圆形或椭圆形;2~3 h后可见少量细胞贴壁,仍以圆形与椭圆形为主,可见少量细胞呈多边形;接种16~24 h后细胞完全贴壁,细胞为长梭形、三角形、多边形或不规则形,可见单个搏动细胞,频率较慢;培养48 h部分细胞融合在一起;培养72 h细胞为多边形、不规则形,大部分细胞间相互连接,搏动趋于同步;培养4 d后细胞达瓶底70%,相互连接在一起成簇,搏动基本同步,搏动频率加快,50~101次/min;培养7 d后细胞达瓶底80%~90%或以上,伪足相互交织成网,融合呈同心圆放射状排列,呈现同步搏动,心房肌细胞有一定收缩力。见图1。
2.2肌细胞存活率 经台盼蓝染色,细胞计数板计数,测得细胞存活率平均为85.2%。其中实验1次细胞存活率为81.3%,实验2次为87.8%,3次为86.6%。
2.3心房肌细胞生长曲线 第3代心房肌细胞1~4×106/ml呈对数生长,倍增时间约24 h(见图2)。

图1 镜下观察心房肌细胞(×200)
2.4心房肌细胞纯度鉴定 用特异性小鼠抗兔α-横纹肌肌动蛋白抗体(一抗)、羊抗小鼠IgG-FITC荧光标记及羊抗小鼠IgG-Cy3荧光标记(二抗)心房肌细胞染色,阳性细胞质为绿色及红色荧光,DAPI衬染细胞核为蓝色荧光,进一步证实培养的细胞为心房肌细胞,阳性率达95%。见图3。
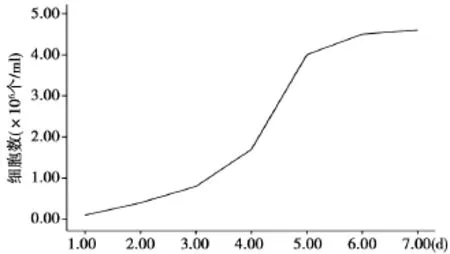
图2 第3代心房肌细胞生长曲线
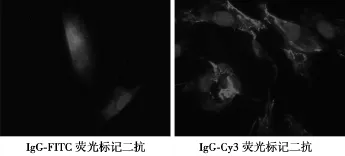
图3 心房肌细胞纯度鉴定(×400)
3讨论
目前原代心肌细胞培养的方法主要有酶消化法和组织块培养法。组织块培养法是将组织剪切成小块后接种于细胞培养板、培养皿进行细胞分离培养,此方法操作简单,但获得的细胞数量少。酶消化培养法是将取下的组织剪碎后,在单独胰酶或者胶原酶,或胰酶加胶原酶〔3,4〕的作用下去除细胞外基质使细胞游离。胰酶可分解细胞外基质中的蛋白质,同时对细胞膜有较强的破坏,组织细胞破坏作用很强,经胰酶消化后的组织会释放大量的胶原蛋白,大量胶原蛋白易形成絮状物,使消化后细胞和上清液很难分离开,影响心肌细胞分离;胶原酶可分解细胞外基质中胶原纤维,作用相对弱。此方法分离的细胞易于从培养基中获取营养,可以快速获得大量的细胞,培养细胞的效率高,较常用。
心脏细胞主要由心肌细胞和成纤维细胞组成,研究报道心肌细胞数占心脏细胞总数不一(30% ~60%)。培养出单一的心房肌细胞为进一步研究心房肌细胞基因转录、离子通道、蛋白表达改变,药物干预及相关电生理变化提供平台〔5〕,以及可进一步利用转基因、膜片钳等先进技术研究心脏疾病〔6,7〕。心房颤动(房颤)是一种最常见的发病机制复杂的心律失常疾病,房颤的发生与左心房病变联系非常紧密,分离培养单一左心房肌细胞尤为重要。心房肌较心室肌薄,心房肌占整个心脏的比重很小,乳鼠、乳兔心脏体积很小,而心房体积则约1~2 mm3,取材很困难,再加上消化过程中酶损伤、机械损伤、非心房肌细胞干扰等因素,大大减少可获得的细胞数量,给心房肌细胞培养带来了困难。
哺乳动物心肌细胞在出生后的1 w具有部分分裂增殖能力,刚出生的心肌细胞增殖能力相对较强,本研究选用了出生48 h内的乳兔为实验对象。胰酶及胶原酶用于原代细胞培养消化组织块,浓度采用0.05% ~0.5%不等。消化时间偏长,胰酶对心肌细胞过度破坏,消化时间过短,胶原酶对细胞外胶原纤维降解不充分,不利于心肌细胞的游离;既保证将心肌细胞外基质分解破坏,又尽可能减少酶对心肌细胞的破坏。一般采用37℃水浴提高胰酶消化效率,也有为了防止胰酶对心肌细胞的过度破坏采用4℃过夜消化法〔8〕。本研究用较低浓度的胰酶和胶原酶混合酶(混合后浓度均为0.1%)消化心房肌组织。对同一次取材组织进行多次消化的方法,并对每一次提取的组织消化液及时终止消化,防止胰酶对心房肌细胞的过度破坏。被胰酶破坏的心房肌细胞释放DNA,易引起细胞粘连成团块,在组织消化液中加入少量无菌的1 mg/ml的DNA酶预防。吸管对组织块吹打时尽量轻柔,以800 r/min对组织消化液离心,尽量减少对心房肌细胞的机械损伤。本研究发现经酶消化后细胞存活率为85.2%,可以进一步纯化心房肌细胞。
本研究结果证实培养的心房肌细胞能较长时间内保持较高的活力。接种密度控制在1×105~5×105个/ml,接种密度过低造成细胞间的信号传递困难,不利于细胞生长及信号传递,接种过密细胞生长过早接触抑制,营养不良,细胞生长及活力受限。
1 Harary I,Farley B.In vitro studies of single isolated beating heart cells〔J〕.Science,1960;131(3414):1674-5.
2 Bénardeau A,Hatem SN,Rücker-Martin C,et al.Primary culture of human atrial myocytes is associated with the appearance of structural and functional characteristics of immature myocardium〔J〕.J Mol Cell Cardiol,1997;29(5):1307-20.
3 Sreejit P,Kumar S,Verma RS.An improved protocol for primary culture of cardiomyocyte from neonatal mice〔J〕.In Vitro Cell Dev Biol Anim,2008;44(3-4):45-50.
4 Golden HB,Gollapudi D,Gerilechaogetu F,et al.Isolation of cardiac myocytes and fibroblasts from neonatal rat pups〔J〕.Methods Mol Biol,2012;843:205-14.
5 Cerbai E,Sartiani L,De Paoli P,et al.Isolated cardiac cells for electropharmacological studies〔J〕.Pharmacol Res,2000;42(1):1-8.
6 Brand NJ,Lara-Pezzi E,Rosenthal N,et al.Analysis of cardiac myocyte biology in transgenic mice:a protocol for preparation of neonatal mouse cardiac myocyte cultures〔J〕.Methods Mol Biol,2010;633:113-24.
7 Louch WE,Sheehan KA,Wolska BM.Methods in cardiomyocyte isolation,culture,and gene transfer〔J〕.J Mol Cell Cardiol,2011;51(3):288-98.
8 陶 静,马依彤,李晓梅,等.原代乳鼠心肌细胞培养方法的改进〔J〕.中华心血管病杂志,2014;42(1):53-6.
