2,4,6-三硝基苯磺酸/乙醇法诱导建立溃疡性结肠炎大鼠模型
2015-11-20贺海辉朱宣宣顾培青刘亚军
贺海辉 沈 洪 朱宣宣 顾培青 刘亚军 朱 磊 郑 凯
(湖南省直中医医院,湖南 株洲 412000)
溃疡性结肠炎(UC)发病多与遗传、环境及免疫反应异常有关,病因和发病机制至今尚未被完全阐明;其病程迁延,易反复发作,严重影响生活质量,且有癌变倾向。但目前仍未得到与人类UC病因、发病机制、病理改变、临床表现及病程发展完全相似的理想模型。本文采用2,4,6-三硝基苯磺酸 (TNBS)/乙醇法给予大鼠灌肠,以建立较为接近的UC研究模型。
1 材料和方法
1.1材料 健康成年雄性SD大鼠20只,体重(202±5)g,由江苏省中医院药理实验室实验动物中心提供。5%TNBS:美国Sigma公司生产,批号080M5000,购于上海Sigma-Aldrich生物技术有限公司;10%水合氯醛:国药集团化学试剂有限公司生产,批号20090922;无水乙醇:南京宁试化学试剂有限公司,批号20100118;大鼠肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β、IL-10酶联免疫检测试剂盒:美国R&D公司产品,由上海朗顿生物科技有限公司进口分装。电子秤(型号MODEL DS-671):上海寺冈电子有限公司产品;电子分析天平(型号FA1004):上海精密科学仪器有限公司产品;酶标仪(型号SUNRISE):瑞士TECAN公司产品;恒温箱(型号HPX-9052MBE):上海博迅实业有限公司医疗设备厂产品;低温冷冻离心机(型号Labofuge 400R):Thermo electron公司产品。
1.2方法
1.2.1大鼠分组及造模方法 20只大鼠随机分成正常组、模型组,每组10只。模型组大鼠禁食不禁水24 h,10%水合氯醛(0.3 ml/kg)腹腔注射麻醉后,用大鼠灌胃针管由肛门轻缓插入约8 cm,缓慢推入造模液(100 mg/kg TNBS+50%乙醇0.25 ml),保持倒立30 s后,仰卧归笼。正常组给予相应体积的生理盐水灌肠。
1.2.2取材 10 d后,所有大鼠禁食24 h,脱颈椎处死,迅速取出结肠,沿肠系膜缘剪开肠腔,用等渗生理盐水漂洗肠组织,将其平铺于冰盘上,肉眼观察结肠大体形态。取结肠病变最严重处,置4%甲醛中固定后,石蜡包埋,切片,苏木素-伊红(HE)染色,光镜下观察组织病理学情况。
1.2.3一般情况观察 每天观察大鼠体重、大便(大便性状、血便等)、进食量、精神状态、皮毛变化、活动情况等。根据给药结束后大鼠体重变化(较实验开始时体重变化百分比)、大便性状和血便情况,参照Cooper等〔1〕方法进行疾病活动指数(DAI)评分并稍作修改。体重下降:无,0分;1% ~5%,1分;5% ~10%,2分;10% ~15%,3分;>15%,4分。大便性状:正常大便,0分;稀糊便,2分;水样便,4分。血便:无肉眼血便,0分;肉眼血便,4分。
1.2.4结肠大体形态损伤观察 观察结肠充血、溃疡、肠壁增厚情况,参照文献〔2〕进行结肠大体形态损伤评分。无损伤,0分;充血但无溃疡,1分;充血且肠壁变厚,但无溃疡,2分;有1处溃疡但无肠壁增厚,3分;有2处或2处以上溃疡或炎症,4分;有2处或2处以上大溃疡和炎症或有1处溃疡和炎症沿结肠纵轴超过1 cm,5分;沿结肠纵轴损伤超过2 cm以上,每超过1 cm增加1分,6~10分。
1.2.5结肠组织病理学检查 光镜下观察结肠组织病理学改变,参照文献〔3〕进行结肠组织病理学评分。上皮细胞:正常形态,0分;有杯状细胞丢失,1分;杯状细胞大面积丢失,2分;隐窝细胞丢失,3分;隐窝细胞大面积丢失,4分。炎症细胞浸润:没有浸润,0分;浸润在隐窝基底层,1分;浸润到达黏膜肌层,2分;浸润深入到黏膜肌层,伴随黏膜增厚和明显水肿,3分;浸润到达黏膜下层,4分。
1.3统计学处理 应用SPSS10.0软件行t检验或Wilcoxon秩和检验。
2结果
2.1一般情况 正常组大鼠反应灵敏,毛发有光泽,饮食正常,无腹泻及便血。经TNBS灌肠苏醒后的大鼠,精神萎靡,少动,毛发杂乱无光泽,饮食量减少,出现不同程度的腹泻及便血。处死前模型组大鼠体重〔(200.00±13.09)g〕显著低于正常组〔(280.00±7.45)g〕(P<0.01)。模型组大鼠 DAI评分〔(2.38±1.51)分〕明显高于正常组(0分)(P<0.01)。
2.2结肠大体形态损伤评分 正常组大鼠结肠大体形态正常,肠道无缩短,黏膜表面光滑、光泽,未见充血水肿、糜烂溃疡,肠壁无增厚。模型组大鼠可见结肠肠道缩短,无粘连,肠管积气积粪,肠黏膜表面有颗粒感、质脆,呈连续性充血水肿并可见糜烂溃疡灶,部分大片剥脱,肠壁增厚。模型组大鼠结肠大体形态评分〔(2.94±0.94)分〕显著高于正常组(0分)(P<0.01)。
2.3结肠组织病理学评分 正常组大鼠镜下观察组织形态正常,结肠壁各层结构清晰,未见水肿、糜烂及溃疡形成,间质少量淋巴细胞浸润。模型组大鼠结肠组织可见黏膜层、黏膜下层广泛溃疡形成,大量中性粒细胞、淋巴细胞等炎性细胞浸润,腺体破坏,结构紊乱,杯状细胞减少,隐窝结构扭曲,隐窝炎症及脓肿形成。模型组大鼠结肠组织病理学评分〔(6.00±1.67)分〕显著高于正常组(0分)(P<0.01)。见图1。
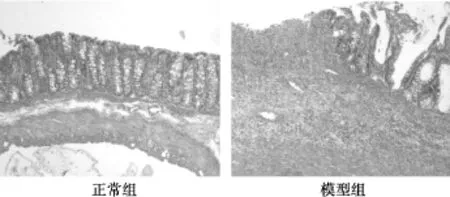
图1 各组大鼠结肠组织病理图片(HE,×100)
3讨论
TNBS与乙醇诱发大鼠结肠炎的主要机制为乙醇破坏结肠黏膜屏障,TNBS渗入结肠作为半抗原与大分子物质结合,形成全抗原引起肠壁一系列免疫应答与炎症反应,其发病机制与人类 UC 相似〔4〕。Yoshimitsu等〔5〕报道,TNBS诱导的 SD 大鼠结肠组织干扰素(IFN)-γ升高,属于 Th1型炎症模型。Strober等〔6〕认为,Th1型炎症反应以透壁性炎症、偶伴肉芽肿形成为主,符合人类CD病理学特征。张涛等〔7〕观察体重(200±20)g的清洁级雄性SD大鼠,给予100 mg/kg TNBS/乙醇灌肠后,可以诱导大鼠结肠炎症伴溃疡形成,且溃疡主要在黏膜层,类似于人的UC病理特点。
与其他造模方法相比,采用TNBS/乙醇法建立UC模型有如下优势:①操作简单,不需预先致敏动物或进行外科手术,而且重现率高;②该模型的持续时间较长,体现急性炎症及溃疡向慢性转化的动态过程,这一较长的病变过程对于评价药物疗效及研究急性炎症向慢性转化的病理变化颇为有用;③该模型组织学变化与人类UC相似,可见肥大细胞和淋巴细胞浸润及隐窝炎和隐窝变形;④TNBS价格相对不高,实验花费不大〔8〕。
对于UC与Th细胞亚型的关系,研究者们有不同的意见。很多人认为UC与Th2细胞密切相关〔9〕。但是有研究〔6〕认为,在人类UC虽然IL-5分泌明显增加,IL-4却未见明显增加。而近来另有研究〔10〕显示,UC是Th1和Th2共同作用的结果,在早期可能 Th1反应增强,而晚期以 Th2反应占优势。Sawa等〔11〕通过检测UC患者肠道各种细胞因子mRNA的扩增,发现IL-1β、IL-4、IL-5、IL-8、IL-10、IL-12p40、IFN-γ 和 TNF-α 等的表达都明显比正常组高。Melgar等〔12〕认为UC中T细胞分化成Th2、Th17及调节性T细胞。可见UC与Th细胞亚型的关系尚不明确,根据TNBS诱导的SD大鼠结肠炎属于Th1型炎症模型〔5〕,推断出此模型更适于CD的研究不可靠。
综上所述,虽然动物试验并非是人体疾病的最好研究模型,但在目前未得到与人类UC病因、发病机制、病理改变、临床表现及病程发展完全相似的理想模型的情况下,采用TNBS/乙醇法建立UC模型为较接近的研究模型。
1 Cooper HS,Murthy SN,Shah RS,et al.Clinicopathologic study of dextran sulfate sodium experimental murine colitis〔J〕.Lab Invest,1993;69(2):238-49.
2 Luk HH,Ko JK,Fung HS,et al.Delineation of the protective action of zinc sulfate on ulcerative colitis in rats〔J〕.Eur J Pharmacol,2002;443(1-3):197-204.
3 Obermeier F,Dunger N,Strauch UG,et al,et al.Contrasting activity of cytosin-guanosin dinucleotide oligonucleotides in mice with experimental colitis〔J〕.Clin Exp Immunol,2003;134(2):217-24.
4 Morris GP,Beck PL,Herridge MS,et al.Hapten-induced model of chronic inflammation and ulceration in the rat colon〔J〕.Gastroenterology,1989;96(3):795-803.
5 Yoshimitsu M,Hayamizu K,Egi H,et al.The neutrophil/Th1 lymphocyte balance and the therapeutic effect of granulocyte colony-stimulating factor in TNBS-induced colitis of rat strains〔J〕.J Interferon Cytokine Res,2006;26(5):291-300.
6 Strober W,Fuss IJ,Blumberg RS.The immunology of mucosal models of inflammation〔J〕.Annu Rev Immunol,2002;20(5):495-549.
7 张 涛,谢建群.大鼠溃疡性结肠炎模型的实验研究〔J〕.中国中西医结合消化杂志,2006;14(4):240-2.
8 王 皓,欧阳钦,胡仁伟.三硝基苯磺酸结肠炎动物模型的建立〔J〕.胃肠病学,2001;6(1):7-10.
9 Lakatos L.Immunology of inflammatory bowel diseases〔J〕.Acta Physiol Hung,2000;87(4):355-72.
10 庞艳华,郑长青.Th1/Th2细胞亚群与炎症性肠病的关系〔J〕.世界华人消化杂志,2004;12(8):1922-4.
11 Sawa Y,Oshitani N,Adachi K,et al.Comprehensive analysis of intestinal cytokine messenger RNA profile by real-time quantitative polymerase chain reaction in patients with inflammatory bowel disease〔J〕.Int J Mof Med,2003;11(2):175-9.
12 Melgar S,Shanahan F.Inflammatory bowel disease-from mechanisms to treatment strategies〔J〕.Autoimmunity,2010;43(7):463-77.
