激活素A对大鼠肌细胞增殖分化的作用
2017-04-05赵为民涂枫任守文方晓敏李
赵为民++涂枫++任守文++方晓敏++李碧侠++赵芳++付言峰++王学敏

摘要:激活素A(Activin A)是转化生长因子β(transforming/mL growth factor-β,TGF-β)超家族中的一员,具有重要的生物学功能。为研究Activin A在肌肉发育中的作用,以大鼠肌细胞L6为研究模型,通过时空表达谱、CCK-8以及流式细胞周期分析等方法来进行研究。结果表明Activin A随着肌细胞由增殖转向分化状态,其表达量呈下降趋势。添加不同浓度的Activin A(5~25 ng/mL)均能显著促进L6细胞的增殖速度,且这种促进细胞增殖的效应随着Activin A浓度的增大而逐渐增强。Activin A能显著增加S期在细胞周期中的比例,同时缩短G1和G2期在细胞周期中所占的比例。此外,通过添加Activin A显著抑制了肌肉分化标记基因Myog的表达。以上结果为进一步研究 Activin A在肌肉发育中的作用机制奠定了基础。
关键词:大鼠;激活素A(Activin A);肌细胞;增殖;细胞周期
中图分类号: S828.2文献标志码: A
文章编号:1002-1302(2016)12-0287-03
收稿日期:2016-09-12
基金項目:国家转基因生物新品种培育重大专项(编号:2014ZX08006-003);国家生猪现代产业技术体系建设专项(编号:CARS-36)。
作者简介:赵为民(1983—),男,湖北钟祥人,博士,助理研究员,主要从事转基因与育种研究。Tel:(025)84391941;E-mail:zhao_weimin1983@aliyun.com。
通信作者:王学敏,硕士,助理研究员,主要从事转基因与猪生产研究。Tel:(025)84391941;E-mail:wxm116@sina.com。
Activin A最初是从猪的卵泡液中分离的一种糖蛋白,通过二硫键连接2个β A亚基构成二聚体形式[1]。Activin A作为TGF-β 超家族的一员,通过与其受体ActRⅡ/ⅡB结合,激活下游的Smad2/ Smad3通路,从而发挥重要的生物学功能。Activin A最初的功能是刺激卵泡刺激素(follicle-stimulating/mL hormone,FSH)的分泌,促进卵泡发育[1],后来发现Activin A在其他的生理过程中也发挥着重要作用。研究表明Activin A在炎症反应中发挥着关键作用[2],例如它在由脂多糖(lipopolysaccharides,LPS)介导的炎症反应中能调节关键炎症因子的表达[3],此外在呼吸道过表达Activin A可诱导严重的肺部炎症反应[4]。Activin A还能促进包括睾丸支持细胞、卵巢颗粒细胞以及肝星状细胞等多种细胞的增殖[5-7]。近年来报道显示Activin A在肌肉的生长发育中也起到重要作用。Activin A在IL-1α和TNF-α炎症因子处理后的肌细胞分化中起到抑制作用[8]。过量的Activin A可导致肌肉的萎缩和恶病质,且这种效应比MSTN还要强[9]。MSTN是肌肉发育的一个负调控因子,通过基因编辑技术敲除MSTN可使生物个体如猪表现出典型的双肌性状[10-11],这说明 Activin A可作为一个新的肌肉靶标基因,通过对其敲除可为适度提高我国地方猪品种的瘦肉率提供一种新途径。然而 Activin A在肌肉发育中的作用机制仍不清楚,这阻碍了对其进行有效挖掘和利用。本研究利用大鼠肌细胞L6为模型,探讨Activin A在肌细胞增殖分化中的作用,这将有助于更好地揭示Activin A基因在肌肉发育中的调控机制,同时也为进一步在猪上进行基因编辑Activin A的研究提供了理论基础。
1材料和方法
1.1材料
Trans1-T1菌株购于北京全式金生物技术有限公司;大鼠L6肌细胞购于中国医学科学院基础医学细胞中心;Activin A重组蛋白购于R&D Systems;RNA提取试剂盒购于北京百泰克生物技术有限公司;CCK-8购于日本同仁;SYBR Premix Ex TaqTM Ⅱ (Tli RNaseH Plus)、Taq酶、PrimeScriptTM RT Master Mix反转录试剂盒购于 TaKaRa公司;Activin A ELISA试剂盒购于武汉博士德生物;DEME、胎牛血清、双抗购于Thermo Fisher公司;引物合成、基因测序由南京金斯瑞生物科技有限公司完成。
1.2RNA的提取及cDNA的合成
RNA提取主要步骤:细胞加入Trizol裂解液室温裂解 5 min,然后加入200 μL氯仿混匀15 s,静置3 min,4 ℃下 12 000 r/min 离心10 min,取上清约400 μL,转移到新的 1.5 mL EP管中,加入等体积的70%乙醇,颠倒混匀,10 000 r/min 过柱离心45 s,弃掉废液。加 500 μL去蛋白液 RE,12 000 r/min 离心 45 s,弃掉废液。加入 700 μL 漂洗液 RW 12 000 r/min离心 60 s,弃掉废液。加入 500 μL 漂洗液 RW,12 000 r/min 离心 60 s,弃掉废液。将吸附柱 RA 放回空收集管中,12 000 r/min 离心 2 min,在吸附膜的中间部位加适量 RNase free 水,室温放置 2 min,12 000 r/min 离心 1 min,-80 ℃冰箱中保存备用。
cDNA的合成主要步骤为:500 ng/mL RNA,2 μL 5×primescript RT Master Mix,补水至10 μL。37 ℃ 反应15 min,85 ℃ 处理1 min,-20 ℃冰箱中保存备用。
1.3荧光定量PCR
荧光定量PCR按照SYBR Premix Ex TaqTM Ⅱ说明书操作,体系如下:cDNA 2 μL,2 ×SYBR Premix Ex TaqTM Ⅱ 10 μL,Rox reference DyeⅡ(50×)0.4 μL,正向引物0.5 μL,反向引物0.5 μL,补水到20 μL。反应程序为95 ℃ 2 min;95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。
1.4L6肌细胞培养及分化
L6细胞培养于含10%胎牛血清的培养基(90%DEME+10%胎牛血清+1%双抗)中,然后置于37 ℃ 5% CO2培养箱中培养,待其密度达到80%时,按照1 ∶[KG-*3]3传代。待分化时,换成含2%马血清的DMEM进行分化,每2 d换1次培养液。
1.5Activin A ELISA测定
参照试剂盒说明,主要步骤:加样品和标准品,37 ℃反应 90 min。[JP3]不洗。加生物素标记抗体,37 ℃反应 60 min,1×洗涤缓冲液洗涤 3 次。加 ABC,37 ℃反应 30 min,1×洗涤缓冲液洗涤 5 次。TMB 37 ℃反应 20~25 min,加入 TMB 终止液,读数。
1.6细胞增殖分析
在96孔板中接种L6细胞,然后将96孔板放在培养箱培养(37 ℃,5% CO2)12 h后,每组加入终浓度为5、10、25 ng/mL 的Activin A,每个处理组重复4次,分别培养24、48、72 h。然后向每孔加入10 μL CCK-8,在培养箱内孵育 1~4 h,用酶标仪测定在450 nm处的吸光度。
1.7细胞周期分析
细胞用胰酶消化后,以1 000 r/min离心5 min,弃培养基,用4 ℃预冷的PBS洗细胞2次,离心去PBS,加入 4 ℃预冷的70%乙醇-20 ℃固定过夜,次日离心弃去固定液,用 4 ℃预冷PBS 5 mL 洗细胞2次,加入0.5 mL PBS[含 50 μg /mL 碘化乙锭(PI),100 μg /mL RNase A]重悬细胞,37 ℃避光孵育30 min,采用流式细胞仪检测细胞周期变化。
1.8数据处理
运用Excel 软件进行数据处理与分析,统计方法采用t检验(α=0.05)。
2结果与分析
2.1Activin A在肌细胞增殖分化中的表达
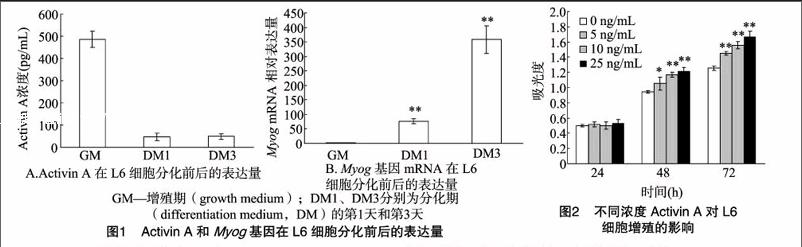
如图1-A所示,随着L6细胞由增殖期(growth medium,GM)转向分化期(differentiation medium,DM)的第1天(DM1)和第3天(DM3),Activin A蛋白在L6细胞增殖期的表达量要极显著高于其在L6细胞分化期的表达量(P<001)。Myog作为一个肌肉分化标记基因用来指示肌细胞的分化状态,从图1-B可以看出,随着L6细胞的分化,Myog表达量从GM到DM1及DM3也极显著上升(P<0.01),说明L6细胞分化成功。
2.2Activin A 对肌细胞增值的作用
由图2可见,当添加不同浓度的Activin A 培养24 h后,L6细胞的增殖速度在各浓度之间并无显著差异。当继续培养至48 h和72 h后,Activin A的效应逐渐显现出来。在48 h中,添加5 ng/mL的细胞增殖速度要显著高于对照组(P<005),而添加10 ng/mL和25 ng/mL的细胞增殖速度要极显著高于对照组(P<0.01),Activin A对细胞增殖的效应随着浓度的增大而逐渐增强。Activin A对L6细胞在72 h的增殖情况与48 h的增殖情况类似,但都达到差异极显著(P<001)。进一步分析发现在72 h时,不同浓度的Activin A对细胞增殖的幅度都要高于其在48 h时对细胞增殖的幅度。
2.3Activin A 对肌细胞周期的作用
为了探讨Activin A是否通过影响细胞周期来影响细胞增殖,添加Activin A培养48 h后,通过流式细胞周期分析发现Activin A能影响L6细胞各个周期的比例大小(图3-A)。与对照组相比,Activin A能极显著提高S期在细胞周期中的比例(P<0.01),同时极显著降低G1和G2期在细胞周期中的比例(P<0.01)(图3-B)。
2.4Activin A 对肌细胞分化的影响
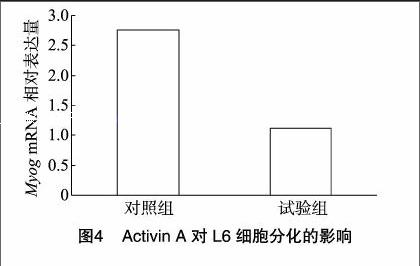
由图4可见,在L6细胞分化液中添加Activin A培养 48 h 后,通过定量PCR结果发现与对照组相比,Activin A极显著抑制了肌肉分化标记基因Myog的表达(P<0.01)。
3讨论
骨骼肌发育是一个极其复杂的生物学过程,在一系列转录因子例如PAX3/PAX7、生肌调节因子(myogenic regulatory factors,MRFs)以及其他基因的相互作用下,由生肌前体细胞分化为成肌细胞,后者再经过增殖、分化、融合形成多核肌管,最终发育形成肌纤维和肌肉组织[12-13],因而肌细胞如何增殖和分化成为研究肌肉发育机制的重点。
研究表明基因的表达水平往往与其细胞所处的状态紧密相关[14-15]。当肌细胞L6由增殖状态转向分化状态时,可以看到Activin A的表達量显著下降,说明其可能与L6细胞的增殖密切相关。进一步的试验表明当外源添加Activin A后,细胞增殖的速度明显高于对照组,说明其确实促进了细胞增殖,且这种促进效应显现出浓度依赖性,这与Activin A对其他细胞的增殖效应[7]相似。细胞周期分为G1、S、G2/M等3个时期,G1是细胞的合成前期,而S期是细胞DNA的复制期[CM(25],当细胞不可逆地退出细胞周期后开始分化[16],因而调节这2个时期的比例大小可影响细胞的增殖与分化。研究表明一些miRNA基因可通过促进G1期的停滞来促进肌细胞的分化[17-18],相反一些miRNA可通过促进细胞增殖以及提高细胞周期中S期比例来抑制肌细胞的分化[19]。本研究表明 Activin A可降低L6细胞周期中G1和G2期的比例而增加S期的比例,同时结合添加Activin A可抑制肌肉分化标记基因Myog的表达,说明Activin A很可能是通过上述机制来抑制肌细胞的分化,其具体机制仍需进一步研究。
[HS2][HT8.5H]參考文献:[HT8.SS]
[1]Rivier J,Spiess J,McClintock R,et al. Purification and partial characterization of inhibin from porcine follicular fluid[J]. Nature,1985,133(1):120-127.
[2]de Kretser D M,OHehir R E,Hardy C L,et al. The roles of activin A and its binding protein,follistatin,in inflammation and tissue repair[J]. Molecular and Cellular Endocrinology,2012,359(1/2):101-106.
[3]Jones K,Mansell A,Patella S,et al. Activin a is a critical component of the inflammatory response,and its binding protein,follistatin,reduces mortality in endotoxemia[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(41):16239-16244.
[4]Apostolou E,Stavropoulos A,Sountoulidis A,et al. Activin-A overexpression in the murine lung causes pathology that simulates acute respiratory distress syndrome[J]. American Journal of Respiratory and Critical Care Medicine,2012,185(4):382-391.
[5]Rabinovici J,Spencer S,Jaffe R. Recombinant human activin-A promotes proliferation of human luteinized preovulatory granulosa cells in vitro[J]. The Journal of Clinical Endocrinology and Metabolism,1990,71(5):1396-1398.
[6]Boitani C,Stefanini M,Fragale A,et al. Activin stimulates Sertoli cell proliferation in a defined period of rat testis development[J]. Endocrinology,1995,136(12):5438-5444.
[7]方胜英,王华,曾令兰,等.激活素A对人肝星状细胞系LX-2细胞增殖的影响[J].临床消化病杂志,2012,24(2):88-90,93.
[8]Trendelenburg A,Meyer A,Jacobi C,et al. TAK-1/p38/nNFκB signaling inhibits myoblast differentiation by increasing levels of Activin A[J]. Skeletal Muscle,2012,2(1):3.
[9]Chen J,Walton K,Winbanks C,et al. Elevated expression of activins promotes muscle wasting and cachexia[J]. FASEB Journal,2014,28(4):1711-1723.
[10]Cyranoski D. Super-muscly pigs created by small genetic tweak[J]. Nature,2015,523(7558):13-14.
[11]Qian L,Tang M,Yang J,et al. Targeted mutations in myostatin by zinc-finger nucleases result in double-muscled phenotype in Meishan pigs[J]. Scientific Reports,2015,5:14435.
[12]Bryson-Richardson R,Currie P. The genetics of vertebrate myogenesis[J]. Nature Reviews Genetics,2008,9(8):632-646.
[13]Buckingham M,Rigby P. Gene regulatory networks and transcriptional mechanisms that control myogenesis[J]. Developmental Cell,2014,28(3):225-238.
[14]Loh Y,Wu Q,Chew J,et al. The Oct4 and nanog transcription network regulates pluripotency in mouse embryonic stem cells[J]. Nature Genetics,2006,38(4):431-440.
[15]Chen L L,Carmichael G G. Altered nuclear retention of mRNAs containing inverted repeats in human embryonic stem cells:functional role of a nuclear noncoding RNA[J]. Molecular Cell,2009,35(4):467-478.
[16]Walsh K,Perlman H. Cell cycle exit upon myogenic differentiation[J]. Current Opinion in Genetics & Development,1997,7(5):597-602.
[17]Dey B,Gagan J,Yan Z,et al. miR-26a is required for skeletal muscle differentiation and regeneration in mice[J]. Genes & Development,2012,26(19):2180-2191.
[18]Wei W,He H,Zhang W,et al. miR-29 targets Akt3 to reduce proliferation and facilitate differentiation of myoblasts in skeletal muscle development[J]. Cell Death & Disease,2013,4:e668.
[19]Zhao Q,Kang Y,Wang Hong,et al. Expression profiling and functional characterization of miR-192 throughout sheep skeletal muscle development[J]. Scientific Reports,2016,6:30281.
