注重开放式教学, 培养学生创新能力
2015-11-12海丰县彭湃中学陈贤溢
文海丰县彭湃中学 陈贤溢
注重开放式教学, 培养学生创新能力
文海丰县彭湃中学 陈贤溢
中学化学课堂教学是学生认识化学世界、了解化学基本知识、提高化学素养的主渠道,教师除了传授化学基础知识、基本技能外,还应注重培养学生的创新思维。在教学中我们该怎样结合学科特点,有意识地、不失时机地对学生进行开放式问题教学呢?
一、问题解答途径的开放性
例如:过氧化钠使品红褪色的原理是什么呢?同学们纷纷猜想问题的答案:
猜想一:过氧化钠与水反应生成的氢氧化钠使品红褪色。
猜想二:过氧化钠使品红褪色的原理是由于过氧化钠具有强的氧化性。
教师整理好各种猜想后,接着启发学生在猜想的基础上进行合理的假设:
假设一:只将氢氧化钠加入到品红溶液中,也能使品红褪色。
假设二:氢氧化钠没有强氧化性,所以氢氧化钠使品红褪色效果应为暂时性褪色。
假设三:如果猜想二是正确的,则过氧化钠使品红褪色效果为永久性褪色。
教师检查学生的实验方案,给予适当的指导。
实验一:将少量的过氧化钠加入放有适量水的试管中,振荡,使其充分反应,反应后的溶液为氢氧化钠溶液,将此溶液滴入到品红溶液中,观察现象。
现象:品红溶液褪色。
结论:氢氧化钠能使品红褪色。
实验二:往实验一所得到的溶液中逐渐滴加稀盐酸(中和氢氧化钠),观察现象。
现象:溶液恢复红色。
结论:氢氧化钠使品红褪色效果为暂时性褪色。
实验三:往已经用过氧化钠褪色过的品红中逐渐滴加盐酸,观察现象。
现象:没有明显现象。
结论:过氧化钠使品红褪色效果为永久性褪色。
让学生对整个科学探索过程的各个环节进行推敲,思考是否存在逻辑性和科学性的错误。有的同学提出,猜想中忽略考虑过氧化钠与水反应还生成氧气这种物质,氧气能否使品红褪色呢?这个问题引起了同学们的强烈兴趣,激发他们进一步探索。
二、问题解答方法的开放性
例:向100mL的FeBr2溶液中通入标准状况下的Cl23.36L全部被还原,测得溶液中[Br-]=[Cl-],则原FeBr2溶液的物质的量浓度是多少?
此题是一道有关氧化还原反应的计算题,审题过程中要引导学生抓住关键:Cl2全部被还原,溶液中[Br-]=[Cl-],再根据反应2Fe2++Br2= 2Fe3++2Br-,可确定还原性Fe2+>Br-;即FeBr2中Fe2+全部被氧化,Br-部分被氧化,抓住这两条主线,从不同的角度分析,就得到多种解题方法。
解法一:电子得失守恒
在氧化还原反应中,氧化反应得电子总数与还原反应失电子总数是相等的,设FeBr2物质的量浓度为x mol·L-1,氧化剂得电子总数=还原剂失电子总数,即Cl2得电子总物质的量=Fe2+失电子总物质的量加部分Br-失去电子的物质的量。
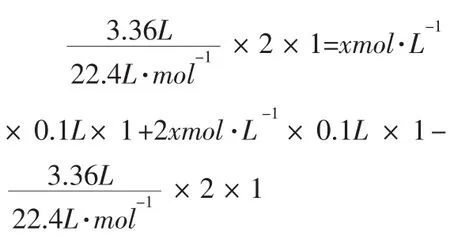
x=2mol·L-1
解法二:原子守恒
将质量守恒定律拓展到元素的原子守恒,此题涉及到氯、溴、铁三种元素的原子,分析
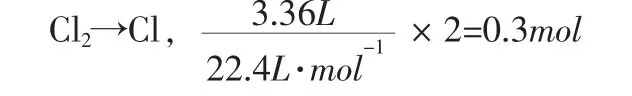
又知[Br-]=[Cl-],即反应后溶液中[Br-]也是0.3mol。则:
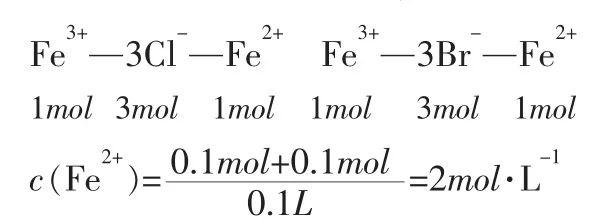
解法三:方程式法
运用逆向思维的方法,依反应后溶液中[Br-]=[Cl-]这一条件,可知生成物中n(FeCl3)∶n(FeBr3)= 1∶1,由此写出反应方程式为:x FeBr2+y Cl2=FeCl3+FeBr3+z Br2,由Fe、Br、Cl守恒得:x=2,y=3/2,z=1/2;即4FeBr2+3Cl2=2FeCl3+ 2FeBr3+Br2,设原溶液中FeBr2的物质的量为nmol,则:
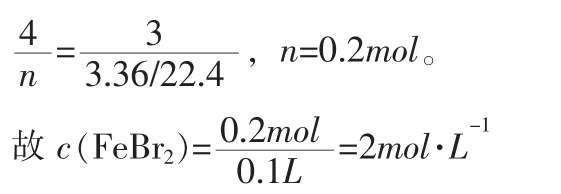
本题除上述三种主要解法外,还有些大同小异的解法。一题多解,即在解答问题时,有意识地从不同角度,不同层次,运用不同方法进行分析研究,并指出其中的最佳方法,可以达到捷径通幽,异曲同工之妙。
责任编辑 潘孟良
