利用数字化实验探究品红褪色与颜色复原机理*
2023-01-04廖志刚楼蕴霄刘凯馨
廖志刚 楼蕴霄,3 刘凯馨 辛 欣
(1.哈尔滨师范大学化学化工学院 黑龙江 哈尔滨 150025;2.哈尔滨师范大学教师教育学院 黑龙江 哈尔滨 150025;3.衢州市仲尼中学 浙江 衢州 324000;4.哈尔滨剑桥学院 黑龙江 哈尔滨 150000 )
在中学阶段,二氧化硫的漂白性是二氧化硫性质学习中的一个重点与难点,要求学生能够利用二氧化硫对品红溶液的暂时性漂白特点检验二氧化硫气体。人教版高中化学教材中“二氧化硫的漂白作用”实验,是向二氧化硫的水溶液中滴加品红、溶液褪色、随后加热颜色复原,通过这一过程来证明二氧化硫的漂白机理,即因二氧化硫与某些有色物质生成了无色不稳定的物质,这些无色物质加热后易分解从而使溶液恢复成原来的颜色。对这一过程的反应机理,教材并未进行深入讨论,且部分描述不够准确,例如:实际上与品红反应的并非是二氧化硫气体,而是二氧化硫与水反应生成的亚硫酸氢根与品红发生了加成反应。[1]通过数字化实验的引入,使抽象内容直观化,强化教学的直观性,有助于学生加深对化学反应的现象和本质原理的理解,并促进学生化学学科核心素养的养成。
一、实验原理探析
品红,别名盐酸副玫瑰苯胺,是一种较为常见的染料。在高中阶段的化学教学中,我们通过实验验证二氧化硫的漂白性,向装有二氧化硫的水溶液试管中滴加品红,随后加热,通过观察这一过程的颜色变化来证明二氧化硫具有漂白作用。
反应原理如图1所示。
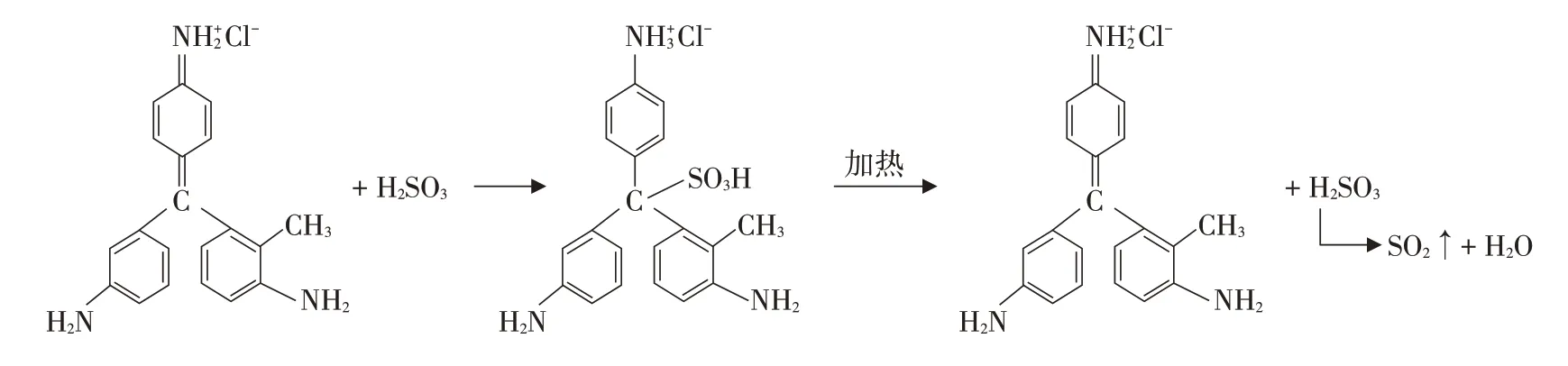
图1 二氧化硫漂白品红反应原理[2]
SO2+H2OH2SO3
二氧化硫使品红褪色机理有多种解释,普遍认为是SO2与H2O 反应生成H2SO3,生成的H2SO3与品红反应生成不稳定无色物质,二氧化硫气体无法与品红直接发生反应。品红的颜色来自于生色基团——醌式结构,二氧化硫与水生成的亚硫酸与醌式结构中的共轭碳碳双键发生了加成反应进而破坏了该结构,所以溶液的红色消失。[3]
二、实验预设问题与预期效果
1.预设问题
其一,选择合适的品红种类。品红分为酸性品红和碱性品红,因此我们要选择一种更加适合于该实验的品红。查阅文献可知,我们在高中化学实验中所用的品红为碱性品红,同时碱性品红更易与二氧化硫水溶液反应,由于磺酸基不稳定,加热易脱去,所以,品红溶液颜色更易恢复,因此,初拟定使用碱性品红进行实验。[4]
其二,品红褪色方法的选择。二氧化硫是一种有毒的刺激性气体,若直接通入品红溶液中所需的时间较长,且由于二氧化硫溶于水的速度大于亚硫酸与品红反应速度,因此,反应后的溶液中容易溶解有大量二氧化硫气体,在实验过程中造成二氧化硫气体的逸出,不利于实验的进行。此外,制备二氧化硫气体的过程中,气体流入的速率与量的稳定性难以准确控制,在做对照实验时反应条件难以准确控制变量,因此,最好选择其他更有效的褪色方法。根据上述实验原理可知,品红并不是与二氧化硫气体直接反应,可选用Na2SO3溶液使品红褪色。[5]
其三,影响颜色复原因素的确定。根据品红褪色原理,初步推断对品红颜色复原有影响的因素可能有以下三点:反应物的不同(二氧化硫气体和亚硫酸钠溶液)、品红种类的不同(酸性品红和碱性品红)、品红浓度的不同。因此,进行对照实验判断以上三点对品红颜色复原这一过程是否起促进或抑制作用。
2.预期效果
本实验主要对品红褪色机理和影响颜色复原的因素两部分内容进行研究。褪色机理部分主要通过数字化实验监测反应的进行,利用二氧化硫传感器检测装置内的二氧化硫浓度,判断二氧化硫气体是否与品红直接反应。之后通过对颜色的变化进行观察,从而判断反应速度的快慢。
3.仪器及药品
实验仪器:电导率传感器、二氧化硫传感器、pH传感器、计算机、数据采集器、铁架台、三颈烧瓶、集气瓶、试剂瓶、烧杯、玻璃棒、药匙、量筒、台秤、石棉网、打孔器、集气瓶、电热炉、注射器。
实验药品:酸性品红、碱性品红、浓硫酸、氢氧化钠固体、无水亚硫酸钠固体、蒸馏水。
三、实验操作的实施
1.实验条件的确定
(1)实验装置的确定
实验装置主要有两套,如图2所示(省略了部分连接装置与数字化实验设备)。第一套用于检验二氧化硫与品红是否能直接反应,需要反应生成二氧化硫气体,同时SO2是一种有毒的刺激性气体,需要一个尾气处理装置,防止SO2直接排放到空气中。整个装置大致分为三部分,第一部分用于二氧化硫气体的生成,第二部分进行二氧化硫与品红反应并进行相关数据的测定,第三部分为装有氢氧化钠溶液的尾气处理装置。整套装置要求处于密闭状态,选择在反应装置加入一个注射器,保证既能控制反应的发生与终止,又能使实验装置处于密闭条件。

图2 实验装置
第二套装置用于品红的颜色复原部分实验。该套装置要求能够满足在同一条件下进行稳定加热,若选择在酒精灯上直接加热,会由于加热部位不同、酒精灯火焰受环境影响晃动进而影响加热效率等因素干扰实验。故此装置选择使用水浴恒温加热,使用电热炉在同一功率下将水加热至一定温度,随后放入装有褪色后品红溶液的仪器进行加热,以确保不同组的加热效率一致。
(2)品红浓度的确定
查阅文献可知理论上本实验中品红的质量分数为0.01%较为合适,[6]浓度过高或者过低都不利于反应的进行。而本实验使用了电导率传感器,其测定范围为0.000~20.000 mS/cm,考虑到电导率的量程,若品红的浓度过低时可能无法测出其电导率,因此需要通过实验测出合适的浓度范围。
(3)二氧化硫的制备方式的确定
本实验通过亚硫酸钠晶体和浓硫酸反应生成SO2气体。[6]具体方式为:取一定质量的亚硫酸钠固体,滴入适量的蒸馏水,随后缓缓加入一定体积的浓硫酸进行反应。该反应过程中,向晶体滴加适量的蒸馏水有两个目的,一是因为浓硫酸吸水会放出大量的热,在促进反应进行的同时防止亚硫酸钠固体板结,减少药品的浪费;二是可以通过水的加入量的多少一定程度上控制反应速度,使得反应不会过于剧烈瞬间结束,能够在一段时间内持续反应生成SO2气体。
2.实验操作的实施
(1)预实验部分
第一步:确定品红的浓度。根据文献可知,推荐的品红的质量分数为0.01%,首先配制质量分数为0.01%的品红溶液,通过电导率传感器测量发现无法测出示数。随后配制质量分数为0.1%的品红溶液,重新测量能成功读出示数,证明0.1%质量分数的品红溶液可以用于数据采集。考虑到品红的溶解难度以及浓度过高对实验的不利影响,因此选用质量分数为0.1%的品红进行相关实验。
第二步:确定亚硫酸钠的用量。无水亚硫酸钠固体与浓硫酸反应后瞬间放出大量的二氧化硫气体,而实验中使用的二氧化硫传感器的浓度范围为0.00~20.00 pm,若反应所用的亚硫酸钠的量过多则会导致生成的二氧化硫气体浓度过高,超出传感器量程,采集的数据不准确。因此分别使用0.1 g、0.5 g、1.0 g 无水亚硫酸钠固体与浓硫酸反应测定其生成的二氧化硫浓度。其中0.1 g 的亚硫酸钠未超出量程,0.5 g 接近量程且在硫酸注入过快时迅速超出量程,放弃测量1.0 g的亚硫酸钠生成的二氧化硫气体。结论:选用更容易控制二氧化硫生成速率的0.1 g 无水亚硫酸钠固体进行实验。
(2)品红褪色机理实验的实施
第一步:二氧化硫气体与品红直接反应实验。
①配制质量分数约为0.01%的品红的醇溶液100 mL、浓度为0.5 mol·L-1的氢氧化钠溶液200 mL,分别装入两个集气瓶中。②根据图2组装实验装置,两个集气瓶中分别装有事先配制好的品红醇溶液和氢氧化钠溶液,注射器中吸有浓硫酸。③检查装置气密性,点燃酒精灯加热三颈烧瓶发现两个集气瓶中均有气泡,证明装置气密性良好。④点击打开DISLab8.0数字化实验软件,进入后点击“通用软件”模块,出现二氧化硫浓度示数,读数为“0”。⑤打开三颈烧瓶瓶塞,往三颈烧瓶中加入0.1g 无水亚硫酸钠固体,滴入少量蒸馏水(约2 mL)浸湿药品。塞好瓶塞。⑥回到数字化实验软件,点击“开始采集”按钮进行数据采集。随后通过注射器向三颈烧瓶中缓缓加入浓硫酸,发现浓硫酸与浸湿的无水亚硫酸钠混合后迅速发生反应,产生气泡。在20 s内缓缓滴加浓硫酸直至气泡不再产生。⑦当数据采集的曲线图中的二氧化硫浓度的数值未超过量程且趋于平稳后,迅速关闭两个止水夹。观察曲线变化,500 s 后停止,保存图像(见图3)。⑧拆除仪器并清洗,留下尾气处理的氢氧化钠溶液备用。

图3 二氧化硫浓度
第二步:品红与酸碱的反应。
①配制1 mol·L-1的氢氧化钠溶液50 mL,以及用浓盐酸与蒸馏水按1∶10稀释后获得的稀盐酸50 mL。②取质量分数为0.1%的酸性品红溶液40 mL于100 mL烧杯中,插入与采集器连接的pH传感器,使其探头完全浸没于溶液中,等待数值稳定。③点击“开始采集”进行数据采集。不断地缓慢滴加氢氧化钠溶液并振荡使其混合均匀,期间探头需浸入溶液。观察到溶液颜色稳定不再变化后,停止滴加等待一段时间。记录实验现象。④若颜色未变化,缓慢滴加稀盐酸,直至颜色变回红色且不再变化后停止滴加,等待一段时间颜色不变化。记录现象,保存数据图。⑤拆除仪器并清洗,放回原处。
第三步:探究影响品红褪色因素的实验。
①关于反应物(SO2气体与Na2SO3溶液)影响的探究。
配制质量分数为0.01%的品红溶液100 mL,质量分数为1%亚硫酸钠溶液100 mL,将亚硫酸钠溶液装入试剂瓶中。按照图1水浴加热装置进行组装,取一电热炉放上石棉网,在石棉网上放置一装有300 mL水的500 mL 大烧杯。使电热炉连接电源,并选择合适的加热功率,之后操作过程中加热功率不再改变。取50 mL的品红溶液倒入一洁净干燥集气瓶中,余下50 mL溶液留于100 mL烧杯之中,将该烧杯记作烧杯1。根据二氧化硫与品红直接反应的实验组装实验装置(去掉二氧化硫传感器与相关装置),将装有品红溶液的集气瓶替换原装有品红的醇溶液的集气瓶。检查装置气密性且气密性良好后,开始反应生成二氧化硫气体并使其通过品红溶液,待品红完全褪色后取出集气瓶,在通风橱中倒入另一干燥洁净的100 mL 小烧杯中,将该烧杯记作烧杯2。将烧杯2 放在通风橱中静置一段时间,等待溶液中溶解SO2基本逸出。向烧杯1中边缓慢滴加亚硫酸钠溶液边振荡,直至溶液恰好褪色且静置30 s 不变色。将烧杯1、烧杯2 中的溶液各取20 mL 加入到两个50 mL 的小烧杯中,使用试管夹固定两烧杯,同时开始水浴加热,并计时,观察两者颜色变化,记录颜色开始变化的时间与颜色稳定不变的时间。当两者颜色均不再变化时取出烧杯,结束实验。
②关于品红的种类(酸性品红与碱性品红)影响的探究。
分别配制质量分数为0.01%的酸性品红与碱性品红各100 mL。取25 mL酸性品红溶液于小烧杯中,边振荡边滴加亚硫酸钠溶液至溶液恰好褪色,且静置30 s后不再变化。使用试管夹固定后水浴加热,放入的同时开始计时,观察现象,记录下颜色开始变化与最终不变的时间点。取25 mL 碱性品红重复上述过程,记录整理实验现象。
③关于品红的浓度影响的探究。
配制质量分数为0.2%的品红溶液100 mL,随后取出50 mL 该溶液加入另一个小烧杯中,分别取出5 ml、25 mL、20 mL 该溶液进行稀释获得100 mL 0.01%、50 mL 0.1%、80 mL 0.05%的品红溶液,重复稀释操作,稀释40 mL 0.01%的品红得到80 mL 的0.005%的品红溶液。装于不同试剂瓶中。取25 mL质量分数0.2%的品红溶液置于50 mL小烧杯中,加入1 mL 亚硫酸钠溶液,摇晃使其混合均匀,观察到溶液变黄且颜色不再变化。使用试管夹固定该小烧杯,放入水浴中加热,放入的同时开始计时。观察颜色变化,记录颜色开始变化的时间与最终颜色不变的时间点。颜色不再变化后继续观察一段时间,无变化后结束实验,取出小烧杯。另取质量分数为0.1%、0.05%、0.01%、0.005%的品红溶液重复上述实验操作。整理记录的实验现象与数据,拆除、清洗仪器。
四、实验现象、数据与分析
1.品红褪色机理实验
(1)二氧化硫气体与品红直接反应
实验开始后,随着浓硫酸的加入,三颈烧瓶中先有大量气泡产生,20 s 后亚硫酸钠固体完全消失,气泡基本不再产生。如图3所示,二氧化硫浓度稳定在4.27 ppm附近便不再变化。在第240 s关闭止水夹后,可以将二氧化硫传感器与品红的醇溶液看为一个整体,二氧化硫的气体浓度直至500 s 反应结束未发生较为明显的下降趋势,观察集气瓶1也未发现品红醇溶液颜色变化,因此可以判断二氧化硫气体并不能与品红直接发生反应。
(2)品红与酸碱反应
结合图4,随着氢氧化钠溶液的滴加,品红颜色先是不变,后在将要达到pH=12时逐步转变为较为明显棕黄色,继续滴加后溶液变为淡黄色,此时的pH=13.17,之后滴加、静置也不再发现明显变化。静置至1000 s,溶液仍未发现明显变化,继续滴加稀盐酸,溶液颜色逐渐变深,1150 s时暂停加入,观察现象,溶液仍呈黄色,继续滴加溶液逐渐变回红色,但与反应开始时相比颜色稍浅一些,后再滴加也不再变化,静置至1500 s颜色未明显变化,实验停止。由此判断对酸性品红而言,溶液的酸碱性会对颜色造成影响,碱性过高(pH >12)时,溶液褪色变为黄色,酸性则对颜色无明显影响。
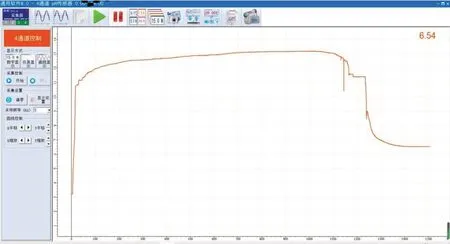
图4 品红和酸与碱反应pH图
2.影响颜色复原因素
(1)反应物(二氧化硫气体与亚硫酸钠溶液)的影响
由于肉眼观察颜色变化容易造成误差,因此,将结束时间选定为一个范围,在观察15 s后未发现明显变化,则认为溶液颜色在开始观察的前10 s到观察的时间这一范围内已经不再变化。
由表1可得,相对于亚硫酸钠溶液而言,二氧化硫气体造成的品红褪色更易褪去,且能较好地恢复到原来的颜色,而亚硫酸钠溶液较难使品红恢复到原来的颜色,颜色更浅,由于亚硫酸钠溶液只加入了2~3滴,对溶液的稀释作用可以忽略不计,亚硫酸钠与品红形成的产物可能更加稳定的原因与体系的pH有关。

表1 SO2气体与Na2SO3溶液对颜色复原的影响
(2)品红种类的影响
根据表2 数据可得,酸性品红与碱性品红对品红的颜色复原这一过程有较大影响,酸性品红相对于碱性而言更容易发生颜色的复原。根据酸性品红结构推测,影响酸性品红颜色的共轭结构随着溶液的酸碱性的变化而恢复,在酸性条件下产物的稳定性更弱,更容易恢复共轭结构,颜色也更容易复原。

表2 酸性品红与碱性品红对颜色复原的影响
(3)品红浓度的影响
观察表3可以发现,品红的浓度对颜色复原的速度和复原后的颜色有所影响,当浓度过高或过低时都对品红的复原起抑制作用,而颜色则随着浓度的降低而变淡,当浓度过低时会严重干扰对颜色变化起点和终点的判断。总的来说,品红的浓度对品红的复原实验有较大的影响,设计实验时要选择合适的浓度范围。

表3 品红浓度对颜色复原的影响
3.问题与优化
(1)组装实验装置时发现二氧化硫传感器口径过大,难以找到合适的装置组装并与其他装置相连接。经过多次的选择与尝试,最终选择将二氧化硫传感器与下端无底的集气瓶相连接。在无底集气瓶瓶口抹上凡士林,插入二氧化硫传感器,在下端塞上打孔的胶塞,用导管与装置相连接,此方法能较为有效测出装置内的二氧化硫浓度,且能保证装置的气密性。
(2)实验过程中发现碱性品红不利于数据采集与后续实验。碱性品红固体微溶于水,理论上溶解度为1%,但实际操作过程中即使是质量分数为0.1%的溶液都难以配制,0.1 g的碱性品红在加热条件下也无法在100 g水中完全溶解,因此,只能配制浓度更低的品红溶液(0.01%),无法配制更高浓度范围的溶液,且此浓度下电导率过低不利于实验的进行。因此,后续实验改进为使用更易溶解的酸性品红。
(3)实验现象与预期不符。根据文献描述,酸性品红与碱溶液混合后应呈现无色,然而实际操作过程中发现两者混合时呈棕黄色。查阅其他资料发现,只有当极稀的酸性品红水溶液(1∶10000)与浓氢氧化钠溶液混合时为无色。[7]后用质量分数约为0.001%的酸性品红与高浓度氢氧化钠混合时溶液颜色变为无色,判断药品未变质。继续实验后发现混合后的颜色与品红浓度有关,浓度越高,颜色呈现明显的黄色,推测两者混合后的溶液颜色与品红浓度有关,浓度越低颜色越不明显,因此,实验时尽量选用浓度更低的品红溶液进行实验,减少颜色的干扰。
(4)颜色复原部分实验数据系通过肉眼判断颜色的变化获得,通过颜色的变化记录时间,对于起点和终点的判断没有明确标准,此过程中容易造成读数误差。在数据分析阶段,若两个数据时间相差在10~15 s以内,则可以认为存在读数误差,两者时间接近。
五、教学中的应用分析
在中学阶段,以学生的知识储备,理解品红褪色的机理是有一定难度的,教材要求学生简单地理解二氧化硫使品红褪色机理,并能以此作为判断是否有二氧化硫气体的依据。本文尝试将传统的定性实验改进为数字化实验的定量实验,利用数字化实验能够即时反馈并以直观的变化曲线表现的特点,将品红褪色的过程以数据的形式表现,但在实际的实验操作过程中仍发现许多现阶段无法解决的问题。若这些问题能加以解决,本实验作为对课本知识的深化与拓展,有助于加深学生对“结构决定性质”这一重要化学原理的理解,引导学生以“宏观表征→符号表征→曲线表征→微观表征”的顺序形成新的认知发展线路,使学生熟知和掌握“四重表征”之间的相互转换关系,[8]提高学生的化学学科素养。随着仪器设备的发展,数字化实验与化学教学的联系将更加紧密,在提高学生化学核心素养方面将发挥更为重要的作用,化学教师可尝试对传统实验进行创新和改进,将数字化实验与化学教学有机结合。

