产脑苷脂鸡枞菌Termitomyces clypeatus CTM-1的分子生物学鉴定及生长特性研究
2015-11-11花卫俊缪冶炼陈介余尤业兵袁丽红
花卫俊,缪冶炼,陈介余,尤业兵,孙 唱,袁丽红,许 琳
(1.南京工业大学 食品与轻工学院,江苏 南京 211800;2.日本秋田县立大学 生物资源学部,日本 秋田 010-0195;3.南京工业大学 生物与制药工程学院,江苏 南京 211800)
产脑苷脂鸡枞菌Termitomyces clypeatus CTM-1的分子生物学鉴定及生长特性研究
花卫俊1,缪冶炼1,陈介余2,尤业兵1,孙 唱1,袁丽红3,许 琳3
(1.南京工业大学 食品与轻工学院,江苏 南京 211800;2.日本秋田县立大学 生物资源学部,日本 秋田 010-0195;3.南京工业大学 生物与制药工程学院,江苏 南京 211800)
脑苷脂A和B具有显著的镇痛作用和脑神经保护作用。鸡枞菌(Termitomyces clypeatus)子实体含有脑苷脂A和B,但是野生鸡枞菌子实体资源稀少。笔者在前期研究中以野生鸡枞菌子实体为原料,通过组织分离、菌种纯化及筛选,培育出菌株CTM-1。本研究中,采用分子生物学方法鉴定了菌株CTM-1与鸡枞菌的菌种同源性,测定了该菌株平板培养、液体培养中菌丝体的生长速率和脑苷脂含量。实验结果表明:菌株CTM-1及其出发野生子实体与Termitomyces clypeatus的同源性为99%。在PDAY平板培养中,菌落直径的增长速率在27 d内基本稳定在1.5 mm/d。比菌落直径增长速率在1 d时为0.21 d-1,然后逐渐下降。在DPt液体培养中,9 d以后为菌丝体生长的稳定期,此时的生物量为3.57 g/L。比菌丝体生长速率在1 d时为2.00 d-1,然后逐渐下降。菌丝体的脑苷脂A、B含量分别为0.152%、0.066%。由此可见,鸡枞菌CTM-1的大规模培养可以成为脑苷脂A、B原料生产的有效途径。关键词:鸡枞菌;菌丝体;脑苷脂;平板培养;液体培养
脑苷脂是单糖或低聚糖与神经酰胺末端羟基结合所形成的一类化合物,是动物、植物、真菌和海洋生物细胞膜/壁的结构成分。脑苷脂在细胞分化、细胞凝集、细胞骨架的迁移、跨膜信号转导等方面发挥重要的调节作用,还具有调控细胞生长、肿瘤抑制活性、免疫调节和神经保护、抗菌抗病毒等生物学活性[1]。
Qi等[2-3]从鸡枞菌子实体中成功分离出脑苷脂A~F。其中,脑苷脂A和B的结构式见图1。脑苷脂A和B作为新型镇痛药物,具有镇痛作用强、持续时间长、无明显副作用、没有药物成瘾和药物耐受反应等特点。通过腹腔注射、口服、皮肤涂抹等途径给药,都显示对神经性疼痛和炎性疼痛的镇痛作用,生物利用度高达46.7%[4]。此外,脑苷脂A和B能通过血脑屏障,减小缺血后的脑梗塞面积和神经细胞死亡,减轻脑水肿,促进脑卒中后运动和认知功能的恢复[5-7]。由于脑苷脂A和B对神经的多靶点具有保护作用,其治疗脑卒中的有效时间超过26 h[7-9]。
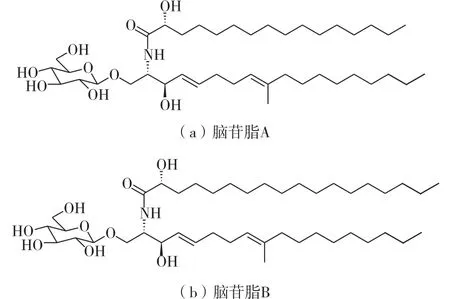
图1 脑苷脂A和B的结构式Fig.1 Structural formula of cerebroside A and B
为了防止世界上疯牛病发生对药物安全带来的危害,脑苷类化合物来源需要从动物脑组织转向植物、食用菌等。鸡枞菌是一种肉质细嫩、味道鲜美、营养丰富的野生珍稀食(药)用菌,但是鸡枞菌只能在贵州、云南、四川等省的山区生长,而且采收季节性强。另外,由于鸡枞菌与白蚁共生,其子实体仅能在白蚁巢上生长,至今还没有实现鸡枞菌子实体人工培养的产业化。因此,鸡枞菌资源稀少、价格昂贵。这些问题是脑苷脂A和B成药的瓶颈。
笔者在前期研究中以野生鸡枞菌子实体为原料,采用组织分离、菌种纯化及筛选的方法,培育出菌株CTM-1[10]。通过菌株 CTM-1的大规模培养,可以生产出制备脑苷脂A和B的菌丝体,克服野生鸡枞菌子实体生产在地域、季节和产量等方面受限制的困难。本研究采用分子生物学方法鉴定菌株CTM-1与鸡枞菌的菌种同源性。此外,为了探明该菌株的生长特性,测定平板培养、液体培养中菌丝体的生长速率和脑苷脂含量。
1 材料与方法
1.1 鸡枞菌子实体及菌种
新鲜鸡枞菌子实体采自云南省红河州建水县山区。用自来水清洗后,装入密封袋中,在-20℃条件下冻藏。使用前,分别用无菌水和75%乙醇和无菌水各清洗一次,作为子实体试样。
以新鲜鸡枞菌子实体为原料,通过组织分离、菌种纯化及筛选获得菌种CTM-1[10]。用接种钩将菌种接至PDAY斜面培养基上,在28℃下培养至菌丝长满斜面,置于4℃的冰箱中保存,并定期转接活化。
1.2 主要试剂
Wizard® Genomic DNA Purification Kit试剂盒,普洛麦格生物技术有限公司;NS1、NS4、Taq DNA聚合酶、dNTPs,宝生物工程(大连)有限公司。
1.3 培养基
PDAY培养基(g/L):马铃薯浸出粉15,葡萄糖20,酵母浸粉2,琼脂20。采用1 mol/L的柠檬酸调节pH至5.0,121℃灭菌20min,倒斜面及平板。
DPt液体培养基(g/L):葡萄糖20,蛋白胨10,MgSO40.75,KH2PO41.5。采用1 mol/L的柠檬酸调节pH至5.0,115℃灭菌30min。
1.4 分子生物学鉴定
采用分子生物学方法对子实体及菌丝体的菌种同源性进行鉴定。
1.4.1 菌丝体准备
用接种钩挑取斜面菌种接入装有200mL液体培养基的500mL三角瓶中,在28℃、150r/min条件下振荡培养5 d。培养结束后,进行发酵液的抽滤,收集菌丝体,分别用75%乙醇和无菌水各清洗1次,作为菌丝体试样。
1.4.2 基因组的提取
按照Wizard® Genomic DNA Purification Kit试剂盒说明书的方法,进行子实体和菌丝体基因组的提取。
1.4.3 18S rRNA的PCR扩增和测序
扩增引物采用通用引物(上游引物 NS1:5′-GTAGTCATATGCTTGTCTC-3′;下游引物NS4:5′-CTTCCGTCAATTCCTTTAAG-3′),采用 9700型PCR扩增仪(北京麦百金科技有限公司)进行子实体和菌丝体基因组的18S rRNA扩增。PCR反应体系:4μL dNTP、5μL 10×Taq buffer(Mg2+free)、2μL NS1、2μL NS4、2μL模板DNA、1μL Taq酶,用超纯水定容至50μL;PCR反应条件:98℃预变性 5min、98℃变性10 s、55℃退火30 s、72℃延伸60 s、30个循环、72℃延伸10min。
PCR扩增产物的检验通过琼脂糖凝胶电泳进行。琼脂糖凝胶电泳中,琼脂糖质量浓度为8 g/L,电泳电压为190 V,缓冲液为TBE缓冲液,时间为15min。
18S rRNA序列分析根据Sanger双脱氧链终止法,采用ABI 3730型DNA测序仪(天津金思德生物有限公司)进行。
1.4.4 18S rRNA进化树的构建
利用序列局部相似性查询系统BLAST(美国国立生物技术信息中心),将子实体、菌丝体的18S rRNA序列与GenBank数据库(美国国立生物技术信息中心)中的所有序列进行比较,找出序列相似的菌种,并用MEGA4.1软件进行匹配排列,用邻接法构建系统进化树。
1.5 平板培养
用孔径5 mm的无菌打孔器从平板菌落边缘部取出菌丝长势均匀、直径为5 mm的圆形菌块,接入新的PDAY平板培养基,每个平板培养基上接3个菌块。28℃恒温培养,定期用十字交叉法测量菌落直径,观察菌落颜色形态和长势。每次菌落直径测定采用9个试样,取平均值和标准偏差。
1.6 液体培养
用孔径5 mm的无菌打孔器从平板菌落边缘部取出长势均匀的圆形菌落,接入装有200mL液体培养基的500mL三角瓶中,每瓶接3个菌落。在28℃、150r/min条件下培养3 d,作为种子液。此时,种子液中的菌体呈短小、均匀的菌丝状,有利于提高种子液转接时接种量的均匀程度。
将种子液按体积分数10%的接种量接入装有30mL液体培养基的150mL三角瓶中,共接18瓶。在28℃、150r/min条件下培养10 d。从第2天开始,每天取出2瓶发酵液,抽滤,收集菌丝体,在105℃下干燥4 h,测量菌丝体干质量。
1.7 脑苷脂含量测定
1.7.1 试样处理
称取菌丝体(或子实体)试样1.0 g、石英砂3.0 g于研钵中,加入甲醇5mL,于冰浴中研磨10min。将匀浆全部移入试管中,加入20mL的二氯甲烷-甲醇溶液(体积比1∶1),在室温条件下超声处理2 h,静置。浸提液用0.45μm滤膜过滤,在旋转蒸发仪上浓缩至适当体积,作为提取物。取提取物1mL,再用等体积的二氯甲烷-甲醇溶液稀释适当倍数,作为测试液。
1.7.2 液相色谱-质谱分析
测试样的脑苷脂A和B含量采用LC-MS/MS系统,LC-10AD型液相色谱仪(LC),日本岛津公司;API 3000型质谱(MS),美国AB SCIEX公司)进行测定。
1)液相色谱分析条件 色谱柱为Agela Venusil XBP C8(50 mm×2.1 mm,5μm);柱温为室温;流动相A为甲酸和10 mmol/L甲酸铵溶液(体积比1∶999);流动相B为甲酸和甲醇(体积比1∶999);洗脱按表1程序进行梯度洗脱;进样量10μL。
2)质谱分析条件 电喷雾离子源(ESI);正离子模式;离子喷雾电压3 000 V;离子源温度400℃;多反应监测(MRM)扫描方式。
脑苷脂A和B的标准品按文献[8]制备,其纯度为99.5%。采用100%甲醇溶液,制备质量浓度分别为4、20、80、200、500、1 000和2 000 ng/mL的脑苷脂A标准品溶液,质量浓度分别为25、50、150、300、400、500、600和750 ng/mL的脑苷脂B标准品溶液。以离子流信号强度的峰面积为纵坐标,以浓度为横坐标,绘制各成分含量测定用的标准曲线。
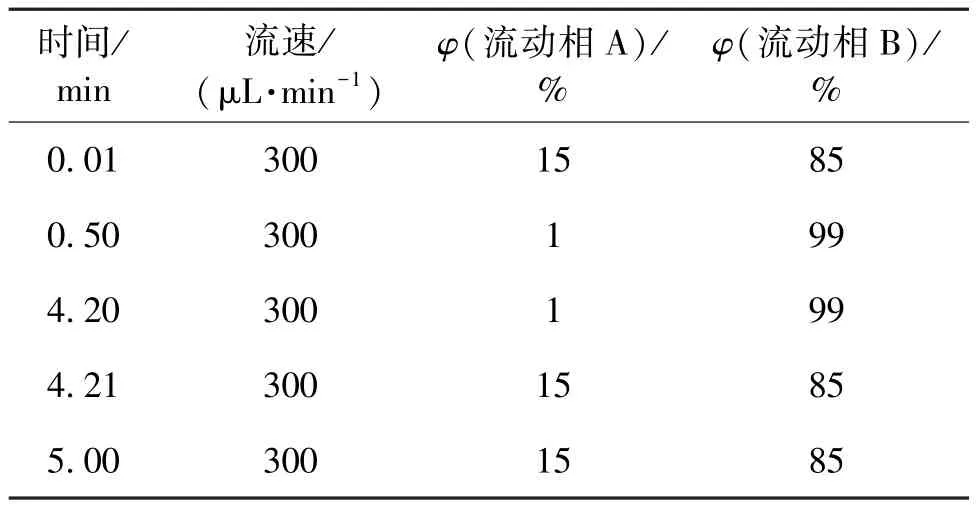
表1 液相色谱洗脱程序Table 1 Elution schedule in HPLC
在脑苷脂A质量浓度0~2 000 ng/mL的范围内,峰面积与脑苷脂A浓度之间的关系见式(1)。
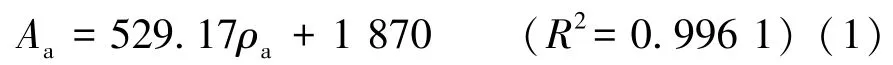
式中:Aa为脑苷脂A的峰面积,counts;ρa为脑苷脂A的质量浓度,ng/mL。
在脑苷脂B质量浓度0~750 ng/mL的范围内,峰面积与脑苷脂B质量浓度之间的关系见式(2)。
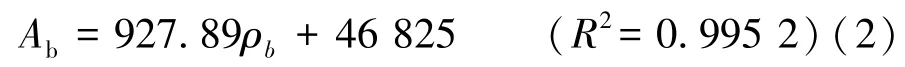
式中:Ab为脑苷脂B的峰面积,counts;ρb为脑苷脂B的质量浓度,ng/mL。
1.7.3 脑苷脂含量计算
菌丝体和子实体中脑苷脂A或B的含量Mc分别以菌丝体、子实体的干物基准表示,其计算见式(3)。
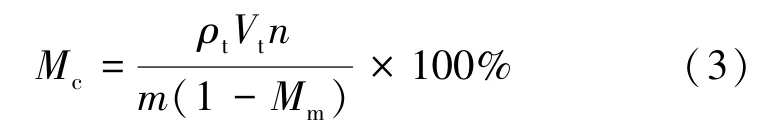
式中:ρt为测试液中脑苷脂 A或B的质量浓度,g/mL;Vt为测试液的体积,mL;n为稀释倍数;m为菌丝体或子实体试样的质量,g;Mm为菌丝体或子实体试样的湿物基准含水率。
2 结果与讨论
2.1 子实体和菌丝体的菌种同源性
对子实体和菌丝体的菌种同源性进行鉴定,结果如图2所示。由图2可知:子实体和菌丝体的18S rRNA片段大小一致,大约为1 500 bp。通过比对子实体和菌丝体的18S rRNA序列(登录号分别为KM657823、KM657824)发现,子实体和菌丝体的18S rRNA在478、479和480位点上有碱基差异。在这3个位点上,子实体的碱基分别为T(胸腺嘧啶)、A(腺嘌呤)和C(胞嘧啶),而菌丝体的碱基分别为C(胞嘧啶)、T(胸腺嘧啶)和A(腺嘌呤)。菌株CTM-1及其出发子实体(Fruiting body-5)均与盾尖鸡枞菌Termitomyces clypeatus有99%的同源性,菌株CTM-1与出发子实体(Fruiting body-5)之间也有99%的同源性。邻接法构建系统进化树(图3),从进化树看出本实验的子实体和菌株CTM-1均为盾尖鸡枞菌T.clypeatus。
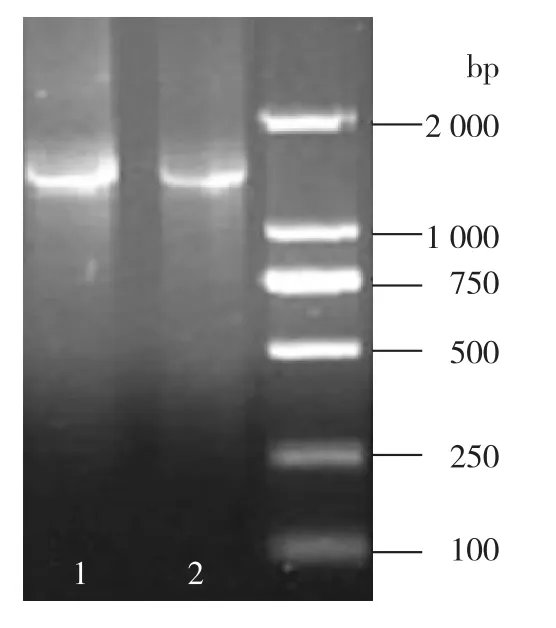
图2 子实体和菌丝体的18S rRNA电泳结果Fig.2 Electrophoresis of the 18S rRNA of fruiting body and mycelia
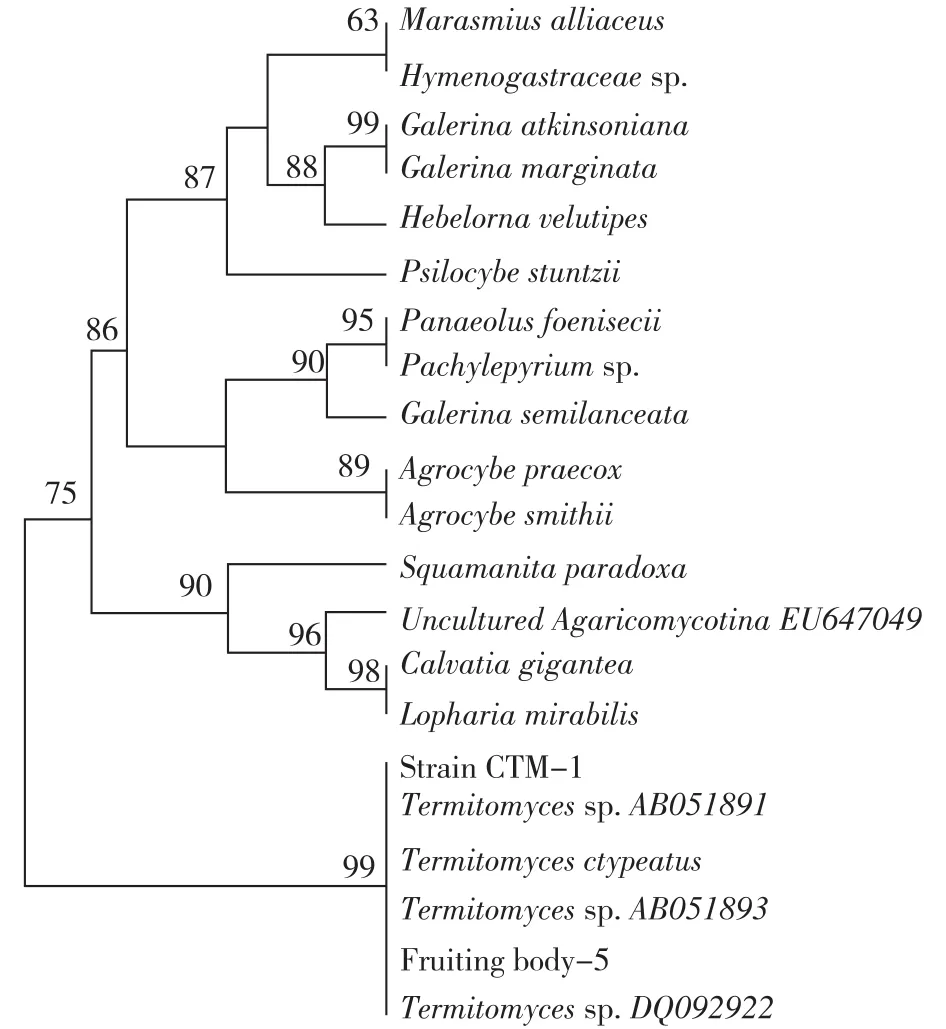
图3 基于18S rRNA序列及邻接法构建的系统进化树Fig.3 Phylogenetic tree based on 18S rRNA sequence and neighbor-joining method
食用菌菌种的鉴定主要有形态学方法和分子生物学方法。形态学方法主要根据子实体形态进行鉴定,而鸡枞菌子实体无法通过菌丝体的人工栽培获得,因此其菌丝体的菌种鉴定不能采用形态学方法。与形态学方法相比,分子生物学方法不但适用于子实体,而且还适用于菌丝体的鉴定,已被广泛应用[11-13]。笔者采用分子生物学方法,成功鉴定了菌株CTM-1及其出发子实体与盾尖鸡枞菌T.clypeatus的同源性,为鸡枞菌菌丝体的大规模培养提供了技术依据。
2.2 菌丝体的生长特性
图4为鸡枞菌CTM-1的菌丝体照片。由图4可知:菌丝体无色,分支较少,有横隔膜,未见锁状联合,菌丝体的直径约为5~7μm。
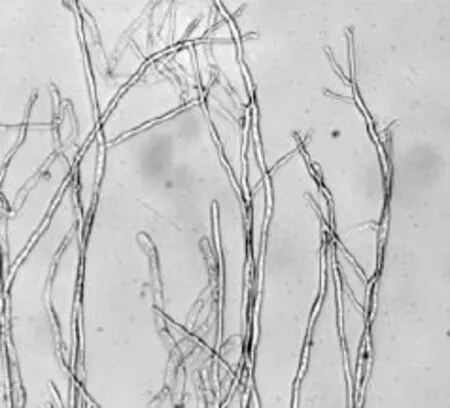
图4 鸡枞菌CTM-1的菌丝体照片(×600倍)Fig.4 Picture of the mycelia of T.clypeatus CTM-1(×600)
鸡枞菌CTM-1平板培养过程中,菌落直径及比菌落直径增长速率的变化如图5所示。由图5可知:菌落直径的增长速率在27 d内基本一定,然后逐渐下降。27 d时,菌落直径达到43.9 mm,培养期间的平均增长速率为1.5 mm/d。比菌落直径增长速率在1 d时为0.21 d-1,然后逐渐下降,27 d下降到0.02 d-1。据文献[14]报道,T.albuminosus、T.fulginosus、T.cylindricus、T.Aurantiacus和T.microcarpus等5种鸡枞菌在25℃、PDA平板培养基、30 d的培养条件下,菌落直径的平均增长速率分别为1.3、1.7、1.1、2.0和2.0 mm/d,而鸡枞菌10-1和鸡枞菌10-2在28℃、PDA平板培养基、30 d的培养条件下,菌落直径的平均增长速率分别为7.5和12.9 mm/d[15]。由此可见,平板培养中的菌落直径增长速率受到菌种和培养条件的影响。
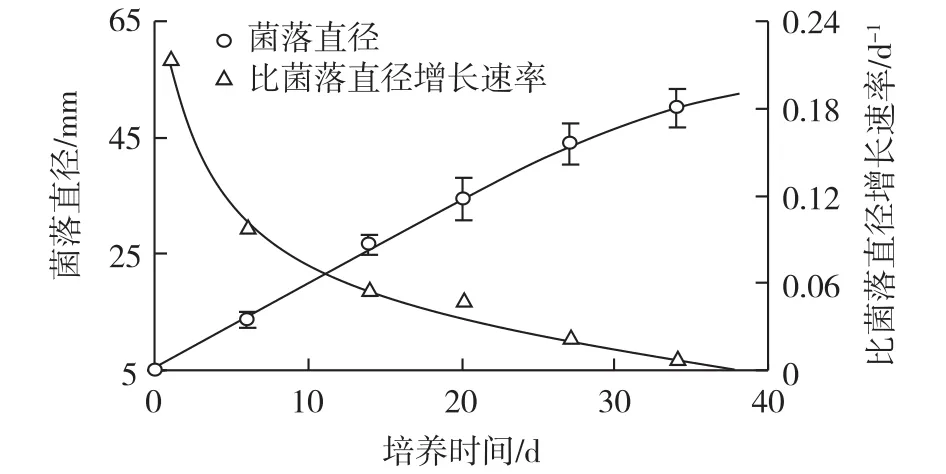
图5 鸡枞菌CTM-1平板培养过程中菌落直径及比菌落直径增长速率的变化Fig.5 Change of colony diameter and specific colonydiameter increasing rate in the plate culture of T.clypeatus CTM-1
图6为平板培养0、14和27 d时的菌落照片。在培养初期,菌落呈致密的绒毛状,匍匐生长在培养基表面,中部稍凸,边缘整齐,表面有褶皱。27 d后,随着菌丝体的老化,其颜色由纯白色转为棕色。总的来说,鸡枞菌平板培养的菌落可以分为菌丝型、孢子型和中间型[16]。鸡枞菌CTM-1的菌落特征与菌丝型一致。
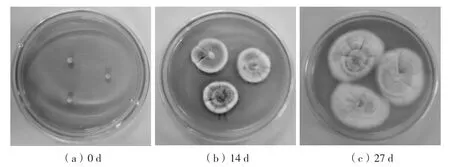
图6 鸡枞菌CTM-1在不同平板培养时间的菌落形态Fig.6 Colony morphology of T.clypeatus CTM-1 at different plate-culture time
鸡枞菌CTM-1液体培养过程中,生物量及比菌丝体生长速率的变化如图7所示。由图7可知:菌丝体生长可以分为0~2 d的延滞期、3~8 d的对数期以及9 d以后的稳定期。稳定期的生物量约为3.57 g/L。比菌丝体生长速率在1 d时为2.00 d-1,然后逐渐下降。
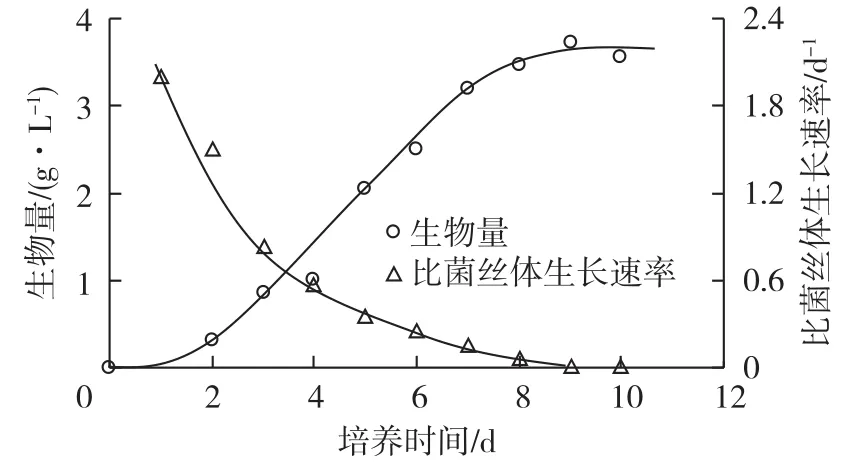
图7 鸡枞菌CTM-1液体培养过程中生物量及比菌丝体生长速率的变化Fig.7 Change of biomass and specific mycelium growth rate in the liquid culture of T.clypeatus CTM-1
2.3 菌丝体中脑苷脂A和B的含量
图8为脑苷脂A和B标准品的二级质谱图。脑苷脂A和脑苷脂B的相对分子质量分别为727和755。由图1可知,脑苷脂A和B均是由葡糖基与含氮的鞘氨醇及脂肪酸连接而成。图8(a)中,m/z= 728.6的峰为脑苷脂 A的[M+H]+。m/z=710.8、m/z=566.6、m/z=548.7和m/z=530.8的峰分别对应脑苷脂A的[M+H-H2O]+、[M+H-C6H10O5]+、[M+H-C6H12O6]+和[M+H-C6H12O6-H2O]+。图8(b)中,m/z=756.7的峰为脑苷脂B的[M+H]+。m/z= 738.6、594.5、576.5和558.7的峰分别对应脑苷脂B的[M+H-H2O]+、[M+H-C6H10O5]+、[M+H-C6H12O6]+和[M+H-C6H12O6-H2O]+,因此,用于脑苷脂A和B定量分析的离子对分别为m/z=728.6/548.7和m/z= 756.7/576.5。
菌丝体、子实体的脑苷脂A和B含量如表2所示。菌丝体通过鸡枞菌CTM-1的液体培养制备而成,子实体按照取样部位分为子实体菌柄和子实体菌盖。由表2可知,菌丝体的脑苷脂A和B质量分数分别为0.152%、0.066%,略低于子实体菌柄的0.266%、0.088%以及子实体菌盖的0.251%、0.077%。
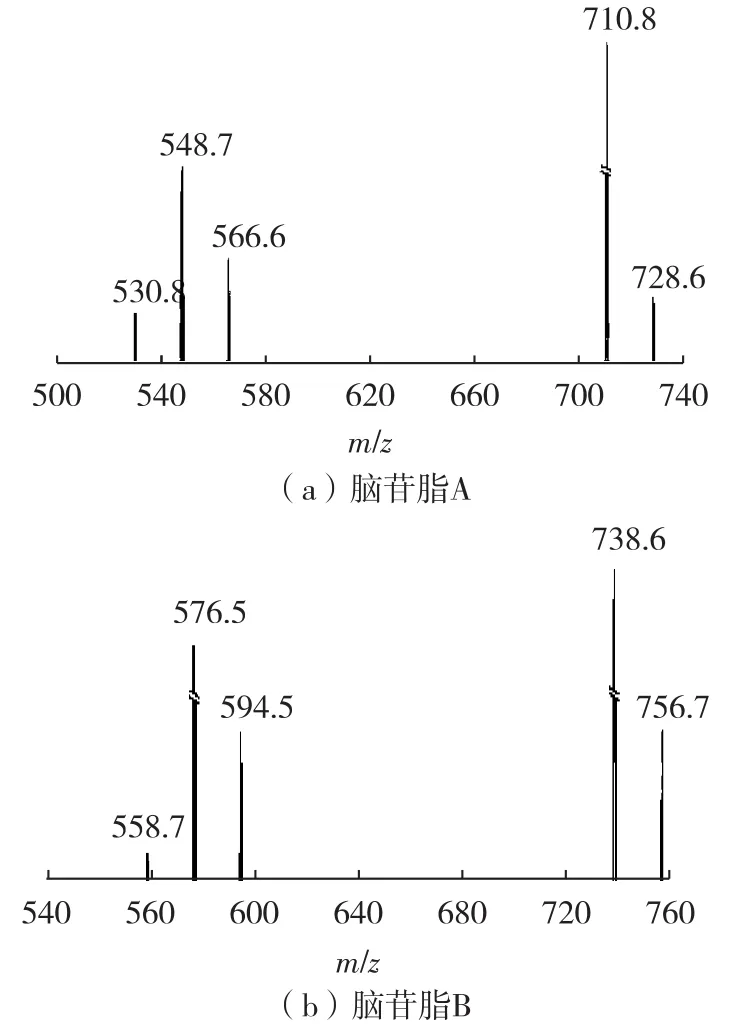
图8 脑苷脂A和脑苷脂B标准品的二级质谱图Fig.8 MS2spectra of cerebroside A and B standard
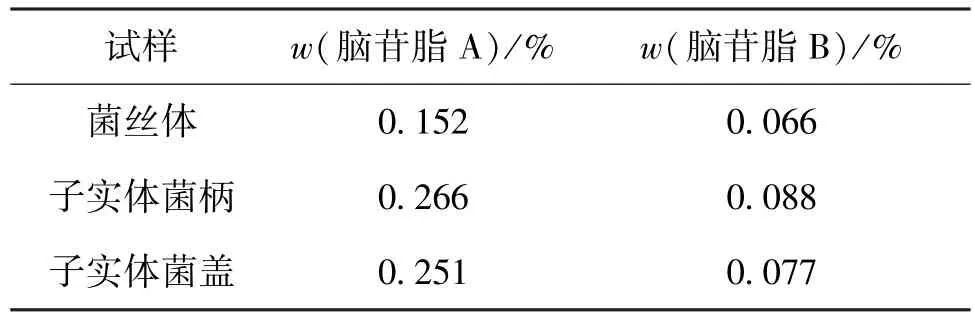
表2 菌丝体、子实体的脑苷脂A和B含量Table 2 Content of cerebrosides A and B in mycelia and fruiting body
菌丝体与子实体中脑苷脂含量的差异可能与鸡枞菌的生活史有关。鸡枞菌的生活史主要由以下几个阶段组成:①孢子萌发形成单核菌丝;②单核菌丝融合形成次生菌丝;③由次生菌丝发育成小白球、原基、假根、子实体[17-18]。与菌丝体相比,子实体中脑苷脂的含量较高。这表明在由菌丝体向子实体发育的阶段中,脑苷脂的合成仍在进行。此外,与其他微生物一样,鸡枞菌的生长和代谢受到培养条件的影响[19]。通过对培养基中碳氮源种类和浓度、无机盐浓度、pH、接种量、转速、装液量和温度等条件的优化,T.albuminosus JNPF-TA01胞内皂甙的产量由28.4 mg/L增加到59.5 mg/L[20]。在T. clypeatus的液体培养基中额外添加1%的葡萄糖并培养6~8 d后,发酵液中纤维二糖脱氢酶的浓度明显高于未添加葡萄糖时的浓度[21]。在T.clypeatus的液体培养基中添加0.1%的2-脱氧-D-葡萄糖后,发酵液的纤维二糖酶活力由1.44 U/mL提高到140.60 U/mL[22]。因此,为了提高鸡枞菌菌丝体中脑苷脂的含量,脑苷脂合成途径的解析、培养条件对菌丝体的生长和代谢的影响、菌丝体中脑苷脂合成的调控等将成为今后研究的主要内容。
3 结论
采用分子生物学方法鉴定了由笔者自行分离出来的菌株CTM-1与鸡枞菌的菌种同源性,测定了菌丝体的生长速率和脑苷脂含量。分子生物学鉴定结果表明,菌株 CTM -1为盾尖鸡枞菌(T.clypeatus),菌株CTM-1及其出发子实体与盾尖鸡枞菌的同源性为99%。在PDAY平板培养中,菌落直径的增长速率在27 d内基本稳定在1.5 mm/d,27 d后逐渐降低。比菌落直径增长速率在1 d时为0.21 d-1,然后逐渐下降。在DPt液体培养中,菌丝体生长可以分为0~2 d的延滞期、3~8 d的对数期以及9 d以后的稳定期,稳定期中的生物量为3.57 g/L。比菌丝体生长速率在1 d时为2.00 d-1,然后逐渐下降。菌丝体中脑苷脂A、B的质量分数分别为0.152%和0.066%。菌丝体中脑苷脂的含量有望通过培养条件的优化进一步提高。
[1]陈颖,吕洁丽,段金廒,等.从生物进化看脑苷脂类化合物的分布及其生物活性研究进展[J].国际药学研究杂志,2009,36(2):121-126.
[2]Qi J,Ojika M,Sakagami Y.Termitomycesphins A-D,novel neuritogenic cerebrosides from the edible chinese mushroom Termitomyces albuminosus[J].Tetrahedron,2000,56(32):5835-5841.
[3]Qi J,Ojika M,Sakagami Y.Neuritogenic cerebrosides from an edible chinese mushroom.part 2:structures of two additional termitomycesphins and activity enhancementofan inactive cerebroside by hydroxylation[J].Bioorg Med Chem,2001,9:2171-2177.
[4]陈玲,戚建华,缪冶炼,等.脑苷类化合物在制备镇痛药物中的应用:中国,201310272349.6[P].2013-12-04.
[5]Chi S,Cai W,Liu P,et al.Baifuzi reduces transient ischemic brain damage through an interaction with the STREX domain of BKCa channels[J].Cell Death and Disease,2010,1(1):1-11.
[6]Li L,Yang R,Sun K,et al.Cerebroside-A provides potent neuroprotection after cerebral ischemia through reducing glutamate release and Ca2+influx of NMDA receptors[J].Int J Neuropsychopharmacol,2012,15(4):497-507.
[7]陈玲,戚智,蔡维艳,等.一种保护缺血性脑损伤的白附子脂溶性成分提取物:中国,200910024861.2[P].2009-10-07.
[8]陈玲,戚建华,戚智,等.一种脑苷脂类化合物的应用:中国,200910154675.0[P].2010-05-12.
[9]陈玲,戚建华,戚智,等.一种脑苷脂B化合物的应用:中国,201110324561.3[P].2012-06-20.
[10]缪冶炼,花卫俊,陈玲,等.一株高产脑苷脂类化合物的鸡枞菌菌种及其菌丝体培养方法:中国,201410252645.4[P]. 2014-09-03.
[11]余仲东,张星耀,曹支敏.真菌核糖体基因间隔区研究概况[J].西北林学院学报,2000,15(2):107-112.
[12]刘作易.DNA指纹技术的发展及其在真菌分类上的应用[J].山地农业生物学报,2000,19(5):460-469.
[13]许学锋,林范学,林芳灿.中国香菇自然种质的 rDNA遗传多样性分析[J].菌物学报,2005,24(1):29-35.
[14]胡清秀.五种鸡枞菌的分离培养试验[J].食用菌学报,2000,7(3):43-47.
[15]曾先富,陈阳婷,熊维全,等.鸡枞菌菌丝体培养试验[J].食用菌,2012(6):9-11.
[16]龙正海,曾大兴.鸡枞菌培养特性的初步研究[J].食品与生物技术学报,2007,26(3):90-94.
[17]陈楚鋆,温志强.鸡枞菌生活史的研究[J].福建农林大学学报:自然科学版,1991(2):193-196.
[18]韦革宏,王卫卫.微生物学[M].北京:科学出版社,2008.
[19]张嗣良.发酵工程原理[M].北京:高等教育出版社,2013.
[20]聂晓东.鸡枞菌丝体及其皂甙的深层发酵条件的优化[D].无锡:江南大学,2009.
[21]Saha T,Ghosh D,Mukherjee S,et al.Cellobiose dehydrogenase production by the mycelial culture of the mushroom Termitomyces clypeatus[J].Process Biochem,2008,43(6):634-641.
[22]Suman K,Sumana M.Method for enhancing cellobiase activity of the novel strain Termitomyces clypeatus using 2-deoxy-D-glucose as glycosylation inhibitor:US,20020148009A1[P].2002-10-10.
(责任编辑 管 珺)
Identification and growth characterization of a cerebroside producing Termitomyces clypeatus CTM-1
HUA Weijun1,MIAO Yelian1,CHEN Jieyu2,YOU Yebing1,SUN Chang1,YUAN Lihong3,XU Lin3
(1.College of Food Science and Light Industrial Engineering,Nanjing Tech University,Nanjing 211800,China;2.Faculty of Bioresource Science,Akita Prefectural University,Akita 010-0195,Japan;3.College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China)
Cerebrosides A and B have significant effects of analgesia and brain protection.Fruiting bodies of Termitomyces contains cerebrosides A and B,but wild Termitomyces resources are scarce.In author′s previous work,a strain CTM-1 was developed by means of tissue isolation,strain purification and screening,using the fresh fruiting bodies of wild Termitomyces as raw material.In the present study,the sequence homology of CTM-1 and Termitomyces was identified with a molecular-biological method.The mycelium growth rate in plate and liquid culture,and the cerebroside content in mycelia were investigated for the strain CTM-1.It was shown that the stain CTM-1 and its parental fruiting bodies had a sequence homology up to 99%with Termitomyces clypeatus.In PDAY plate culture,the colony-diameter increasingrate was constant at 1.5 mm/d in the period between and 27 d.The specific colony-diameter increasing rate was 0.21 d-1at 1 d,and decreased gradually after then.In DPtliquid culture,the growth of mycelia entered the stable phase at 9 d,and the biomass was 3.57 g/L.The specific mycelium growth rate was 2.00 d-1at 1 d,and decreased gradually after then.The content of cerebrosides A and B in mycelia was 0.152%and 0.066%,respectively.Consequently,the large-scale culture of T.clypeatus CTM-1 can be considered as an effective way for the production of raw material containing cerebrosides A and B.
Termitomyces;mycelium;cerebroside;plate culture;liquid culture
Q939.99
A
1672-3678(2015)05-0067-07
10.3969/j.issn.1672-3678.2015.05.013
2014-10-08
国家重点基础研究发展计划(973计划)(2011CBA00807)
花卫俊(1990—),男,江苏盐城人,硕士研究生,研究方向:功能成分及功能食品;缪冶炼(联系人),教授,E-mail:ylmiao@njtech. edu.cn
